于健,邹迪莎,叶瑶,周素娴,郑天鹏,杨帆
T2DM小型猪模型骨骼肌、肝脏及胰腺组织蛋白激酶B表达及磷酸化的变化
于健1,邹迪莎2,叶瑶2,周素娴1,郑天鹏1,杨帆1
目的研究高脂高糖饮食联合链脲佐菌素(STZ)构建巴马小型猪2型糖尿病(T2DM)模型的可行性,并观察小型猪模型骨骼肌、肝脏及胰腺组织蛋白激酶B(PKB)表达及磷酸化变化。方法将健康雄性巴马小型猪10只随机分为2组:对照组5只,喂养普通饲料;糖尿病模型组5只,高脂高糖饮食联合STZ构建巴马小型猪T2DM模型。检测2组小型猪空腹血糖、空腹胰岛素水平,并计算胰岛素抵抗指数(HOMA-IR)。采用Western blot法检测骨骼肌、肝脏及胰腺组织中PKB蛋白表达及磷酸化水平。结果(1)高脂高糖饲料喂养10个月后,与对照组比较,模型组体质量、空腹血糖、空腹胰岛素水平及HOMA-IR明显升高(P<0.01)。(2)与对照组相比,模型组STZ给药后空腹血糖水平进一步升高,空腹胰岛素水平明显下降(P<0.01)。(3)与对照组比较,模型组骨骼肌、肝脏及胰腺组织中PKB蛋白表达及磷酸化水平明显降低(P<0.05)。结论高脂高糖饮食联合STZ多次腹腔注射可以成功构建T2DM小型猪模型,模型组小型猪骨骼肌、肝脏及胰腺组织PKB蛋白表达及磷酸化水平明显降低。
糖尿病,2型;蛋白激酶类;猪,雏型;肌,骨骼;肝;胰腺;巴马小型猪
随着社会经济的发展以及人们膳食结构和生活方式的改变,糖尿病(diabetes,DM)发病率明显上升,糖尿病已成为全球范围内致死、致残和医疗费用增加的重要因素。目前2型糖尿病(T2DM)的发病机制仍未完全清楚,其中胰岛素抵抗(insulin resistance,IR)在T2DM的发生发展中起重要作用。链脲佐菌素(streptozotocin,STZ)能够选择性地破坏某些种属动物胰岛的β细胞,导致糖尿病的发生。在考虑膳食在糖尿病发病进程的因素中,膳食诱导联合小剂量STZ的糖尿病造模技术已被广泛应用[1],但这种方法主要应用于啮齿类动物模型的复制,而大型动物模型如猪动物模型复制的报道较少。小型猪不仅许多器官系统与人类相似,而且价格也相对适中,是诱发糖尿病模型的理想动物[2]。蛋白激酶B(protein kinase B,PKB)是胰岛素作用主要的信号转导途径之一——磷脂酰肌醇3-激酶(PI3K)途径下游重要的丝氨酸/苏氨酸激酶,PKB能通过影响胰岛素的信号转导调节葡萄糖的摄取、糖原合成、糖酵解等胰岛素代谢反应。因此,本研究应用高脂高糖饮食联合STZ构建巴马小型猪T2DM模型,探讨该模型特征及骨骼肌、肝脏、胰腺组织PKB和磷酸化(P)-PKB蛋白的表达情况,以期为糖尿病研究提供稳定的动物模型。
1材料与方法
1.1主要试剂PKB及P-PKB一抗(CST公司),胰岛素放射免疫分析试剂盒(北京北方生物技术研究所),STZ(美国Sigma公司)。
1.2 T2DM小型猪模型的构建参照笔者以往的T2DM小型猪模型造模方法[3]:选择巴马小型猪10头(均为雄性),体质量10~20 kg,2~3月龄,适应性喂养1周后将小型猪按简单随机化方法分为2组(每组5头),模型组给予高脂高糖饲料喂养(高脂高糖饲料配方为蔗糖37%、猪油10%、胆固醇2%、普通饲料51%);对照组喂养普通饲料。2组动物喂养10个月,11个月初禁食空腹给予模型组动物腹腔注射STZ 100 mg/kg,1周后,重复上述剂量1次。对照组动物腹腔注射等剂量柠檬酸-柠檬酸钠缓冲液。各组继续维持原有饲料喂养,实验周期共12个月。成模标准:参照1999年世界卫生组织(WHO)糖尿病诊断标准。
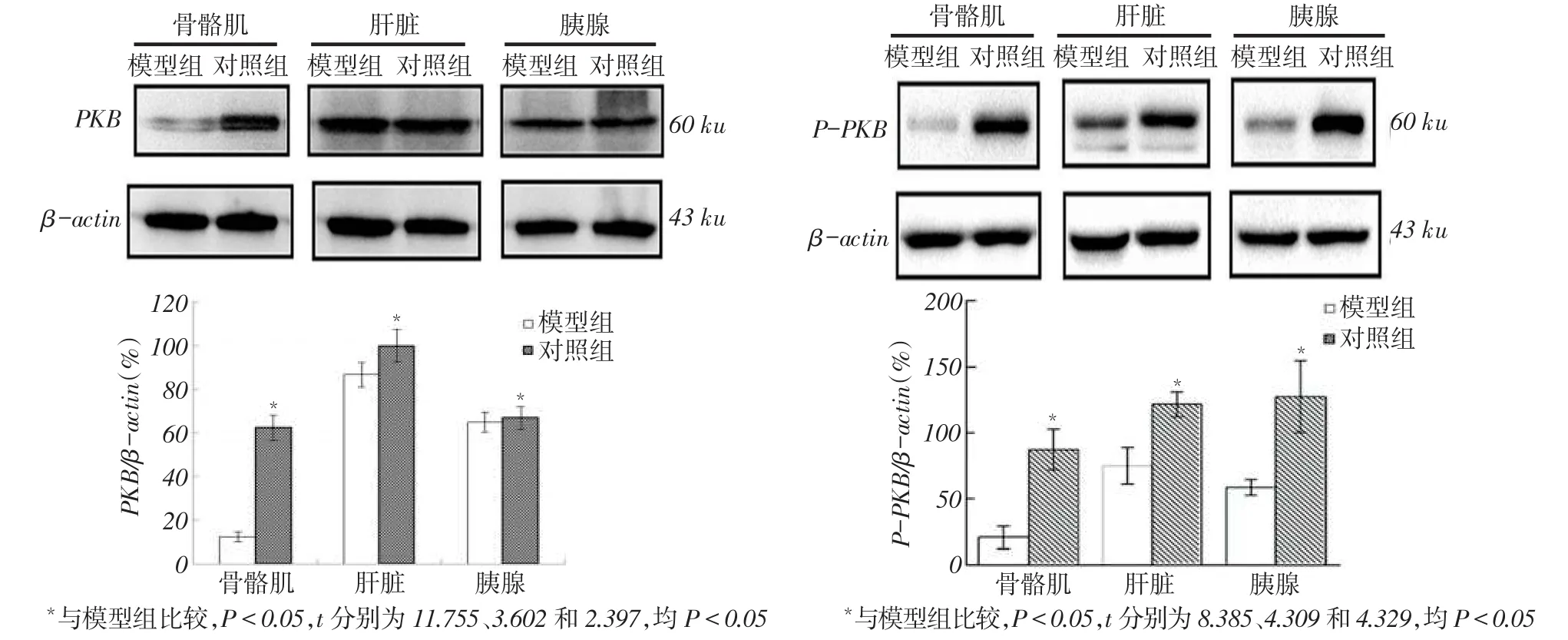
Fig.1 Comparisons of PKB and P-PKB protein expression in skeletal muscle,liver and pancreatic tissues between two groups图1 2组骨骼肌、肝脏及胰腺PKB及P-PKB蛋白表达比较
1.3空腹血糖、胰岛素水平检测小型猪禁食采血检测空腹血糖及空腹胰岛素水平,并计算胰岛素抵抗指数(HOMA-IR)。
1.4骨骼肌、肝脏及胰腺组织PKB及P-PKB蛋白表达检测小型猪禁食麻醉,股动脉放血处死,取胰腺、肝脏和骨骼肌组织,置于-70℃冰箱保存,参照文献[4]采用Western blot检测骨骼肌、肝脏及胰腺组织PKB蛋白表达及磷酸化水平。
1.5统计学方法数据采用SPSS 19.0软件统计分析,计量资料采用均数±标准差()表示,两样本均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组动物一般情况模型组均成模,成模小型猪毛发粗糙、无光泽,精神萎靡,并出现多尿、多饮、多食及体质量下降等糖尿病症状。高脂高糖饲料喂养10个月后,模型组的体质量(86.32±5.86)kg较对照组(41.54±4.54)kg明显升高(t=15.672,P<0.01)。对照组小型猪精神状况良好,毛发光泽,生长良好。
2.2高脂高糖喂养10个月后2组空腹血糖、空腹胰岛素及HOMA-IR比较模型组空腹血糖(6.46± 0.31)mmol/L、空腹胰岛素(15.67±1.46)mIU/L及HOMA-IR 4.51±0.53较对照组(4.66±0.45)mmol/L、(8.12±0.32)mIU/L及1.69±0.22均明显升高(t分别为7.461、11.328和10.928,均P<0.01)。
2.3实验结束时2组空腹血糖、空腹胰岛素水平比较模型组动物空腹血糖水平(11.46±1.64)mmol/L较对照组(4.64±0.47)mmol/L明显升高(t=8.938,P<0.01),模型组动物空腹胰岛素水平(6.57±0.33)mIU/L较对照组(8.11±0.28)mIU/L明显降低(t=8.142,P<0.01)。
2.4 2组骨骼肌、肝脏及胰腺组织PKB蛋白表达及磷酸化水平比较与对照组比较,模型组骨骼肌、肝脏及胰腺组织PKB蛋白表达及磷酸化水平明显降低(P<0.05),见图1。
3 讨论
猪在解剖结构、血生化指标、肥胖倾向性等方面与人类高度相似,其中小型猪动物模型已广泛运用于糖尿病、呼吸系统、心血管系统、消化系统及外科等领域的研究[5-7]。适于医学动物实验的有巴马小型猪、西双版纳小型猪、五指山微型猪等。巴马小型猪源产于广西巴马瑶族自治县,是具有悠久的饲养历史和稳定的遗传基因的地方小型猪品种。小型猪除了血生化指标与人类高度相似外,其糖脂质代谢也近似于人类;此外小型猪容易饲养、抗病能力强、易于实验操作等。因此,小型猪在糖尿病研究中具有独特优势。
IR是T2DM的主要发病机制,IR是指胰岛素执行其正常生物作用的效应不足,表现为外周组织尤其是肌肉、脂肪组织对葡萄糖的利用障碍。胰岛素通过与其受体结合可在不同组织细胞内激活不同的信号途径而产生不同的作用,胰岛素信号转导在胰岛素生理作用的发挥中起着至关重要的作用,因而信号转导的不同环节出现异常均可导致IR。胰岛素受体信号主要包括PI3K/PKB/哺乳动物雷帕霉素靶蛋白(mTOR)和有丝分裂原信号(MAPK)两条途径。其中PKB在胰岛素信号转导和葡萄糖转运中起重要作用,PKB表达水平和活性的改变与IR及糖尿病的发生发展密切相关,在IR状态下,胰岛素刺激的肝细胞及脂肪细胞的PKB丝氨酸磷酸化及PKB活性受到抑制,进一步削弱了胰岛素的作用。另外,PKB的磷酸化还可以减少胰岛β细胞凋亡,促进β细胞修复,改善β细胞分泌功能[8]。
本研究先采用高脂高糖饮食喂养巴马小型猪,模型组动物出现明显肥胖、高胰岛素血症及IR,并采用多次小剂量注射STZ部分破坏胰岛β细胞,接近人类T2DM发病特点,而且大大降低了STZ的不良反应,与文献报道相似[9]。另外,本研究结果发现T2DM模型组骨骼肌、肝脏及胰腺组织PKB蛋白表达及磷酸化水平明显低于对照组,提示模型组出现IR的倾向,与其他研究相一致[4]。
本研究显示采用高脂高糖饮食联合STZ多次腹腔注射的方法构建T2DM小型猪模型,操作简便、易于掌握,且具有较好的安全性,为糖尿病研究提供了良好的研究工具。
[1]Liu YN,Jung JH,Park H,et al. Olive leaf extract suppresses messenger RNA expression of proinflammatory cytokines and enhances insulin receptor substrate 1 expression in the rats with streptozotocin and high-fat diet-induced diabetes[J]. Nutr Res,2014,34(5):450-457. doi:10.1016/j.nutres.2014.04.007.
[2]Strauss A,Moskalenko V,Tiurbe C,et al. Goettingen Minipigs (GMP):comparison of two different models for inducing diabetes [J]. Diabetol Metab Syndr,2012,5(4):7. doi:10.1186/1758-5996-4-7.
[3]Yu J,Ye Y,Huang LL,et al. The research on stability of type 2 diabetes model in Chinese Bama miniature pigs induced by high fat/ high sucrose diet and STZ[J]. Shanxi Med J,2014,43(21):2499-2501.[于健,叶瑶,黄漓莉,等.高脂高糖饮食联合链脲佐菌素构建巴马小型猪2型糖尿病模型稳定性研究[J].山西医药杂志,2014,43(21):2499-2501].
[4]Cao SC,Zhao G,Chang B,et al. Effects of exercise on expression and phosphorylation of PI3K and PKB in insulin signaling in the skeletal muscles of type 2 diabetic rats[J]. J South Med Univ,2010,30(6):1217-1221.[曹师承,赵刚,常波,等.运动对2型糖尿病大鼠骨骼肌胰岛素信号通路PI3K/PKB磷酸化与表达的影响[J].南方医科大学学报,2010,30(6):1217-1221].
[5]He B,Musk GC,Mou L,et al. Laparoscopic surgery for kidney orthotopic transplant in the pig model[J]. JSLS,2013,17(1):126-131. doi:10.4293/108680812X13517013318021.
[6]Wolf E,Braun- Reichhart C,Streckel E,et al. Genetically engineered pig models for diabetes research[J]. Transgenic Res,2014,23(1):27-38. doi:10.1007/s11248-013-9755-y.
[7]Sheu SY,Wang WL,Fu YT,et al. The pig as an experimental model for mid-dermal burns research[J]. Burns,2014,40(8):1679-1688. doi:10.1016/j.burns.2014.04.023.
[8]Higa M,Shimabukuro M,Shimajiri Y,et al. Protein kinase B/Akt signalling is required for palmitate-induced beta-cell lipotoxicity [J]. Diabetes Obes Metab,2006,8(2):228-233.
[9]Xiao GH,Zhang SJ,Yu J,et al. Establishment of model of type 2 diabetes in Chinese banna miniature pigs induced by high sucrose/ high fat diet and STZ[J]. Journal of Medical Science in Central South China,2012,40(4):351-356.[肖国华,张素君,余坚,等.高糖高脂联合低剂量STZ诱导版纳微型猪2型糖尿病模型的建立[J].中南医学科学杂志,2012,40(4):351-356]. doi:10.15972/j.cnki.43-1509/r.2012.04.018.
(2015-10-12收稿2015-12-30修回)
(本文编辑魏杰)
Changes of protein kinase B and phosphorylation expression in the skeletal muscle,liver and pancreas of miniature pig model with type 2 diabetes mellitus model
YU Jian1,ZOU Disha2,YE Yao2,ZHOU Suxian1,ZHENG Tianpeng1,YANG Fan1
1 Department of Endocrinology,the Affiliated Hospital of Guilin Medical College,Guangxi 541001,China;2 Graduate School of Guilin Medical College
Objective To study the feasibility of Bama miniature pig model establishment of type 2 diabetes mellitus (T2DM)by high-fat and high-sugar diet combined with streptozotocin(STZ),and observe the changes in protein kinase B (PKB)and phosphorylation expressions in skeletal muscle,liver,and pancreatic tissues of the miniature pig model. Methods A total of 10 healthy male Bama miniature pigs were randomly divided into two groups:control group(n=5,fed normal diet)and diabetic model group(n=5,fed high-fat and high-sugar diet combined with STZ to establish T2DM Bama miniature pig model). The fasting plasma glucose(FPG)and fasting insulin(FINS)levels were measured,and insulin resistance(HOMA-IR)was calculated in two groups. The PKB and phosphorylation expressions in skeletal muscle,liver and pancreatic tissues were measured using Western blot assay. Results(1)After 10 months of high-fat and high-sugar diet,the body weight,FPG,FINS and HOMA-IR were significantly higher in model group than those of control group(P<0.01). (2)After STZtreatment,compared with control group,there was afurther increased level of FPG and asignificantly decreased level of FINS in model group(P<0.01).(3)Compared with control group,the PKB and phosphorylation expression levels in skeletal muscle,liver and pancreas were significantly lower in model group(P<0.05). Conclusion The high-fat and highsugar diet combined with STZ can successfully establish the T2DM miniature pig model. The PKB and phosphorylation expression levels in skeletal muscle,liver,and pancreatic tissues are decreased in model pigs.
diabetes mellitus,type 2;protein kinases;swine,miniature;muscle,skeletal;liver;pancreas;Bama miniature pig
广西科学研究与技术开发计划项目课题(桂科攻1347003-5);桂林市科学研究与技术开发计划项目课题(20150126-1-1);广西壮族自治区卫生厅科研课题(Z2014301)
1桂林医学院附属医院内分泌科(邮编541001);2桂林医学院研究生院
于健(1965),女,教授,硕士,主要从事糖尿病慢性并发症基础与临床研究
R587.1
A
10.11958/20150202



