郑爱华,郑全辉,张爱红
肺肿瘤小鼠MDSC、Treg及传统T细胞变化研究
郑爱华1,郑全辉2△,张爱红1
目的 探讨肺肿瘤小鼠骨髓源性抑制细胞(MDSC)、调节性T细胞(Treg)和传统T细胞的变化及机制。方法 采用配对设计将20只C57BL/6小鼠随机均分为Lewis肺癌细胞注射组(LLC组)和正常对照组(NC组),LLC组采用皮下注射LLC细胞100 μL(1×106)制备肺肿瘤小鼠模型,对照组注射等量生理盐水。待肿瘤形成后取小鼠脾细胞,采用流式细胞仪检测肺肿瘤小鼠MDSC、Treg及CD4+和CD8+T细胞比例和数量变化,膜联蛋白-V(Annexin-Ⅴ)染色检测CD4+和CD8+T细胞凋亡变化,5-溴脱氧尿嘧啶核苷(BrdU)染色检测CD4+和CD8+T细胞增殖变化。结果 与NC组相比,LLC组脾脏MDSC比例和数量明显增加,CD4+Foxp3+Treg所占CD4+T细胞比例和数量明显增加,而CD4+和CD8+T细胞所占脾细胞比例和数量明显降低(均P<0.05)。与NC组相比,LLC组CD4+和CD8+T细胞增殖明显降低,同时CD8+T细胞凋亡明显增加(P<0.05)。结论 MDSC和Treg细胞在肺肿瘤小鼠数量增加,同时,MDSC和Treg抑制CD4+和CD8+T细胞增殖,并促进CD8+T细胞凋亡。
肺肿瘤;癌,Lewis肺;T淋巴细胞,调节性;CD4阳性T淋巴细胞;CD8阳性T淋巴细胞;细胞增殖;细胞凋亡;骨髓源性抑制细胞
肺癌目前仍是世界范围内发病率和死亡率最高的肿瘤之一,其发生和发展的免疫学病理机制仍不明确。正常的免疫应答状态是机体抵抗肿瘤发生和发展的重要因素,其中,CD4+和CD8+T细胞介导的细胞免疫应答在机体抗肿瘤免疫中发挥主要作用,而骨髓源性抑制细胞(MDSC)和调节性T细胞(Treg)则主要发挥免疫抑制功能。近年来研究发现,肿瘤患者免疫功能往往处于失调状态,这种免疫失调状态伴随机体免疫细胞亚群变化,并与肿瘤的发生、发展密切相关[1]。本研究以皮下注射Lewis肺癌细胞建立肿瘤小鼠模型,探讨肺肿瘤小鼠效应性CD4+和CD8+T细胞以及调节性MDSC和Treg细胞的数量变化及可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 小鼠Lewis肺癌细胞系(LLC)购自北京北纳创联生物技术研究院,在含10%胎牛血清及双抗(青霉素100 U/mL,链霉素100 mg/L)的DMEM(GIBCO公司)培养液中培养,培养条件为饱和湿度、37℃、5%CO2,2~3 d更换1次培养液。细胞总数达到95%融合时用0.25%胰酶及0.02% EDTA溶液消化、传代培养。
1.1.2 动物 SPF级C57BL/6小鼠20只,购自中国食品药品检定研究院[许可证号:SCXK(京)2009-0017],在华北理工大学SPF级动物房饲养。
1.1.3 主要试剂及仪器 红细胞裂解液、Fc受体阻断剂(2.4G2)、PerCP标记大鼠抗小鼠CD4(RM-4.5)、PE标记大鼠抗小鼠CD8a(53-6.7)、FITC标记大鼠抗小鼠CD25(7D4)、PE标记大鼠抗小鼠Gr-1(RB6-8C5)、FITC标记大鼠抗小鼠CD11b(M1/70)、膜联蛋白-V(Annexin-Ⅴ)凋亡染色试剂盒、5-溴脱氧尿嘧啶核苷(BrdU)细胞增殖检测试剂盒均购自美国BD公司。PE标记大鼠抗小鼠Foxp3抗体(FJK-16S)及Foxp3细胞内染色试剂盒购自美国eBioscience公司。低温冷冻离心机为德国Beckman公司产品,流式细胞仪FACS Calibur为美国BD公司产品。
1.2 方法
1.2.1 肺肿瘤小鼠模型的制备 消化、收集LLC细胞,离心去上清,用无菌生理盐水洗涤2次,将细胞悬浮于生理盐水中,台盼蓝染色细胞活力>95%。进行细胞计数,调整细胞浓度为1×107/mL。取6~8周龄小鼠20只,雌雄各半,采用配对设计随机分成正常对照(normal control,NC)组和LLC组,每组10只。小鼠皮肤进行乙醇消毒后LLC组每只于腋窝皮下注射LLC细胞100 μL(1×106),NC组注射等量生理盐水。
1.2.2 免疫细胞表面分子染色 于肿瘤形成后约2周处死小鼠。分离脾脏并制成单细胞悬液。调整各组织细胞悬液浓度为1×107/mL,各取100 μL加入流式管中,加入2.4G2,4℃封闭10 min,然后直接加入10 μL(1∶10~1∶100稀释)荧光素标记的抗细胞表面分子抗体,4℃避光染色30 min。细胞染色缓冲液离心洗涤2次(每次1 000 r/min,5 min)后上机检测,CD11b+Gr1+MDSC细胞、CD4+CD25+T细胞、CD4+和CD8+T细胞所占脾细胞比例(即MDSC ratio、CD4+CD25+T ratio、CD4+T ratio、CD8+T ratio)采用CellQuest软件分析获得,以上不同免疫细胞亚群数量由其所占脾细胞比例乘以脾细胞总数获得。细胞凋亡分析采用Annexin V染色试剂盒,按说明书操作,数据分析同上。
1.2.3 Foxp3细胞内染色 取以上脾细胞悬液,按上述步骤进行淋巴细胞CD4、CD25表面分子染色。细胞染色缓冲液离心洗涤2次后收集细胞,每管加入100 μL细胞固定/打孔液,充分混匀后4℃避光放置20 min。每管用1 mL打孔/洗涤缓冲液,离心洗涤2次(每次1 000 r/min,5 min)后收集细胞,每管用100 μL打孔/洗涤缓冲液重悬,加入适量稀释的Foxp3抗体,4℃避光染色30 min。每管用1 mL打孔/洗涤缓冲液,离心洗涤2次后上机检测,CD4+Foxp3+Treg所占CD4+T细胞比例(CD4+Foxp3+Treg/CD4+T ratio)和数量分析同上。
1.2.4 BrdU掺入法检测细胞增殖 小鼠每24 h腹腔注射BrdU溶液,每只1 mg,连续注射3 d。处死后收集脾脏细胞,首先进行细胞表面染色,4℃30 min。细胞经固定、透膜后加入DNase I(100 mg/L),37℃,1 h,加入荧光素标记抗BrdU单克隆抗体染色,流式细胞仪分析及数据处理同上。
1.3 统计学方法 应用SPSS 13.0统计软件进行统计学处理,计数资料以均数±标准差(±s)表示,组间比较采用t检验,双侧P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肺肿瘤模型制备 与NC组相比,LLC组1周后腋下开始出现可触及的肿瘤,全部成瘤,3周后肿瘤明显增大,几乎累及整个腋窝,解剖小鼠后可见明显肿瘤团块形成,表明肿瘤模型制备成功,见图1。

Fig.1 Mouse lung tumor models were made by subcutaneous injection of LLC cells in armpit图1 小鼠皮下肺肿瘤模型制备
2.2 肺肿瘤小鼠MDSC和Treg细胞变化 与NC组相比,LLC组MDSC所占脾细胞比例和数量显着增加(P<0.01)。2组CD4+CD25+T细胞所占脾细胞比例和数量差异无统计学意义,但LLC组CD4+Foxp3+Treg所占CD4+T细胞比例和数量较NC组明显增加(P<0.05或P<0.01),见图2、表1。
2.3 肺肿瘤小鼠CD4+和CD8+T细胞变化 与NC组相比,LLC组脾脏CD4+和CD8+T细胞所占脾细胞比例和数量均明显降低(P<0.05),见图3、表2。
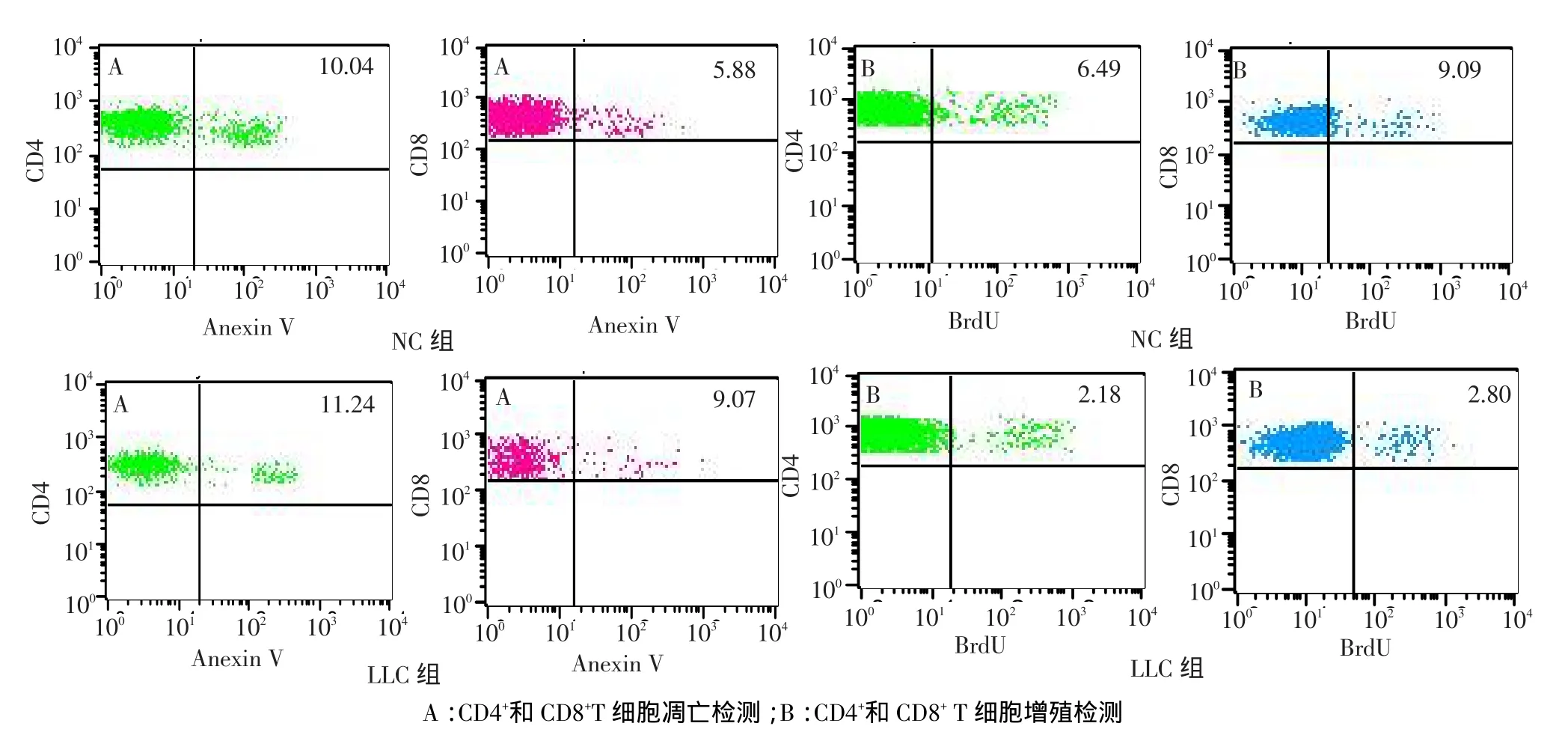
2.4 小鼠CD4+和CD8+T细胞凋亡和增殖变化 2 组CD4+T细胞凋亡比较差异无统计学意义;与NC组相比,LLC组CD8+T细胞凋亡比例增加,CD4+和CD8+T细胞增殖降低,差异均有统计学意义(P<0.05),见表3、图4。
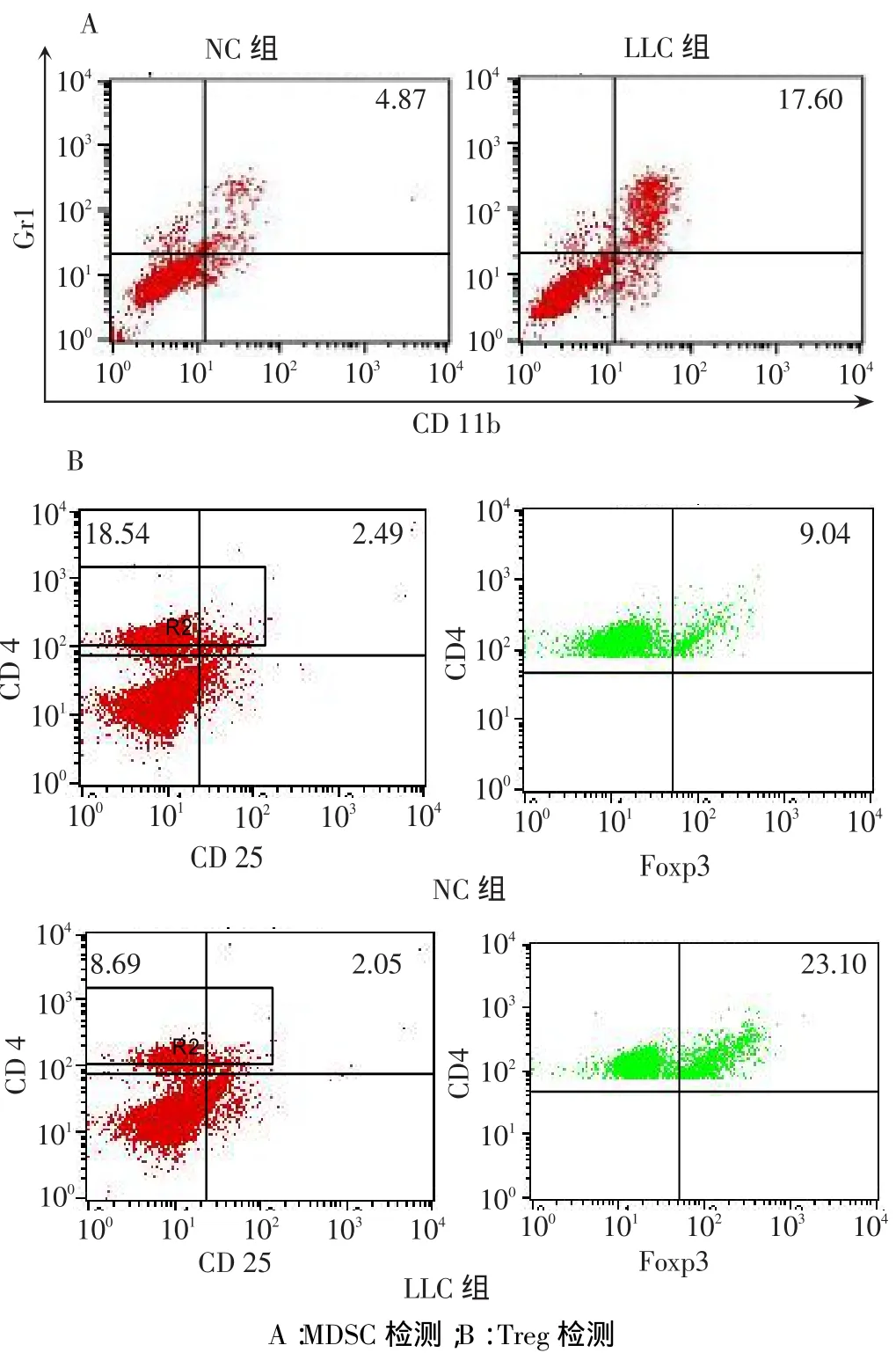
Fig. 2 The changes of MDSC and Treg cells in the spleen of LLC injected mice detected by flow cytometry图2 流式细胞仪检测2 组小鼠脾脏MDSC 和Treg 细胞变化
Tab.1 Comparison of the ratio and number of MDSC and Treg cells between two groups表12组小鼠MDSC和Treg细胞比例和数量比较(n=10,±s)
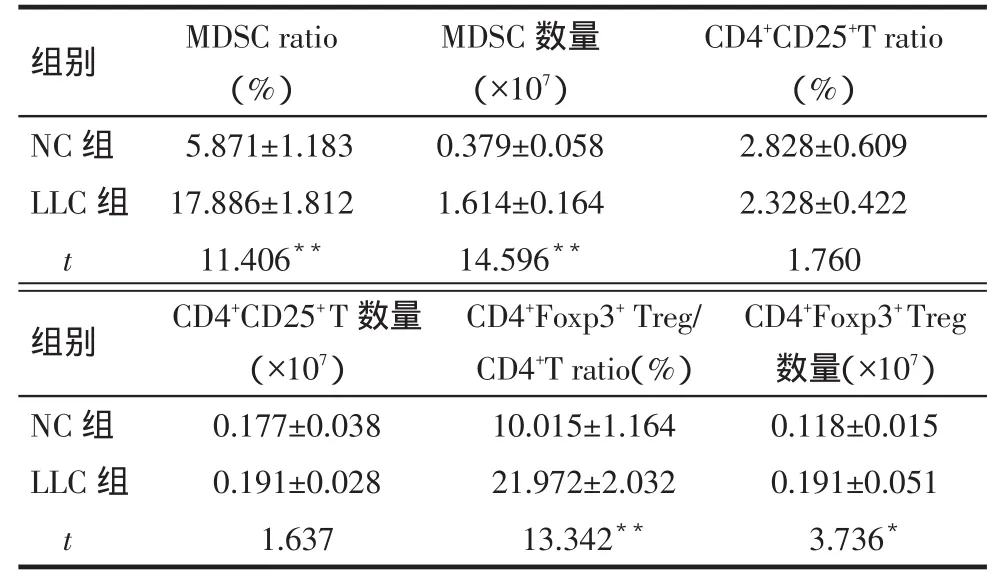
Tab.1 Comparison of the ratio and number of MDSC and Treg cells between two groups表12组小鼠MDSC和Treg细胞比例和数量比较(n=10,±s)
*P<0.05,**P<0.01
组别NC组LLC组t MDSC数量(×107)0.379±0.058 1.614±0.164 14.596**MDSC ratio (%)5.871±1.183 17.886±1.812 11.406**CD4+CD25+T ratio (%)2.828±0.609 2.328±0.422 1.760组别NC组LLC组t CD4+CD25+T数量(×107)0.177±0.038 0.191±0.028 1.637 CD4+Foxp3+Treg/ CD4+T ratio(%)10.015±1.164 21.972±2.032 13.342**CD4+Foxp3+Treg数量(×107)0.118±0.015 0.191±0.051 3.736*
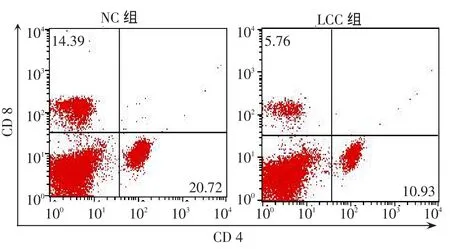
Fig.3 The changes of CD4+and CD8+T cells in the spleen of two groups of mice detected by flow cytometry图3 流式细胞仪检测2组小鼠脾脏CD4+和CD8+T细胞变化
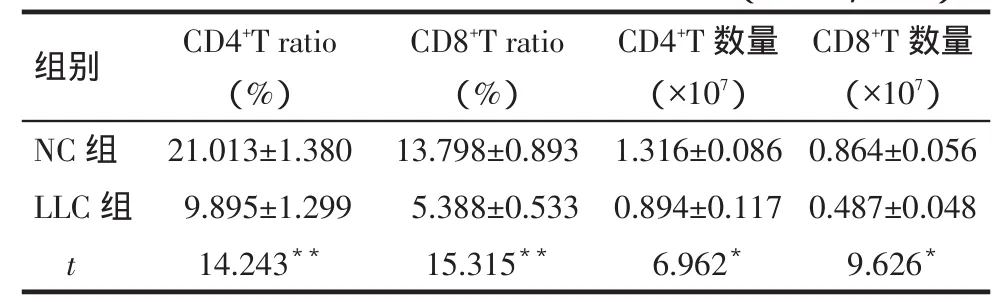
Tab.2 Comparison of the ratio and number of CD4+and CD8+T cells between two groups表2 2组小鼠CD4+和CD8+T细胞比例和数量比较 (n=10,x±s)
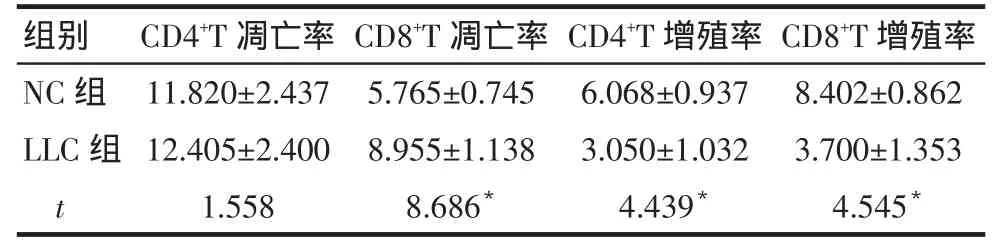
Tab.3 Comparison of apoptosis and proliferation of CD4+ and CD8+T cells between two groups of mice 表3 2组小鼠CD4+和CD8+T细胞凋亡和增殖比较 (n=10,%,?±s)
3 讨论
肿瘤的发生、发展伴随机体免疫功能的异常变化,而这种变化往往与各种免疫细胞亚群的数量或功能改变密切相关。虽然机体有多种免疫细胞参与对肿瘤细胞的杀伤和清除,但传统T细胞仍是抗肿瘤免疫的主力军[2]。其中,CD8+效应T细胞通过释放穿孔素/颗粒酶,表达膜型FasL以及分泌肿瘤坏死因子(TNF)-α等机制直接杀伤肿瘤细胞,而CD4+效应T细胞则进一步通过释放Th1型细胞因子促进CD8+T细胞的抗肿瘤活性[3]。然而,在机体抗肿瘤免疫应答作用下,许多肿瘤仍能在体内进行性生长,表明肿瘤细胞能够逃避机体免疫系统的攻击,或产生抑制T细胞免疫应答的机制。MDSC和Treg是两个发挥免疫抑制作用的细胞群,MDSC主要由未成熟的巨噬细胞、树突状细胞以及粒细胞组成。人MDSC被确定为CD33+CD11b+HLA-DRlow/-,小鼠MDSC被确定为Gr1+CD11b+[4]。Treg是一群细胞表面高表达白细胞介素(IL)-2受体α链(CD25),胞质中表达Foxp3转录因子的CD4+T细胞亚群。MDSC主要通过分泌转化生长因子(TGF)-β、IL-10等细胞因子抑制免疫应答,而Treg既可通过细胞间直接接触,也可通过产生TGF-β、IL-35等细胞因子抑制免疫效应细胞增殖[5-6]。
近年来研究表明,MDSC在多种因素引起的慢性炎症和几乎各种肿瘤发展过程中出现,主要由CD11b+Ly6CloLy6G+非成熟粒细胞和 CD11b+Ly6ChiLy6G-单核细胞组成[7-8]。本研究中采用LLC细胞腋下注射制备肺肿瘤小鼠模型,主要观察了肺肿瘤形成早期(3周)不同免疫细胞变化。与以往研究结果一致[9-11],本研究显示MDSC在LLC细胞同系移植诱导的肺肿瘤小鼠中明显增加,Treg在肺肿瘤小鼠中也呈明显上升趋势。Treg既可从胸腺中自然产生,具有CD4+CD25+表型,也可由外周CD4+CD25-初始T诱导产生,而转录因子Foxp3表达与否决定其是否具有真正Treg功能[12]。本研究表明,虽然Foxp3表达在肺肿瘤小鼠CD4+T中显着增加,但CD4+CD25+T细胞的比例和数量没有明显变化,说明肺肿瘤小鼠中增多的Treg主要由外周诱导产生。
本研究表明,与MDSC和Treg在肺肿瘤小鼠中的上升趋势相反,CD4+和CD8+T细胞在肺肿瘤小鼠中明显减少,其原因主要来源于二者增殖能力的显着降低。另外,肺肿瘤小鼠CD8+T细胞凋亡比例也明显增加。研究发现,MDSC除能大量产生IL-10、 TGF-β等免疫抑制性细胞因子外,还高表达精氨酸酶、一氧化氮合酶以及合成大量活性氧[13]。精氨酸酶、一氧化氮合酶可加速精氨酸的分解和一氧化氮的合成,而精氨酸减少最终将会导致T细胞的活化和增殖受阻[14]。另外,一氧化氮不但通过抑制IL-2受体下游信号蛋白抑制T细胞活化,而且通过活化Fas-FasL途径促进T细胞凋亡[15]。另有研究表明,肿瘤患者CD8+T细胞Fas表达增加,对MDSC或Treg诱导的凋亡敏感性增强[16]。
总之,本研究发现肺肿瘤小鼠MDSC和Treg细胞比例和数量增加,而CD4+、CD8+T细胞则出现明显的增殖受阻和凋亡增加,导致其细胞数量减少,提示肺肿瘤发生、发展过程伴随机体免疫功能的复杂变化,表现为抑瘤功能减弱,而促进肿瘤发展的因素逐渐增强。因此,如何采取有效方法逆转荷瘤机体的这一免疫功能变化将为临床肿瘤患者治疗提供新的思路。本研究主要探讨了肺肿瘤形成早期以上免疫细胞变化,采用原位肺肿瘤小鼠模型进一步探讨肺肿瘤形成晚期免疫细胞数量和功能变化,以及肺肿瘤生长微环境对机体免疫细胞的影响尚需在后续实验中逐步加以阐明。
[1]Alizadeh D,Larmonier N.Chemotherapeutic targeting of cancerinduced immunosuppressive cells[J].Cancer Res,2014,74(10):2663-2668.doi:10.1158/0008-5472.CAN-14-0301.
[2]Motz GT,Coukos G.Deciphering and reversing tumor immune suppression[J].Immunity,2013,39(1):61-73.doi:10.1016/j. immuni.2013.07.005.
[3]Hoepner S,Loh JM,Riccadonna C,et al.Synergy between CD8 T Cells and Th1 or Th2 Polarised CD4 T Cells for adoptive immunotherapy of brain tumours[J].PLoS One,2013,8(5):e63933.doi:10.1371/journal.pone.0063933.
[4]Diaz-Montero CM,Finke J,Montero AJ.Myeloid-derived suppressor cells in cancer:therapeutic,predictive,and prognostic implications[J]. Semin Oncol,2014,41(2):174-184.doi:10.1053/j.seminoncol. 2014.02.003.
[5]Lindau D,Gielen P,Kroesen M,et al.The immunosuppressive tumour network:myeloid-derived suppressor cells,regulatory T cells and natural killer T cells[J].Immunology,2013,138(2):105-115.doi:10.1111/imm.12036.
[6]Yan YJ,He XH.Review the function and structure of interleukin-35 and its function in mediating treg cell immuno-suppression[J]. Tianjin Med J,2014,42(12):1243-1245.[闫永嘉,何向辉.IL-35结构功能及其调控Treg细胞免疫抑制功能的研究进展[J].天津医药,2014,42(12):1243-1245].doi:10.3969/j.issn.0253-9896.2014.12.026.
[7]Movahedi K,Guilliams M,Van den Bossche J,et al.Identification of discrete tumor-induced myeloid-derived suppressor cell subpopulations with distinct T cell-suppressive activity[J].Blood,2008,111(8):4233-4244.doi:10.1182/blood-2007-07-099226.
[8] Youn JI,Nagaraj S,Collazo M,et al.Subsets of myeloid-derived suppressor cells in tumor-bearing mice[J].J Immunol,2008,181 (8):5791-5802.doi:10.4049/jimmunol.181.8.5791.
[9]Zheng QH,Liu YW,Zhang XM.Changes of myeloid derived suppressor cells and T cells in lung cancer mice[J].Chinese Journal of Immunology,2015,31(5):595-599.[郑全辉,刘英文,张雪梅.肺癌小鼠MDSC和T细胞变化[J].中国免疫学杂志,2015,31(5):595-599].doi:10.3969/j.issn.1000-484X.20 15.05.004.
[10]Li YD,Liu RQ,Liu J,et al.The proportion and significance of MDSC in the PBL of non-small cell lung cancer patients[J]. Chinese Journal of Practical Medicine,2013,40(1):61-64.[李亚东,刘瑞青,刘杰,等.非小细胞肺癌患者外周血MDSC的比例及意义[J].中国实用医刊,2013,40(1):61-64].doi:10.3760/ cma.j.issn.1674-4756.2013.01.026
[11]Fan HT,Lin HS,Li J,et al.The changes of CD4+CD25+Foxp3+regulatory T cells and myeloid-derived suppressor cells in Lewis lung carcinoma-bearing mice and its relationship with tumor growth [J].Current Immunology,2009,29(5):370-375.[樊慧婷,林洪生,李杰,等.Lewis肺癌荷瘤小鼠CD4+CD25+Foxp3+调节性T细胞及髓样抑制细胞与肿瘤生长的关系[J].现代免疫学,2009,29(5):370-375].
[12]Sawant DV,Vignali DA.Once a Treg,always a Treg?[J].Immunol Rev,2014,259(1):173-191.doi:10.1111/imr.12173.
[13]Waldron TJ,Quatromoni JG,Karakasheva TA,et al.Myeloid derived suppressor cells:Targets for therapy[J].Oncoimmunology,2013,2(4):e24117.doi:10.4161/onci.24117.
[14]Rodriguez PC,Quiceno DG,Ochoa AC.L-arginine availability regulates T-lymphocyte cell-cycle progression[J].Blood,2007,109(4):1568-1573.doi:10.1182/blood-2006-06-031856.
[15]Daigneault M,De Silva TI,Bewley MA,et al.Monocytes regulate the mechanism of T-cell death by inducing Fas-mediated apoptosis during bacterial infection[J].PLoS Pathog,2012,8(7):e1002814. doi:10.1371/journal.ppat.1002814.
[16]Guo CL,Yang XH,Cheng W,et al.Expression of Fas/FasL in CD8+T and CD3+Foxp3+Treg cells--relationship with apoptosis of circulating CD8+T cells in hepatocellular carcinoma patients[J]. Asian Pac J Cancer Prev,2014,15(6):2613-2618.
(2015-11-20收稿 2016-03-24修回)
(本文编辑 李国琪)
Changes of MDSC,Treg and traditional T cells in lung tumor mice
ZHENG Aihua1,ZHENG Quanhui2△,ZHANG Aihong1
1 Department of Emergency Medicine,Tangshan Gongren Hospital,Tangshan 063000,China;2 School of Basic Medicine,North China University of Science and Technology△
Objective To explore changes of the myeloid derived suppressor cell(MDSC),regulatory T cell(Treg),traditional T cell,and their mechanisms in lung tumor mice.Methods Twenty C57BL/6 mice were randomly divided into the experimental and the normal control groups.The experimental group was injected with Lewis lung cancer cells(LLC,100 μL 1×106)subcutaneously to prepare the lung tumor model mice,the normal control group was given the same amount of saline(NC).Spleen cells were obtained from LLC and NC groups.Flow cytometry was used to detect the ratio and number changes of MDSC,Treg,CD4+and CD8+T cells in the lung tumor of mice.CD4+and CD8+T cell apoptosis were detected by Annexin-Ⅴstaining,and their proliferation were detected by 5-bromine deoxidization uracil nucleoside(BrdU)incorporation. Results Compared with normal control mice,the ratio and number of MDSC in spleen increased significantly in LLC group (P<0.01),in addition,the ratio of CD4+Foxp3+Treg in CD4+T cells and their number in spleen increased significantly in LLC group.However,the ratio and number of CD4+and CD8+T cells in spleen decreased significantly in LLC group(P<0.05). The proliferation of CD4+and CD8+T cells decreased significantly in LLC group compared with that of NC group(P<0.05),while the apoptosis of CD8+T cells increased significantly(P<0.05).Conclusion MDSC and Treg cells increase in lung tumor model mice,which inhibit proliferation of CD4+and CD8+T cells and promote apoptosis of CD8+T cells.
lung neoplasms;carcinoma,Lewis lung;T-lymphocytes,regulatory;CD4-positive T-lymphocytes;CD8-positive T-lymphocytes;cell proliferation;apoptosis;myeloid derived suppressor cell
R392.11
A
10.11958/20150345
国家自然科学基金资助项目(81373111);河北省自然科学基金资助项目(H2013209019)
1唐山市工人医院急诊内科(邮编063000);2华北理工大学基础医学院
郑爱华(1981),女,主治医师,主要从事肿瘤免疫学治疗相关研究
△通讯作者 E-mail:zhqhdlp@sohu.com



