李建功,赵永萍,刘莹,仇玉莹,李美娟,贾琼,张静,李洁△
黄连素对精神分裂症患者胰岛素抵抗与细胞因子的影响
李建功1,2,赵永萍2,刘莹2,仇玉莹2,李美娟1,2,贾琼1,张静1,李洁2△
目的探讨黄连素对利培酮单药治疗的精神分裂症患者胰岛素抵抗与血清细胞因子水平的影响。方法将64例利培酮单药治疗的精神分裂症患者随机分为研究组(合并黄连素治疗)31例和对照组(合并安慰剂治疗)33例,测定2组患者治疗前及治疗12周后的空腹血糖(FBG)、空腹胰岛素(Fins),采用稳态模型公式计算胰岛素抵抗指数(HOMA-IR)。采用酶联免疫吸附法测定血清白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α水平。结果研究组治疗后的FBG、Fins、HOMA-IR、IL-1β、IL-6、TNF-α水平较自身治疗前和对照组治疗后均显着降低(P<0.05);而对照组治疗后较治疗前FBG水平则显着升高(P<0.01),IL-1β、IL-6、TNF-α水平降低(P<0.01),Fins、HOMA-IR水平无明显变化(P>0.05)。研究组患者HOMA-IR与血清IL-1β、IL-6、TNF-α均呈正相关(r分别为0.316、0.351及0.401,P<0.01)。结论黄连素能显着降低利培酮单药治疗的精神分裂症患者FBG、Fins、HOMA-IR、IL-1β、IL-6、TNF-α水平,且HOMA-IR水平与IL-1β、IL-6、TNF-α密切相关。
精神分裂症;胰岛素;血糖;白细胞介素1β;肿瘤坏死因子α;黄连素;胰岛素抵抗
精神分裂症是一种慢性、常见的重型精神疾病,患者社会功能及劳动能力会受到损害,但具体病因尚未阐明[1]。白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子(tumor necrosis factor-alpha,TNF)-α作为促炎性细胞因子,是启动炎症反应的关键细胞因子已基本成为共识。研究显示,炎症反应系统的免疫激活改变和细胞因子表达水平的不同均参与精神分裂症的发生发展过程[2]。研究表明,常用的非典型抗精神病药可导致精神分裂症患者发生糖代谢异常[3-4]。因此,治疗患者精神症状的同时,血糖的调节、胰岛素抵抗(insulin resistance,IR)的改善、糖代谢异常的减少等应受到更多的关注。黄连素(berberine,BBR)为一种传统中药,具有抗炎、免疫调节、降低血糖血脂、抗肿瘤、保护脑细胞等功效[5-6]。本研究旨在探讨黄连素对利培酮单药治疗的精神分裂症患者IR与血清细胞因子IL-1β、IL-6及TNF-α水平的影响。
1 对象与方法
1.1研究对象选取2014年3月—2015年1月于天津市安定医院应用利培酮单药治疗的精神分裂症患者69例,所有入组的精神分裂症患者在研究期间继续保持原有利培酮治疗剂量。纳入标准:(1)符合精神障碍诊断和统计手册第4版(Diagnosis and statistic manual for mental disorder-Ⅳ,DSM-Ⅳ)精神分裂症的诊断标准。(2)年龄18~55岁,性别不限。(3)目前使用的利培酮剂量稳定1个月以上。(4)无严重躯体疾病,血常规、肝肾生化、心电图、脑电图及体格检查结果无明显异常。(5)患者及家属知情同意。排除标准:(1)具有DSM-Ⅳ中其他精神障碍。(2)近1个月有乙醇、镇静催眠药物、毒品等物质滥用史者。(3)难治性精神分裂症患者。(4)近1个月内接受过无抽搐电休克治疗(modified electric convulsive therapy,MECT),经颅磁刺激治疗或者使用长效抗精神病药物者。(5)有严重的躯体疾病,包括未控制的高血压、严重的心血管、脑血管、肺部疾病、甲状腺疾病、糖尿病、癫痫等。(6)正在接受抗炎或免疫抑制治疗,包括口服甾体类激素。(7)有慢性感染史,包括结核病、艾滋病及肝炎等。(8)怀孕以及哺乳妇女。69例患者采用随机数字表法分配到研究组(合并黄连素治疗,34例)和对照组(合并安慰剂治疗,35例)。研究组2例因病情需要更换其他抗精神病药物而脱落,1例因病情好转出院失访而脱落;对照组1例因病情需要更换其他抗精神病药物而脱落,1例因自行终止抗精神病药治疗而脱落,剔除后共64例。2组利培酮平均治疗时间(3.53±1.22)个月。研究组31例,男14例,女17例,年龄(40.14±9.40)岁,利培酮日用量(3.77±0.85)mg/d。对照组33例,男15例,女18例,年龄(40.18±12.21)岁,利培酮日用量(3.85±0.94)mg/d。2组的性别(χ2=0.001)、年龄(t=0.012)及利培酮日用量(t=0.160)差异均无统计学意义(P>0.05),具有可比性。本研究经过天津市安定医院伦理委员会审查通过,所有研究对象均签署知情同意书。
1.2方法
1.2.1基本信息调查表(自编),内容包括:姓名、年龄、性别、受教育年限、病程等人口学资料;现病史、既往史、个人史、家族史、治疗情况(用药种类、利培酮剂量)等临床资料。
1.2.2药物治疗方案研究组服用利培酮合并黄连素(东北制药集团沈阳第一制药有限公司,国药准字H21022453,100 mg/片)300 mg/次,每日3次;对照组服用利培酮合并安慰剂(黄连素模拟剂)300 mg/次,每日3次,共服用12周。受试者在研究过程中不得换用另一种药物,禁止合并使用心境稳定剂,对于伴有失眠的患者可使用镇静催眠类药物。
1.2.3标本采集及处理所有受试者于治疗前及治疗12周后采血。于清晨空腹时抽取肘正中静脉血5 mL,立即测定空腹葡萄糖(fasting blood glucose,FBG)及胰岛素(fasting insulin,Fins)水平。同时将离心后的血清置于-80℃冰箱保存,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定血清IL-1β、IL-6、TNF-α水平。采用稳态模型公式计算胰岛素抵抗指数(homeostasismodel assessment-insulin resistance,HOMA-IR)=FBG×Fins/22.5。
1.3统计学方法采用SPSS 17.0软件进行统计学处理。计数资料以例(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以表示,2组间比较采用独立样本t检验,组内治疗前后比较采用配对样本t检验,相关分析采用Pearson相关分析方法,P<0.05为差异有统计学意义。
2 结果
2.1一般生化指标比较见表1。(1)组内比较。研究组治疗后的FBG、Fins、HOMA-IR水平均较治疗前降低(P<0.01)。对照组治疗后FBG水平较治疗前升高(P<0.01),而Fins、HOMA-IR治疗前后差异无统计学意义(P>0.05)。(2)组间比较。治疗前2组的FBG、Fins、HOMA-IR差异无统计学意义(P>0.05);治疗后研究组的FBG、Fins、HOMA-IR水平较对照组均降低(P<0.01)。
2.2血清IL-1β、IL-6、TNF-α水平比较见表2。(1)组内比较。研究组和对照组治疗后的血清IL-1β、IL-6、TNF-α水平较治疗前均降低(P<0.01)。
(2)组间比较。治疗前2组的IL-1β、IL-6、TNF-α水平差异无统计学意义(P>0.05);治疗后研究组的IL-1β、IL-6、TNF-α水平较对照组均降低(P<0.05)。
2.3研究组HOMA-IR与血清IL-1β、IL-6、TNF-α的相关性HOMA-IR与IL-1β、IL-6、TNF-α均呈正相关(r分别为0.316、0.351及0.401,P<0.01)。
Tab.1The comparison of blood glucose markers between two groups表1 2组血糖指标的比较
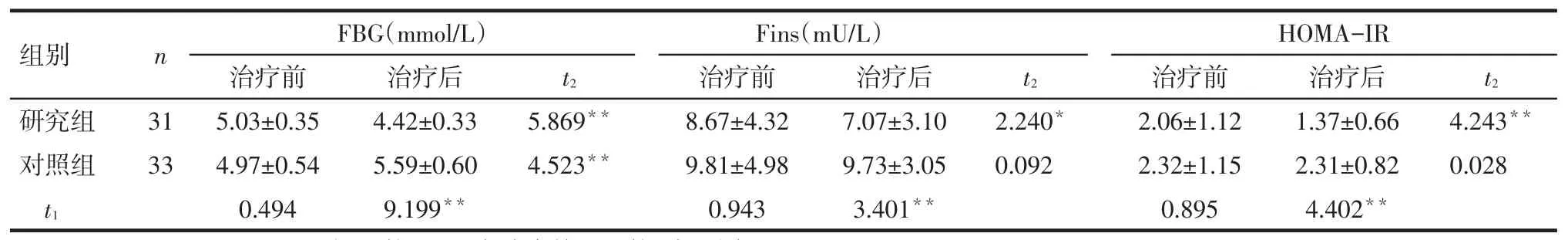
Tab.1The comparison of blood glucose markers between two groups表1 2组血糖指标的比较
*P<0.05,**P<0.01;t1:组间比较;t2:组内治疗前后比较;表2同
组别研究组对照组n FBG(mmol/L)HOMA-IR t2治疗后4.42±0.33 5.59±0.60 9.199**t2 31 33 t2 5.869**4.523**2.240*0.092 4.243**0.028 t1治疗前5.03±0.35 4.97±0.54 0.494 Fins(mU/L)治疗前8.67±4.32 9.81±4.98 0.943治疗后7.07±3.10 9.73±3.05 3.401**治疗前2.06±1.12 2.32±1.15 0.895治疗后1.37±0.66 2.31±0.82 4.402**
Tab.2The comparison of serum levels of IL-1β,IL-6 and TNF-α between two groups表2 2组血清IL-1β、IL-6、TNF-α水平比较(ng/L,)
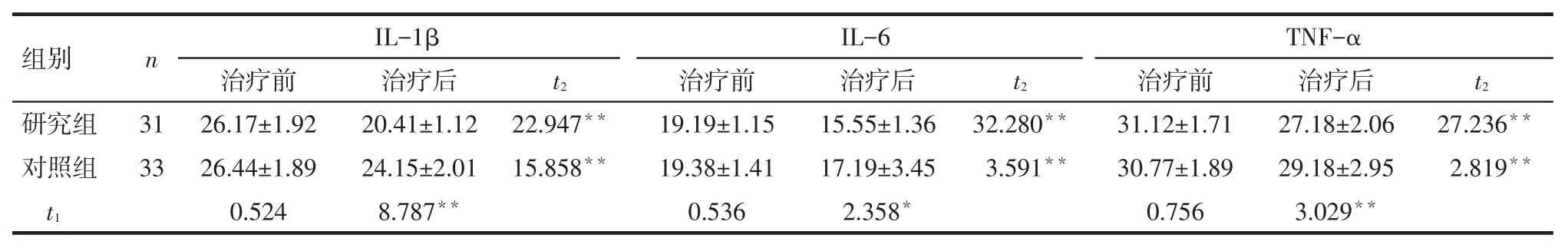
Tab.2The comparison of serum levels of IL-1β,IL-6 and TNF-α between two groups表2 2组血清IL-1β、IL-6、TNF-α水平比较(ng/L,)
组别研究组对照组n IL-1βIL-6TNF-α t2治疗后20.41±1.12 24.15±2.01 8.787**t2 31 33 t2 22.947**15.858**32.280**3.591**27.236**2.819**t1治疗前26.17±1.92 26.44±1.89 0.524治疗前19.19±1.15 19.38±1.41 0.536治疗后15.55±1.36 17.19±3.45 2.358*治疗前31.12±1.71 30.77±1.89 0.756治疗后27.18±2.06 29.18±2.95 3.029**
3 讨论
目前黄连素调节糖脂代谢,改善IR的作用已被证实[7-8]。本研究结果显示,研究组治疗后的FBG、Fins、HOMA-IR水平较治疗前及对照组患者均降低,而对照组治疗前后Fins、HOMA-IR水平无明显变化,治疗后FBG水平较治疗前则显着升高,提示黄连素对精神分裂症患者的血糖具有调节作用,这与相关研究结果基本一致[9-11]。黄连素对血糖代谢的调节可能与其能够抑制胰岛素基因的表达,减少细胞中胰岛素及其mRNA的表达数量,从而对胰岛B细胞发挥保护作用有关[12]。除了抑制胰岛素的表达外,黄连素还可能增加AMP(adenosine monophosphate)激活蛋白激酶(AMPK)的活性及胰岛素受体的敏感性,进而改善IR,起到降低血糖的作用[13]。另外,黄连素可能通过抑制依赖于AMPK激活的线粒体呼吸链复合体Ⅰ,从而促进外周组织葡萄糖的消耗,起到降血糖的作用[14]。
越来越多的研究表明,精神分裂症患者存在由细胞因子介导的免疫功能异常,细胞因子可能参与精神分裂症的病因学机制[15]。目前,国内外关于黄连素与精神分裂症免疫学假说的关联性研究较少。已有的动物研究发现,黄连素可以抑制多种促炎性细胞因子如IL-1β、IL-6、TNF-α的表达,具有较强的抗炎作用[16-17]。Li等[18]研究显示,黄连素能够抑制内毒素血症小鼠血浆中TNF-α的表达,促进IL-10的表达,从而可抑制多种细胞因子如IL-1β、IL-6的产生。国内的动物研究也得到相似的结论[19]。然而,黄连素用于精神分裂症的临床研究少见报道。本研究尝试将黄连素作为治疗精神分裂症患者的辅助用药,结果显示治疗12周末,2组血清IL-1β、IL-6、TNF-α水平较治疗前均降低,且研究组较对照组上述指标下降更明显,考虑可能的原因是黄连素激活了巨噬细胞AMPK信号通路,抑制了多种炎症因子、细胞因子和趋化因子(如IL-1β、IL-6、TNF-α等)的表达,从而抑制炎症反应[20]。同时,黄连素可能通过抑制核因子-κB抑制蛋白(Iκ-B)的磷酸化和降解,减弱核因子-κB(nuclear factor-kappa B,NF-κB)的活性,引起TNF-α和IL-1β的分泌和释放的减少,抑制炎症反应[21]。
通常情况下,细胞因子可通过诱导胰岛素受体底物(IRS)的丝氨酸磷酸化,阻碍IRS酪氨酸磷酸化,导致IRS与胰岛素受体的结合能力下降,并抑制IRS激活其下游的磷脂酰肌醇3激酶(PI3K)的磷酸化过程,从而干扰IRS信号转导通路,导致IR。有研究认为,黄连素可以通过降低血清细胞因子(如IL-6、TNF-α)的分泌,从而改善IR[22]。TNF-α可引起胰岛内的巨噬细胞活化并释放IL-1,诱导一氧化氮合酶(NOS)表达,增加胰岛β细胞内的一氧化氮(NO)及NOS,从而抑制胰岛素发挥作用[23]。本研究结果显示,研究组HOMA-IR与IL-1β、IL-6、TNF-α均呈正相关,提示黄连素可能通过抑制精神分裂症患者血清中细胞因子IL-1β、IL-6、TNF-α的水平,从而降低血糖,提高胰岛素敏感性并改善IR。
综上所述,黄连素可改善患者的IR及炎症反应,减少疾病本身及抗精神病药带来的代谢紊乱及炎症反应,提高患者的生存质量。然而,本研究样本量相对较小,随机单盲的设计可能会带来入组的偏倚,有待进一步加大样本量采用随机双盲的方法进行研究。
[1]Liu YH,Zhang LX,Zhang XH.Association study of IL-10 gene promoter polymorphisms and efficacy of risperidone treatment of schizophrenic patients with first episode[J].Chin J Behav Med& Brain Sci,2014,23(10):913-916.[刘延辉,张立霞,张心华.白介素10基因启动子多态性与首发精神分裂症及利培酮疗效的关联[J].中华行为医学与脑科学杂志,2014,23(10):913-916]. doi:10.3760/cma.j.issn.1674-6554.2014.10.014.
[2]Ding WH,Cui DH.Progress on animal model of immune-related with schizophrenia[J].Chin J Behav Med&Brain Sci,2013,22(8):764-765.[丁文华,崔东红.免疫相关精神分裂症动物模型研究进展[J].中华行为医学与脑科学杂志,2013,22(8):764-765].doi:10.3760/cma.j.issn.1674-6554.2013.08.028.
[3]Rojo LE,Gaspar PA,Silva H,et al.Metabolic syndrome and obesity amongusersofsecondgenerationantipsychotics:Aglobal challenge for modern psychopharmacology[J].Pharmacol Res,2015,101:74-85.doi:10.1016/j.phrs.2015.07.022.
[4]Pina-Camacho L,Díaz-Caneja CM,Saiz PA,et al.Pharmacogenetic study of second-generation antipsychotic long-term treatment metabolic side effects(the SLiM Study):rationale,objectives,design and sample description[J].Rev Psiquiatr Salud Ment,2014,7(4):166-178.doi:10.1016/j.rpsm.2014.05.004.
[5]Zhang JJ,Tan HS.Progress of Berberine's Clinical Application[J]. Pharmaceutical and Clinical Research,2015,23(3):287-290.[张晶晶,谈恒山.黄连素的临床应用研究进展[J].药学与临床研究,2015,23(3):287-290].doi:10.13664/j.cnki.pcr.2015.03.022.
[6]Singh IP,Mahajan S.Berberine and its derivatives:a patent review(2009-2012)[J].Expert Opin Ther Pat,2013,23(2):215-231. doi:10.1517/13543776.2013.746314.
[7]Pang B,Zhao LH,Zhou Q,et al.Application of berberine on treating type 2 diabetes mellitus[J].Int J Endocrinol,2015,2015:905749.doi:10.1155/2015/905749.,
[8]Liu C,Wang Z,Song Y,et al.Effects of berberine on amelioration of hyperglycemia and oxidative stress in high glucose and high fat diet-induced diabetic hamsters in vivo[J].Biomed Res Int,2015,2015:313808.doi:10.1155/2015/313808.,
[9]Dai P,Wang J,Lin L,et al.Renoprotective effects of berberine as adjuvant therapy for hypertensive patients with type 2 diabetes mellitus:Evaluation via biochemical markers and color Doppler ultrasonography[J].Exp Ther Med,2015,10(3):869-876.
[10]Hu Y,Young AJ,Ehli EA,et al.Metformin and berberine prevent olanzapine-induced weight gain in rats[J].PLoS One,2014,9(3):e93310.doi:10.1371/journal.pone.0093310.
[11]Ding YM,Yan W,Wang HY,et al.The impact of berberine on leptin,adiponectin and insulin resistance in patients with type 2 diabetes mellitus[J].Jilin Medical Journal,2013,34(22):4461-4463.[丁怡敏,闫威,王怀颖,等.黄连素对2型糖尿病患者群瘦素、脂联素及胰岛素抵抗的影响[J].吉林医学,2013,34(22):4461-4463].doi:10.3969/j.issn.1004-0412.2013.22.022.
[12]Shen N,Huan Y,Shen ZF.Berberine inhibits mouse insulin gene promoter through activation of AMP activated protein kinase and may exert beneficial effect on pancreatic β-cell[J].Eur J Pharmacol,2012,694(1/2/3):120-126.doi:10.1016/j.ejphar.2012.07.052.
[13]Zhou L,Yang Y,Wang X,et al.Berberine stimulates glucose transportthroughamechanismdistinctfrominsulin[J]. Metabolism,2007,56(3):405-412.
[14]Xu M,Xiao Y,Yin J,et al.Berberine promotes glucose consumption independently of AMP-activated protein kinase activation[J].PLoS One,2014,9(7):e103702.doi:10.1371/ journal.pone.0103702.
[15]Karanikas EP.Psycho-immunological mechanisms in schizophrenia[J].Psychiatriki,2011,22(1):43-52.
[16]Zhang Y,Li X,Zhang Q,et al.Berberine hydrochloride prevents postsurgery intestinal adhesion and inflammation in rats[J].J Pharmacol Exp Ther,2014,349(3):417-426.doi:10.1124/ jpet.114.212795.
[17]Choo BK,Roh SS.Berberine protects against esophageal mucosal damage in reflux esophagitis by suppressing proinflammatory cytokines[J].Exp Ther Med,2013,6(3):663-670.
[18]Li F,Wang HD,Lu DX,et al.Neutral sulfate berberine modulates cytokine secretion and increases survival in endotoxemic mice[J]. Acta Pharmacol Sin,2006,27(9):1199-1205.
[19]He Y,Zhang EH,Zhong GQ,et al.Berberine inhibits myocardial inflammation in rat with chronic heart failure[J].Basic&Clinical Medicine,2013,33(6):718-721.[何艳,张恩浩,钟国强,等.黄连素抑制慢性心衰大鼠心肌炎性反应[J].基础医学与临床,2013,33(6):718-721].
[20]Jeong HW,Hsu KC,Lee JW,et al.Berberine suppresses proinflammatoryresponsesthroughAMPKactivationin macrophages[J].Am J Physiol Endocrinol Metab,2009,296(4):E955-964.doi:10.1152/ajpendo.90599.2008.
[21]Lee CH,Chen JC,Hsiang CY,et al.Berberine suppresses inflammatory agents-induced interleukin-1beta and tumor necrosis factor-alpha productions via the inhibition of IkappaB degradation in human lung cells[J].Pharmacol Res,2007,56(3):193-201.
[22]Li Z,Geng YN,Jiang JD,et al.Antioxidant and anti-inflammatory activities of berberine in the treatment of diabetes mellitus[J].Evid Based Complement Alternat Med,2014,2014:289264.doi:10.1155/2014/289264.[Epub 2014 Feb 11.]
[23]Kwon G,Xu G,Marshall CA,et al.Tumor necrosis factor alphainduced pancreatic beta-cell insulin resistance is mediated by nitric oxide and prevented by 15-deoxy-Delta12,14-prostaglandin J2 and aminoguanidine.A role for peroxisome proliferatoractivated receptor gamma activation and inos expression[J].J Biol Chem,1999,274(26):18702-18708.
(2016-01-22收稿2016-04-10修回)
(本文编辑陆荣展)
The impact of berberine on insulin resistance and cytokines in patients with schizophrenia
LI Jiangong1.2,ZHAO Yongping2,LIU Ying2,QIU Yuying2,LI Meijuan1.2,JIA Qiong1,ZHANG Jing1,LI Jie2△
1 Department of Psychiatry,Tianjin Medical University,Tianjin 300070,China;2 Department of Psychiatry,Tianjin Anding Hospital△
E-mail:tjlijie3827@163.com
ObjectiveTo explore the impact of berberine on serum levels of insulin resistance and cytokines in schizophrenia patients treated with risperidone.MethodsSixty-four schizophrenia patients treated with risperidone were randomized to berberine group(n=31)and control group(n=33).The fasting plasma blood glucose(FBG)and fasting insulin(Fins)were detected before and after treatment in two groups.The homeostasis model assessment for insulin resistance(HOMA-IR)was calculated.The serum levels of interleukin(IL)-1β,IL-6,tumor necrosis factor-alpha(TNF-α)were evaluated by enzyme linked immunosorbent assay before and after the treatment.ResultsCompared with control group and pre-treatment group,the levels of FBG,Fins,HOMA-IR,IL-1β,IL-6 and TNF-α were significantly decreased after treatment in berberine group(P<0.05).The FBG level was significantly higher,the levels of IL-1β,IL-6 and TNF-α were significantly lower,after treatment in control group(P<0.01).There were no significant changes in Fins and HOMA-IR after treatment(P>0.05).There was positive correlation between HOMA-IR and IL-1β,IL-6 and TNF-α in berberine group(r=0.316,0.351 and 0.401,P<0.01).ConclusionBerberine can significantly decrease FBG,Fins,HOMA-IR,IL-1β,IL-6 and TNF-α levels in schizophrenia patients treated with risperidone.The HOMA-IR level is closely correlated with IL-1β,IL-6 and TNF-α levels.
schizophrenia;insulin;blood glucose;interleukin-1beta;tumor necrosis factor-alpha;berberine;insulin resistance
R749.3
A
10.11958/20160027
天津市安定医院院级课题基金资助(1507)
1天津医科大学精神病与精神卫生专业(邮编300070);2天津市安定医院八科
李建功(1983),男,住院医师,硕士在读,主要从事生物精神病学研究
E-mail:tjlijie3827@163.com



