杨雪圆,冯超,冯津萍△
主动脉瓣狭窄(aortic stenosis,AS)是一种心脏瓣膜病,由于风湿性、老年退行性以及先天畸形等原因导致主动脉瓣在收缩期不能完全开放使得左心室射血受阻。研究表明,74岁以后瓣膜病发病率逐年上升[1]。尽管当前各类手术可以彻底解决瓣膜疾病,但临床上仍有一部分患者存在手术禁忌证,这类患者仅能通过药物治疗改善或缓解临床症状。AS早期可通过增加左心室做功代偿延长左心室射血期,血压可代偿在正常水平,甚至出现收缩压(SBP)的升高,随着疾病进展至失代偿期,心肌收缩力降低,左心室射血减少,患者多表现为SBP和脉压的减低[2]。高血压使主动脉瓣狭窄的代偿过程缩短,增加AS 心脏泵血阻力及心脏做功。Rahimi 等[3]发现SBP 升高20 mmHg(1 mmHg=0.133 kPa),AS 风险增加41%;舒张压(DBP)升高10 mmHg,AS 风险增加24%。然而Lauten等[4]发现低血压可加重AS患者病死率,且Kawase等[5]指出SBP<120 mmHg与AS的1年内病死率增加有关。目前AS 与血压之间关系尚不明确,本研究旨在分析重度AS不良预后的危险因素,以及血压波动与其不良预后的关系。
1 对象与方法
1.1 研究对象 连续收集天津市胸科医院心脏重症病房2018 年12 月—2022 年3 月收治的慢性心力衰竭(CHF)急性失代偿患者共91例。纳入标准:(1)根据2021年欧洲心脏病学会(ESC)心力衰竭指南[6]以及《中国心力衰竭诊断和治疗指南2018》[7]明确诊断为心力衰竭。(2)纽约心脏病协会(NYHA)分级Ⅱ—Ⅳ级。排除标准:(1)原发性轻度及中度AS、原发性AS 以外的其他瓣膜疾病、先天性心脏病、肺源性心脏病、肥厚性心肌病、各类心包疾病、心肌炎以及主动脉夹层。(2)甲状腺疾病、恶性肿瘤、免疫系统疾病、白血病、淋巴瘤等疾病。(3)严重肝功能不全(肝功能Child C级患者)或严重肾功能不全[根据CKD-EPI 公式计算,估算肾小球滤过率(eGFR)≤15 mL·min-1·1.73 m-2]。(4)妊娠期或哺乳期。
1.2 分组标准 (1)AS 组。纳入重度AS 患者的诊断标准,根据《中国成人心脏瓣膜病超声心动图规范化检查专家共识》[8]推荐标准符合以下条件之一者:①主动脉瓣瓣口面积<1 cm2;②主动脉瓣峰值流速≥4 m/s;③主动脉瓣平均跨瓣压差≥40 mmHg。(2)非主动脉瓣狭窄(NAS)组。非重度AS的心力衰竭患者。
1.3 资料收集
1.3.1 临床资料收集 通过天津市胸科医院电子病历库收集入组者的一般基线资料,包括年龄、性别、体质量指数(BMI)、吸烟史、糖尿病史、高血压史、动脉阻塞性疾病(包括陈旧性脑梗死和外周动脉阻塞性疾病)、入院当天心力衰竭症状和体征以及入院期间药物使用情况[包括肾素-血管紧张素系统抑制剂(RASi):血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体拮抗剂(ARB)/血管紧张素受体脑啡肽酶抑制剂(ARNI)、螺内酯、β 受体阻滞剂、钠-葡萄糖协同转运蛋白2 抑制剂(SGLT2-i)、口服利尿剂、正性肌力药物、血管扩张剂等]。
1.3.2 血压相关指标 收集患者晨起5点以及下午8点血压值,入院后前3 d及出院前2 d血压平均值分别为入院平均血压及出院平均血压。计算收缩压差(ΔSBP)=入院平均收缩压-出院平均收缩压,舒张压差(ΔDBP)=入院平均舒张压-出院平均舒张压,入/出院平均动脉压(MAP)=1/3 入/出院平均收缩压+2/3入/出院平均舒张压。
1.3.3 血清学及心脏超声指标 收集入院次日空腹血检测的白细胞计数(WBC)、中性粒细胞百分比(NE)、肌酐(Cr)、白蛋白(ALB)、总胆红素(TBIL)、谷氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和B 型钠尿肽(BNP)。收集入院3 d 内的心脏超声指标,包括左心室射血分数(LVEF)、肺动脉收缩压(PASP)以及左心房前后径(LAD)。根据血清Cr 水平,采用慢性肾脏病流行病学协作组(CKD-EPI公式)计算eGFR。
1.4 随访 分别于出院后第2、4、12、24、48周进行5次随访,随访方式以电话为主,部分以门诊形式。主要终点事件为全因死亡和(或)因心力衰竭再入院的复合终点,次要终点事件为心源性死亡。
1.5 统计学方法 采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,非正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,组间差异比较采用独立样本t检验或秩和检验;计数资料以例(%)表示,组间比较采用χ2检验或Fisher 确切概率法;采用Kaplan-Meier 法绘制生存曲线,采用Log-rank 检验比较生存率的差异。采用单因素和多因素Cox 回归模型分析AS 患者发生主要及次要终点事件的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 2组一般临床资料比较 最终纳入91例患者,其中男59 例,女32 例,年龄55~94 岁,平均(74.68±8.80)岁;AS 组50 例,NAS 组41 例。AS 组年龄、BMI及吸烟、双下肢水肿、糖尿病比例高于NAS 组;动脉阻塞性疾病、服用RASi、螺内酯、β受体阻滞剂、口服利尿剂、静脉使用正性肌力药、血管扩张药以及利尿剂比例低于NAS组(P<0.05)。见表1。
2.2 2组血压相关指标比较 2组入院基础血压、入院平均血压、入院MAP、出院平均血压、出院MAP、ΔSBP和ΔDBP差异均无统计学意义,见表2。
2.3 2 组血清学及心脏超声指标比较 AS 组ALB及BNP 水平低于NAS 组,PASP 水平高于NAS 组(P<0.05),其他指标在2 组间差异无统计学意义(P>0.05)。见表3。

Tab.3 Comparison of serological examination and cardiac ultrasound indexes between the AS group and the NAS group表3 AS组和NAS组血清学检查及心脏超声指标比较[M(P25,P75)]
2.4 AS 组与NAS 组预后分析 所有患者均完成随访,47 例(51.6%)患者发生主要终点事件(AS 组30例,NAS 组17 例),12 例(13.2%)发生次要终点事件(AS 组10 例,NAS 组2 例)。Kaplan-Meier 生存分析结果表明,AS 组主要终点事件发生率(Log-rankχ2=4.695,P=0.030)及次要终点事件发生率(Log-rankχ2=4.331,P=0.037)均高于NAS组,见图1、2。

Fig.1 Kaplan-Meier curve of all-cause death and/or heart failure readmission in the AS group and the NAS group图1 AS组与NAS组全因死亡和(或)因心力衰竭再入院的Kaplan-Meier曲线
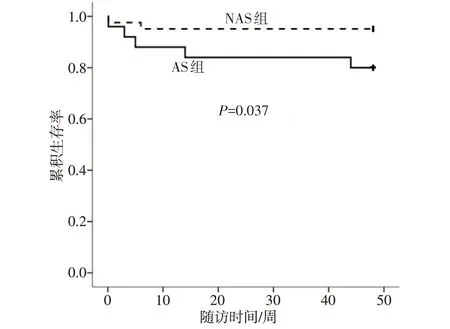
Fig.2 Kaplan-Meier curve of cardiac death of the AS group and the NAS group图2 AS组与NAS组心源性死亡的Kaplan-Meier曲线
2.5 AS 不良预后危险因素分析 单因素Cox 回归分析结果显示,高龄,合并糖尿病(无=0,有=1)、高血压(无=0,有=1),NE、Cr、PASP、入院基础SBP、入院平均SBP、ΔSBP 升高是主要终点事件的危险因素,口服RASi(无=0,有=1)是主要终点事件的保护因素(均P<0.05),见表4。高龄、Cr、LVEF、PASP、入院MAP、ΔSBP 和ΔDBP 升高是次要终点事件的危险因素(均P<0.05),见表5。将上述单因素分析结果差异有统计学意义的变量纳入多因素Cox回归分析模型,结果显示,高龄、合并高血压、ΔSBP和NE升高是影响主要终点事件的独立危险因素,口服RASi是主要终点事件的独立保护因素(均P<0.05),而高龄、ΔSBP 和ΔDBP 升高是影响次要终点事件的独立危险因素(均P<0.05),见表6、7。

Tab.4 Univariate Cox regression analysis of primary endpoint events for AS patients表4 AS患者主要终点事件的单因素Cox回归分析
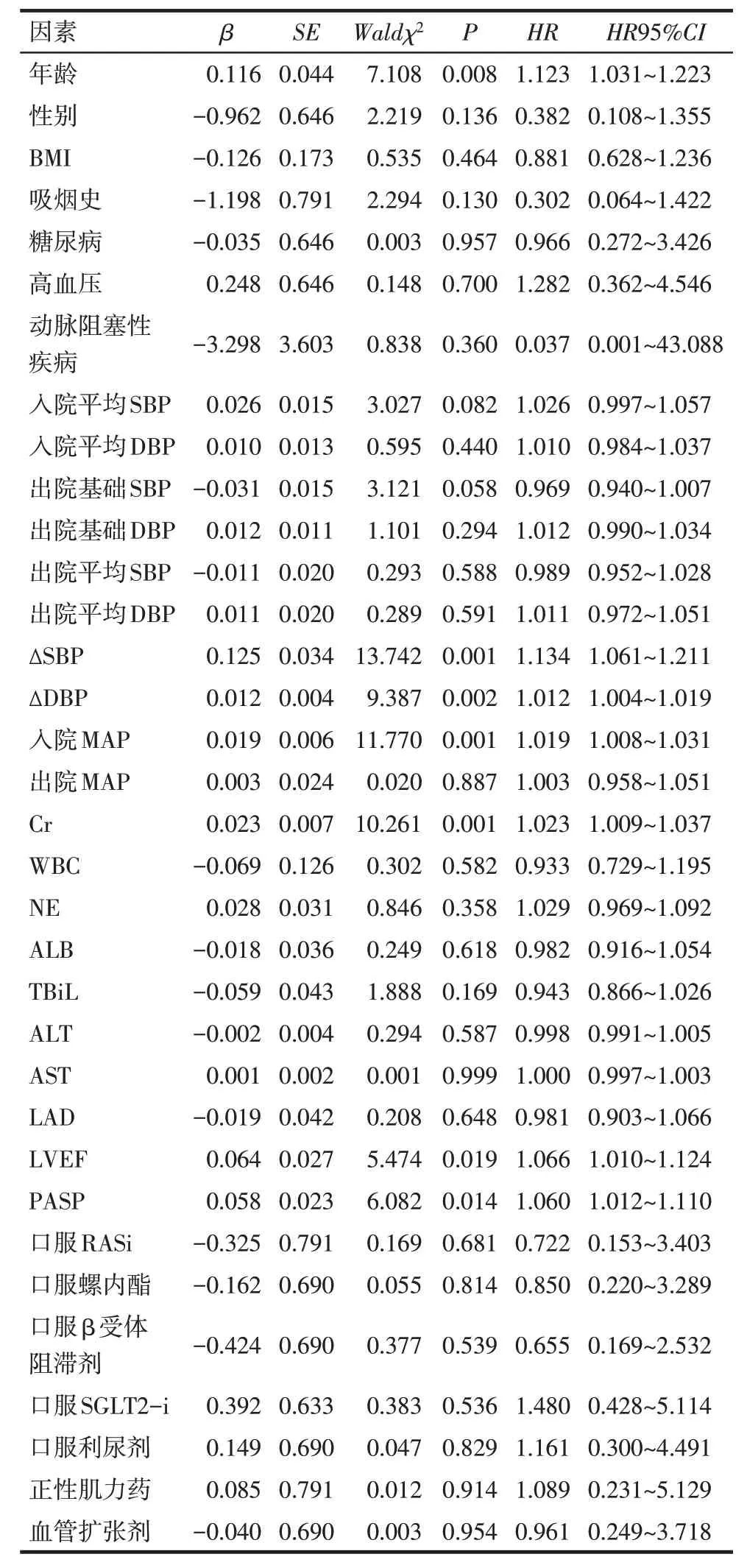
Tab.5 Univariate Cox regression analysis of secondary endpoint events for AS patients表5 AS患者次要终点事件的单因素Cox回归分析

Tab.6 Multivariate Cox regression analysis of primary endpoint events for AS patients表6 AS患者主要终点事件的多因素Cox回归分析

Tab.7 Multivariate Cox regression analysis of secondary endpoint events for AS patients表7 AS患者次要终点事件的多因素Cox回归分析
2.6 亚组分析 根据是否合并高血压将AS组分为高血压亚组(26例)与非高血压亚组(24例),高血压亚组主要终点事件发生率高于非高血压亚组(P<0.05),2 组间次要终点事件发生率差异无统计学意义,见表8。Kaplan-Meier 生存分析结果表明,AS 合并高血压亚组主要终点事件发生率高于非高血压亚组(Log-rankχ2=11.059,P=0.001),见图3。

Fig.3 Kaplan-Meier curve of all-cause death and/or heart failure readmission of the hypertensive subgroup and the non-hypertensive subgroup图3 高血压亚组与非高血压亚组的全因死亡和/或因心力衰竭再入院事件的Kaplan-Meier曲线

Tab.8 Results of endpoint events in the non-hypertensive and hypertensive subgroups of the AS group表8 AS组非高血压亚组与高血压亚组终点事件发生结果[例(%)]
根据ΔSBP 四分位数(P25=-7.04,P50=-1.00,P75=13.75)将AS 组分为4 个亚组,主要终点事件发生率随着ΔSBP 的增大而增高(P<0.05);在次要终点方面存在同样的趋势(P<0.001),见表9。Kaplan-Meier生存分析结果表明,ΔSBP越大,AS组主要终点事件发生率越高(Log-rankχ2=19.791,P<0.001),见图4。

Fig.4 Kaplan-Meier curve of all-cause death and/or heart failure readmission of AS with the different ΔSBP groups图4 AS不同ΔSBP组的全因死亡和(或)因心力衰竭再入院事件的Kaplan-Meier曲线
3 讨论
3.1 AS 患者生存率减低 主动脉瓣在心脏瓣膜中起到“总开关”的作用,对心脏功能有重要影响。由于AS 独特的血流动力学变化,临床上血管扩张剂、正性肌力药等药物的使用存在局限性。此外,AS增加心脏做功,破坏心脏正常血流动力学,导致患者生存率极低。
3.2 高血压是AS发生发展的危险因素 本研究发现高血压是AS发生不良预后的独立危险因素,合并高血压的AS 患者因心力衰竭再住院或全因死亡发生风险增加10 倍左右。Tromso 研究[9]指出,SBP 及DBP 增高是AS 发生的独立危险因素。2017 年CANHEART 的前瞻性研究[10]发现,高血压与AS 发生发展密切相关。高血压降低主动脉瓣压力梯度,使得瓣口面积相对增加,AS 程度低估[11],故而对于AS合并高血压患者,在注意防范高血压对疾病本身影响的同时,还应注意结合患者症状及体征正确评估狭窄程度,使其得到正确及时的治疗。
3.3 高血压影响AS患者预后的潜在机制 长期高血压一方面导致左心室肥厚、心室壁血供相对不足,降低心室质量指数,使得左心室储备降低;另一方面,高血压使得主动脉瓣承受应力增高,加剧瓣膜机械性损伤[5]。此外,高血压和AS与炎症反应之间关系密切。两者均会激发炎症反应[12],促进淋巴细胞及巨噬细胞浸润,导致转化生长因子(TGF)-β1以及白细胞介素(IL)-1分泌,加剧氧化应激,进而导致细胞凋亡、线粒体功能障碍、血管内皮功能障碍、血管硬化以及血管生成减少,由此导致血流动力学紊乱,加重AS 射血阻力[13-14]。肾素-血管紧张素-醛固酮系统(RAAS)激活是高血压发病的重要机制之一。血管紧张素(Ang)-Ⅱ通过诱导TGF-β1、核因子(NF)-κB等激活心脏成纤维细胞、胞外基质、胶原蛋白以及层黏连蛋白分泌增加,促进瓣膜纤维化、硬化及钙化[15]。研究表明使用RAAS抑制剂降压治疗可减少Ang-Ⅱ生成,改善瓣膜重塑、主动脉瓣钙化进展、内皮细胞功能以及稳定斑块等作用,降低AS 患者死亡风险[16-17]。故而,应积极防范高血压并控制血压以利于控制AS的发展以及不良预后的发生,延长此类患者的寿命。
3.4 收缩压波动对AS 的影响 有文献报道SBP 的升高是AS 进展的危险因素之一[18]。但Kawase 等[5]发现低水平的SBP 与AS 高病死率相关。SBP 对AS的影响存在不确定性。Nielsen 等[19]建议,将AS 患者的SBP维持在130~139 mmHg,此时患者病死率及因心力衰竭再入院率发生最低。Basile等[17]针对AS合并高血压患者进行研究,同样推荐上述SBP范围。本研究发现ΔSBP 较基础SBP 以及平均SBP 水平对AS 的进展及预后的影响更为重要,ΔSBP 是AS 患者发生主要终点事件以及心源性死亡事件的独立危险因素。SBP 是在主动脉瓣开放阶段,左心室射出的血液作用于动脉壁的压力。收缩压波动程度增加,瓣膜应力增强,机械性损害加重,导致瓣膜间质细胞分泌产生大量矿质颗粒,是主动脉瓣钙化性狭窄进展加快的重要机制之一。此外,SBP 异常波动与异常的RAAS 激活、内皮细胞损伤以及炎症细胞浸润密切相关,均会导致AS的进展及恶化。
3.5 年龄对AS 的影响 随着年龄的增长,主动脉瓣弹力纤维分泌减少,间质细胞活性减低,导致瓣膜退行性改变以及钙化[20]。高龄作为心血管疾病常见传统危险因素,导致主动脉瓣血管弹力纤维减少,动脉硬化加重,血管顺应性减低,对血流冲击等刺激承受力减低,主动脉扩张[21]。有研究发现主动脉扩张性的减低与AS 不良心血管事件独立相关[22]。这可能与患者远端血管承受左心室射出血流的能力降低、左心室后负荷增加相关。
3.6 降压药物对AS的影响 早期RASi作为血管扩张剂不建议使用于AS患者,防止心脏前向血流的急剧减少,引起脑灌注不足、低血压、心绞痛等症状。近些年研究表明,使用RASi 可以明确降低AS 患者病死率[16]。本研究结果显示AS患者使用RASi是发生主要终点事件的保护因素,但使用该类药物能否改善AS预后还有待更全面的研究去证实。
综上所述,AS 降低患者生存率,高血压、ΔSBP增加及高龄是AS不良预后的独立危险因素,且血压波动越大,生存时间越短,预后越差。本研究为回顾性、单中心研究,样本量较小,研究结论尚需后期开展多中心、前瞻性、大样本研究来进一步证实。



