粟莎莎, 张姝, 黄健, 陈曦, 李艳, 方立超, 邓钧, 莫非**, 郑峻松**
(1.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 2.贵州医科大学附院 临床检验中心, 贵州 贵阳 550004; 3.陆军军医大学 药学与检验医学系, 重庆 400038)
DNA甲基化是DNA化学修饰的一种形式,在细胞分化、基因表达调控及基因组稳定等方面起着重要作用[1-3]。研究表明,异常DNA甲基化与癌症等人类很多疾病相关,肺癌CDKN2A基因、肝癌ARID2基因、结肠癌CDKN2A基因及白血病HOXA10基因等甲基化可作为肿瘤标志物[4-10],因此,DNA甲基化检测对于肿瘤的预测、诊断和治疗具有重要意义。传统的DNA甲基化检测技术主要有甲基化敏感限制性内切酶分析 (MSRE)[11]、重亚硫酸氢盐测序 (Bisulfite-Seq)[12]和甲基化免疫共沉淀(MeDIP)[13],这些方法大多操作繁琐、耗时,且需要昂贵的仪器设备[14-16],而DNA电化学传感器因操作简便、快速、灵敏,能选择性识别待分析对象中的电化学活性物质,是理想的快速分析DNA甲基化的手段[17-19]。目前大多数应用电化学传感器检测DNA甲基化的研究主要是通过检测DNA甲基转移酶活性以间接反映DNA甲基化水平,而不能精确测定DNA中5-甲基胞嘧啶(5-mC)的水平[20-23];此外,DNA甲基转移酶仅催化双链DNA中特定序列发生甲基化,不能定量检测多甲基化位点的靶序列。本研究拟构建一种简单、直接,能有效分析DNA序列中5-mC数量的电化学生物传感器,从而为临床DNA甲基化位点的定量检测提供一种简便有效的方法。
1 材料与方法
1.1 材料
1.1.1DNA序列 实验所用探针及不同甲基化数量的靶DNA序列均由上海生工生物工程有限公司合成,-20 ℃保存备用,见表1。

表1 实验所用DNA序列Tab.1 The base sequences of DNA used in this experinment
注:“/i5med C/”表示甲基化位点,DNA S0为非甲基化DNA,DNA S1~S5分别为含有1、2、3、4、5个甲基化位点的靶DNA。
1.1.2主要试剂 铁氰化钾(K3[Fe(CN)6])、亚铁氰化钾(K4Fe(CN)6·3H2O)、氯化钾(KCl)、氯金酸(HAuCl4·3H2O)、三(2-羧乙基)膦盐酸盐(TCEP)、巯基己醇(MCH)及牛血清白蛋白(BSA)均购自上海生工生物工程有限公司,5-mC抗体及HRP-IgG购自Abcam公司,氯化钠(NaCl)、硝酸钾(KNO3)、氯化镁(MgCl2)购自国药集团化学试剂有限公司;三羟甲基氨基甲烷乙二胺四乙酸(Tris-EDTA, TE)缓冲液、对苯二酚、氯化钾(KCl)购自北京鼎国昌盛生物技术有限责任公司;其他所用试剂均为分析纯,实验用水均为超纯水(电阻率18.2 MΩ·cm)。
1.1.3仪器 超声波清洗仪、电子天平、CHI660D电化学工作站(上海辰华仪器公司),电极为三电极体系,辅助电极为铂丝电极,参比电极为Ag/AgCl电极,工作电极为金电极(直径为2 mm)。
1.2 方法
1.2.1纳米金修饰金电极(AuNPs/Au)的制备 将直径为2 mm的金电极用0.05 μm的Al2O3粉打磨成镜面,然后分别在超纯水、无水乙醇、超纯水中超声清洗5 min。室温晾干后,将电极放入现配的Piranha溶液(98% H2SO4与30% H2O2按3 ∶1的体积混合)中活化15 min以上,然后用超纯水彻底清洗干净,氮气吹干。将上述处理好的金电极浸入3 mmol/L HAuCl4·3H2O(含0.1 mol/L KNO3)溶液中,于-0.2 V电位下沉积120 s,最后用超纯水充分淋洗干净,制得AuNPs/Au。
1.2.2DNA电化学传感器的制备 向AuNPs/Au电极表面滴加10 μL含有0.1 μmol/L 探针DNA、50 mmol/L NaCl和1.0 mmol/L TCEP的1×TE缓冲液(pH 7.4),于4 ℃孵育过夜,使末端巯基化的DNA探针通过Au-S键固定在电极表面。取出电极,用PBS充分淋洗去除多余吸附的DNA,即制得单链DNA(ssDNA)修饰的AuNPs/Au(ssDNA/AuNPs/Au)。然后滴加1 mmol/L MCH 10 μL,室温放置1 h,以封闭电极表面的空白位点,PBS淋洗电极后氮气吹干。继续滴加10 μL含0.1 μmol/L靶DNA、50 mmol/L NaCl和10 mmol/L MgCl2的1×TE缓冲液(pH 7.4),于37 ℃水浴箱杂交90 min。杂交完成后,电极用PBS重复冲洗3次,得到双链DNA(dsDNA)修饰的AuNPs/Au(dsDNA/AuNPs/Au),即制得实验所用DNA电化学传感器。
1.2.3抗5-mC和HRP-IgG的固定 将上述制备的电极用5% BSA室温封闭30 min以防止后续加入抗体的非特异性吸附。向电极表面滴加10 mg/L抗5-mC抗体10 μL,37 ℃孵育1 h后,再次淋洗电极;继续滴加80 mg/L HRP-IgG 10 μL,于室温孵育30 min;以上两步反应每一步后均用PBS重复淋洗3次后再进行下一步操作。
1.2.4电化学测定 在含1 mmol/L H2O2和1 mmol/L对苯二酚的PBS溶液中,采用差分脉冲伏安法(DPV)进行电化学测定。测定参数:电位扫描范围- 0.3 ~ 0.1 V、采样间隔0.016 7 s、脉冲宽度0.05 s、脉冲周期0.2 s、静止时间2 s。
1.3 观察指标
(1)对电极进行电化学表征,裸金电极经过纳米金修饰、探针固定、MCH封闭及靶序列杂交的修饰,每一步修饰后均在含0.1 mol/L KCl的1 mmol/L[Fe(CN)6]3-/4-溶液中采用循环伏安法(CV)进行电化学表征;(2)DNA甲基化电化学测定条件的优化,包括杂交时间的优化及抗5-mC抗体浓度的优化;(3)可行性分析,对甲基化和非甲基化DNA进行电化学测定,区分甲基化与非甲基化DNA;(4)DNA甲基化位点定量分析,分别对DNA S1~S5进行检测,观察DPV峰电流与靶DNA甲基化位点数量的关系;(5)重复性及稳定性检测。
2 结果
2.1 电极的电化学表征
采用CV法进行电极的电化学表征,结果显示,裸金电极在0.2~0.3 V出现一对明显的氧化还原峰,电势差小于0.1 V,提示[Fe(CN)6]3-/4-在电极表面转移速度快;当电沉积纳米金后,由于电极表面的AuNPs有效提高电极比表面积,促进电子转移,所以氧化还原峰电流增高;当电极表面修饰上探针后,由于其带负电荷的磷酸骨架排斥溶液中同样带负电荷的离子扩散至电极表面,所以氧化还原峰电流减小,氧化峰与还原峰之间的电位差增大。同样,当MCH成功修饰上电极后,排斥溶液中同样负电荷的[Fe(CN)6]3-/4-,峰电流进一步减小;当与靶序列杂交后,由于电极表面的负电荷增多,峰电流继续减小,氧化还原峰之间的电位差进一步增大。电化学表征结果表明各成分均成功修饰到电极上,电极组装成功。见图1。

注:a为裸金电极,b为纳米金修饰金电极,c为探针固定,d为MCH封闭,e为靶序列杂交。图1 DNA电化学传感器自组装CV表征Fig.1 Characterization of CV obtained for the self-assembling biosensor
2.2 DNA甲基化电化学测定条件的优化
2.2.1杂交时间的优化 杂交时间是影响传感器性能的重要因素,随着杂交时间从0延长到180 min,DPV峰电流一开始迅速增大,杂交90 min后变化不大,为了节约时间,提高传感器分析效率,最终选择90 min为最优杂交时间。见图2。
2.2.2抗5-mC抗体浓度的优化 抗体浓度直接影响其与5-mC的结合,因此,需要对抗5-mC抗体浓度进行优化。随着抗体浓度增加,峰电流迅速升高,但当抗体浓度超过10 mg/L,电流趋于平缓,说明反应达到饱和,因此,选择10 mg/L浓度为最佳浓度。见图3。
2.3 DNA甲基化电化学检测的可行性分析
由于甲基化DNA能特异性结合抗5-mC抗体,与抗体结合的HRP-IgG能催化H2O2还原产生电流,通过测定电流的大小可区分甲基化和非甲基化DNA。实验结果表明,非甲基化DNA的DPV峰电流极其微弱,可能是由于部分抗5-mC抗体非特异性吸附在电极表面而形成;而甲基化DNA则出现较强的峰电流,约5.2 μA,说明该方法可以有效区分甲基化与非甲基化DNA。见图4。
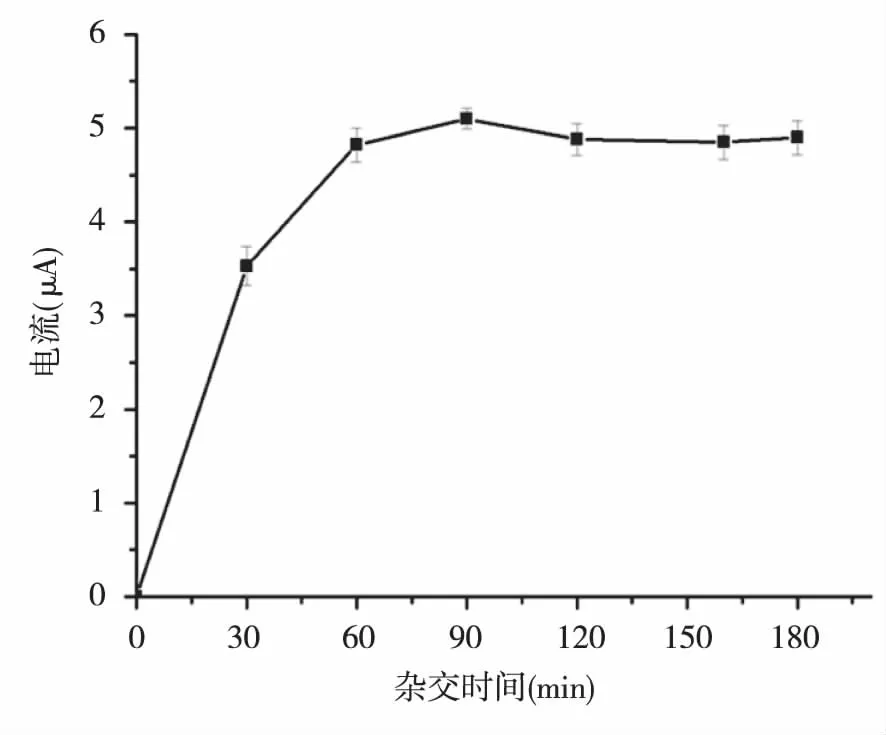
图2 杂交时间对DPV峰电流的影响Fig.2 Effect of hybridization time on DPV peak current

图3 抗5-mC抗体浓度对DPV峰电流的影响Fig.3 Effect of anti 5-mC concentration on DPV peak current

注:a为甲基化DNA,b为非甲基化DNA。图4 甲基化与非甲基化DNA的DPV检测信号Fig.4 DPV signal of methylated and unmethylated DNA
2.4 DNA甲基化位点定量分析
分别对0.1 μmol/L 的DNA S1~S5进行检测,随着DNA甲基化位点数量的增加,DPV峰电流随之增高,以甲基化位点数量和DPV峰电流值分别为横纵坐标作图,并计算得回归方程I(μA)=1.598N+3.309,r=0.991,在1~5个甲基化位点范围内,DPV峰电流与靶DNA甲基化位点的数量呈线性关系。 见图5。

注:a、b、c、d、e分别为1、2、3、4、5个甲基化位点。图5 不同数量甲基化位点的DPV曲线及回归曲线Fig.5 The DPV curve obtained from methylated DNA with different numbers of methylation sites and the regression curve
2.5 重复性及稳定性
在相同条件下,对含一个甲基化位点的靶DNA重复测定5次,得到相对标准差(RSD)约为6.49%,证明该方法重复性在可接受范围内。此外,将制备的传感器于0.1 mol/L PBS溶液中4 ℃放置28 d,结果峰电流仍维持在最初峰电流的92.6%,表明所制备的传感器具有较好的稳定性。
3 讨论
电化学传感分析是通过将分析体系中识别分子与靶分子的相互作用转化为电响应信号而实施的一类具有响应快速、灵敏度高、操作方便、成本低等优点的新型分析技术,在临床疾病的快速诊断、疗效观察等方面具有广阔的应用前景[24-26]。
电极的组装是DNA甲基化分析的关键技术之一,本实验通过电沉积的方式将AuNPs修饰到电极表面后,末端巯基化的DNA探针与AuNPs之间形成Au-S键使得探针牢牢固定在电极表面,利用MCH封闭电极表面的空白位点,防止DNA非特异性吸附,靶DNA与探针之间则通过碱基互补配对的作用杂交形成双链DNA,从而将靶DNA连接到电极表面。对电化学生物传感器的每一步修饰效果用CV进行表征,最先当电极表面修饰上AuNPs后,氧化还原峰电流增高,说明电沉积制备的AuNPs有效促进了电子转移,从而提高传感器的灵敏度。当在电极表面依次组装上探针DNA、MCH和靶DNA后,由于其带负电荷的磷酸骨架排斥溶液中同样带负电荷的粒子扩散至电极表面,所以氧化还原峰电流逐渐减小,氧化峰与还原峰之间的电位差增大。这些结果表明,各成分均成功修饰到电极上,电极组装成功。
为了提高传感器的性能,研究中对杂交时间和5-mC抗体浓度两个重要条件进行了优化,实验结果表明,杂交时间为90 min可获得最佳杂交效果,5-mC抗体浓度为10 mg/L为最佳孵育条件。在此优化的条件下,本实验分析了含1、2、3、4、5个甲基化位点的靶DNA,以5-mC抗体为捕获抗体,以HRP标记的抗5-mC抗体IgG作为电化学信号示踪物,结果表明,DPV峰电流的大小是与靶DNA中甲基化的数量成正比的,所以该方法可用于DNA甲基化位点的定量分析。由于大多数报道主要通过甲基转移酶催化产生的单个甲基化位点进行检测,不能分析多个甲基化位点的DNA靶序列,并且由于不同个体内环境差异可能对酶活性产生影响,因而,通过检测甲基转移酶的活性来反映甲基化水平并不是最可靠的分析手段。在本研究中,随着甲基化位点数量的增多,结合到电极表面的HRP-IgG就越多,因此获得的电流信号就越高,通过DPV峰电流大小与DNA甲基化位点的数量关系,实现了DNA甲基化位点的定量检测,线性方程为I(μA)= 1.598 N+3.309,相关系数为0.991。
综上所述,本研究成功构建用于DNA多甲基化位点定量分析的电化学生物传感器,方法简单、直接、特异性好,无需重亚硫酸氢盐转化和PCR扩增等繁琐的步骤,有望应用于癌症和其他相关疾病的临床诊断及发病风险的评估。



