李璨, 陆爽*, 吴君
(贵州医科大学 感染病学教研室, 贵州 贵阳 550004)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指无大量饮酒、排除病毒性肝炎等其他已明确的因素外,以肝细胞脂肪变性和蓄积为特征的综合性病变[1]。随着人们饮食结构和生活方式的改变,NAFLD的发病率呈现逐年增高趋势,在我国,NAFLD的发病率将有可能超越病毒性肝炎,成为导致肝纤维化、肝硬化甚至肝癌的主要原因[2]。非酒精性脂肪性肝纤维化是肝炎最终发展为肝癌的重要阶段,但至今该疾病发生的机制尚不清楚,亦无确切有效的药物对其进行干预[3],因此,积极探索NAFLD肝纤维化的发病机制及其可能的治疗靶点的研究十分必要和迫切[4]。本课题组前期根据中药各方剂组成药材的功效,将丹参、黄芪、汉防己等9味中药熬制为汤药,应用于临床肝纤维化患者疗效颇佳,后期经加工制成复方制剂丹防胶囊。本研究对C57BL/6J小鼠采用高脂饮食喂养建立非酒精性脂肪性肝纤维化模型[5],造模同时给予丹防胶囊灌胃干预,于干预8周时观察小鼠血糖、甘油三酯(TG)、胆固醇(TC)、谷丙转氨酶(ALT)及谷草转氨酶(AST)水平变化,同时取小鼠肝组织,检测TGF-β1、Smad2、α-平滑肌(α-smooth muscle atin,α-SMA)蛋白和mRNA及col-Ⅳ mRNA表达,探索丹防胶囊干预小鼠酒精性脂肪性肝纤维化效果及可能作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物及药物 30只SPF级雄性C57BL/6J小鼠,8周龄,体质量(18±1.4) g,购于贵州医科大学动物实验中心;丹防胶囊购于贵阳天阳公司(尚未申报新药)。本研究获得贵州医科大学伦理委员会批准。
1.1.2主要试剂 TGF-β1、Smad2、α-SMA抗体(Abcam ab53100、ab33875、ab32575)、GAPDH抗体(Cell Signaling 14C10)、二抗(中杉金桥ZB-2301)、TB Green premix Ex TaqII(Tli RNaseH plus)、引物(上海生工)、总RNA提取试剂盒(TianGen Dp 419)。
1.2 方法
1.2.1动物分组及处理 30只SPF级雄性C57BL/6J小鼠按随机数字法均分为正常组、模型组及丹防组。模型组及丹防组小鼠给予高脂饮食(60%脂肪及2%胆固醇)喂养8周[6]、建立非酒精性脂肪性肝纤维化模型,正常组小鼠给予普通饮食;造模同时给予丹防组1.22 g/20 g丹防胶囊灌胃[7]、正常组与模型组给予等量生理盐水灌胃,1次/d,共8周。第8周时,记录小鼠体质量,检测血糖、TG、TC、ALT及AST;然后麻醉处死小鼠后记录肝脏重量,并迅速取肝右叶相同部位固定行肝组织病理学检查;取剩余肝组织,采用逆转录实时荧光定量PCR(RT-qPCR)方法检测TGF-β1、Smad2、α-SMA及col-Ⅳ mRNA表达水平,采用Western blot法检测TGF-β1、Smad2及α-SMA蛋白水平。
1.2.2HE染色 取厚约4 μm的石蜡切片经脱蜡水化后,苏木素染色5 min,分化10 s后置于1×PBS 处理5 min;伊红染色1 min,蒸馏水冲洗;经脱水及透明后中性树胶封片。200×镜下观察,采集图片。
1.2.3油红O染色 取厚约6 μm的冰冻切片经蒸馏水漂洗,转入60%异丙醇中漂洗20 s,进行油红O染色5~10 min;60%异丙醇洗掉染液,再经苏木素复染1 min、盐酸酒精分化10 s及PBS漂洗10 min后,封片剂封片。200×镜下观察,采集图片。
1.2.4天狼星红染色 各组厚约6 μm的石蜡切片经二甲苯脱蜡后天狼星红色液滴染1 h;流水冲洗去除残夜,苏木素复染8~10 min,1×PBS漂洗3次,5 min/次;常规脱水透明,中性树胶封片。200×镜下观察,采集图片,通过Image Pro plus6.0测量出现纤维化部分的面积。
1.2.5Western blot 称取20 mg小鼠肝组织,液氮研磨并加入裂解液提取肝组织蛋白,按4 ∶1加入5×蛋白上样缓冲液,置于100 ℃金属浴中加热10 min;配制12% SDS-PAGE凝胶电泳及转膜,5%脱脂奶粉常温封闭1 h,加入一抗TGF-β1(1 ∶1 000)、Smad2(1 ∶1 500)、α-SMA(1 ∶3 000)、GAPDH(1 ∶6 000),4 ℃孵育过夜,加入二抗(1 ∶5 000)常温孵育50 min后曝光;以GAPDH为内参照,经Image J软件分析各组蛋白条带灰度值。
1.2.6RT-qPCR 严格按照试剂盒说明书提取小鼠肝组织总mRNA,测定mRNA浓度及纯度。逆转录后按PCR操作说明书进行qPCR操作,反应体系为上下游引物混合物2 μL、cDNA 1.6 μL、SYBR 10 μL、ROX Ⅱ 0.4 μL及 ddH2O 6 μL,反应条件为95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s,40个循环。以GAPDH为内参照,每组样本设置3个复孔,采用2-△△CT值计算基因表达量。引物序列及产物大小见表1。

表1 RT-qPCR引物序列及产物大小Tab.1 RT-qpcr primer sequence and sequence fragment size
1.3 统计学方法
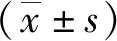
2 结果
2.1 一般情况
实验过程中,正常组小鼠正常饮食进水,毛发整齐有光泽,精神佳;模型组毛发杂乱黯淡,体质量增加,精神差;丹防组小鼠经干预后,一般情况较模型组小鼠稍有改善。
2.2 体质量、肝脏重量及血糖、TG、TC、ALT、AST水平
结果显示,与正常组比较,模型组小鼠体质量、肝脏重量显着增加,血糖、TG、TC、ALT及AST水平显着升高,差异有统计学意义(P<0.05);与模型组比较,丹防组小鼠体质量、血糖、TG及TC水平变化差异无统计学意义(P>0.05)、肝脏重量及ALT、AST水平显着降低,差异有统计学意义(P<0.05)。见表2。
表2 各组小鼠体质量、肝脏重量及血糖、TG、TC、ALT、AST水平变化Tab.2 Changes of body weight, liver weight, TG, TC, ALT and AST in each
注:(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。
2.3 肝脏组织学
如图1所示,HE染色结果显示,正常组小鼠肝组织结构完整清晰,无空泡结构形成,未见炎性细胞浸润。与正常组比较,模型组肝组织空泡形成明显,伴有炎性细胞浸润;与模型组比较,丹防组中空泡结构大小及数量减少。油红染色结果显示,正常组小鼠肝组织中未见脂滴积聚,模型组小鼠肝组织则出现大量脂滴积聚,脂肪变性明显;与模型组比较,丹防组小鼠肝组织中脂滴蓄积减少。天狼星染色结果显示,正常组小鼠肝组织中未见明显组织纤维增生,模型组小鼠中肝组织中有大量红色胶原纤维增生;与模型组比较,丹防组小鼠肝组织中红色胶原纤维减少,肝纤维化程度减轻。
2.4 α-SMA、TGF-β1、Smad2蛋白和mRNA及col-Ⅳ mRNA表达水平
结果显示,与正常组比较,模型组小鼠肝组织匀浆中α-SMA 、TGF-β1、Smad2蛋白和mRNA,col-Ⅳ mRNA表达水平均显着升高,差异有统计学意义(P<0.05);与模型组比较,丹防组小鼠肝组织匀浆中α-SMA 、TGF-β1、Smad2蛋白和mRNA,col-Ⅳ mRNA表达水平均均显着降低,差异有统计学意义(P<0.05)。见图2。
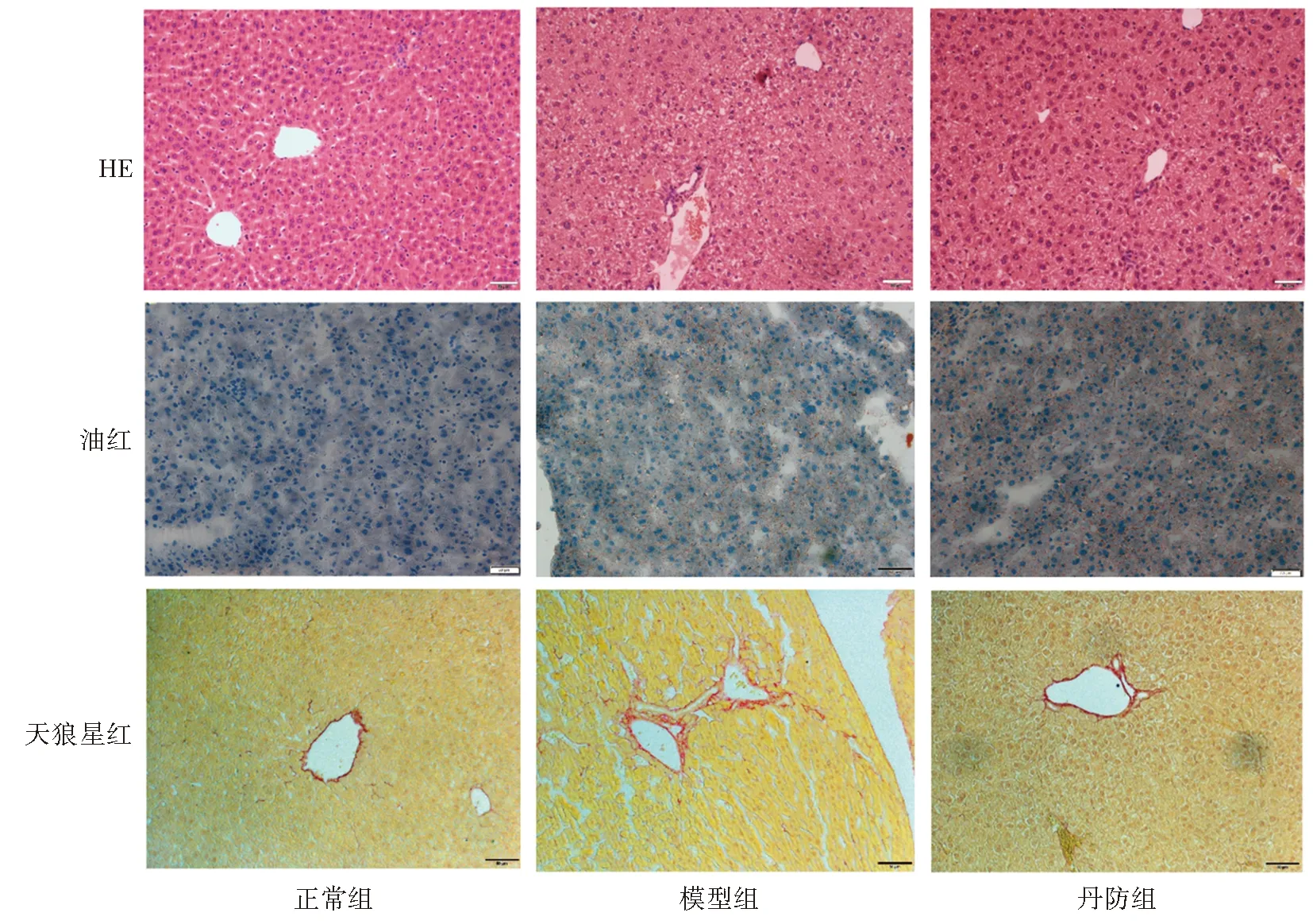
图1 各组小鼠肝脏组织学变化(HE、油红及天狼星红染色,×200)Fig.1 Liver histopathological changes in each group(HE, ORO and Sirius Red, ×200)
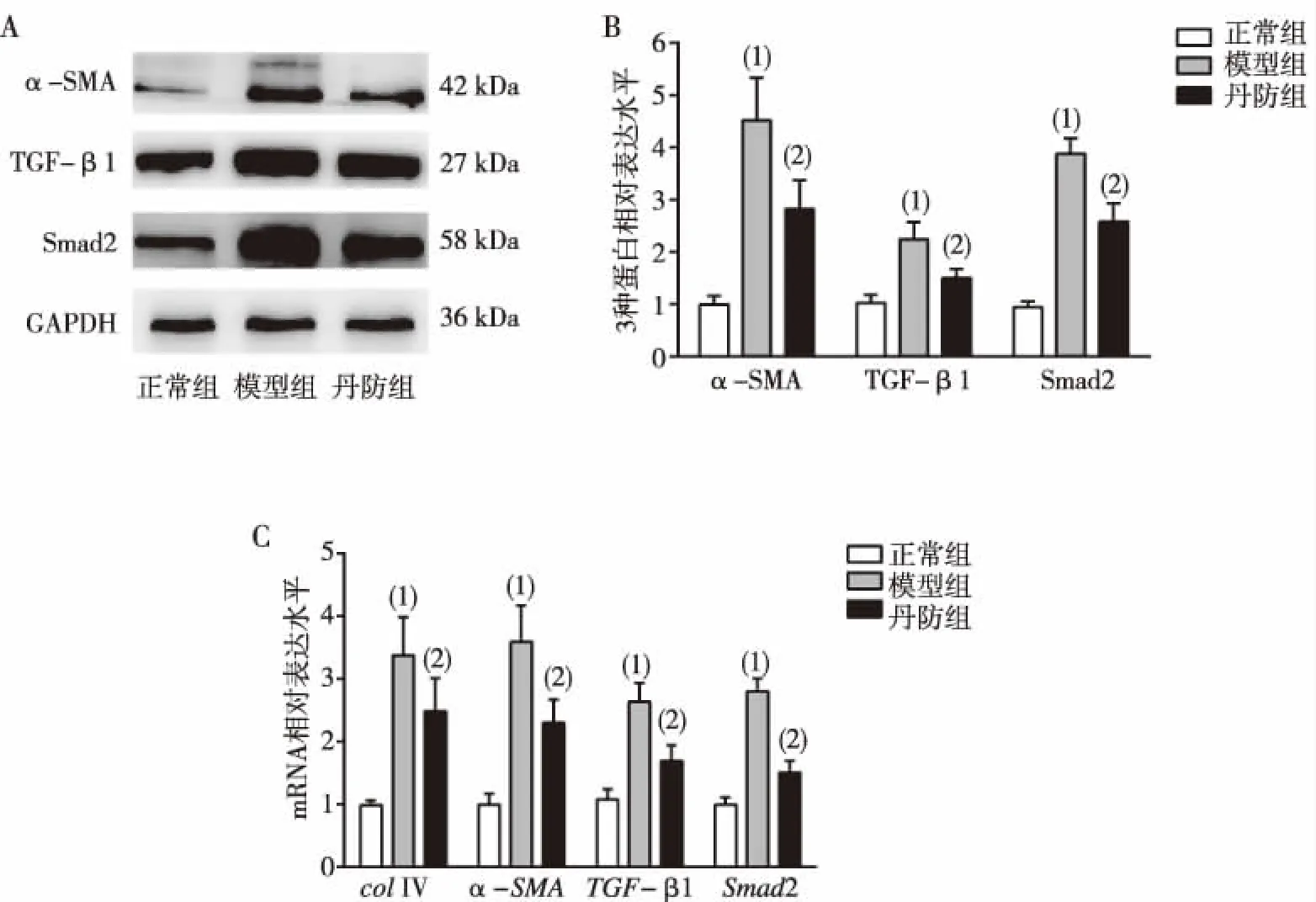
注:A为α-SMA、TGF-β1及Smad2蛋白表达(Western Blot),B为α-SMA、TGF-β1及Smad2蛋白表达的直条图,C为col-Ⅳ、α-SMA、TGF-β1及Smad2 mRNA表达直条图;(1)与正常组比较,P<0.05;(2)与模型组比较,P<0.05。图2 各组小鼠肝组织匀浆α-SMA、TGF-β1、Smad2蛋白和mRNA及col-Ⅳ mRNA表达Fig.2 Expression of α-SMA, TGF-β1, Smad2 protein and mRNA and col-Ⅳ mRNA in liver tissues of mice
3 讨论
目前,NAFLD发病机制尚不清楚,研究认为NAFLD和其相关肝纤维化的发生可能与遗传代谢、环境饮食、胰岛素抵抗等密切相关,以肝细胞存在广泛脂肪浸润和发生炎症为主要特征[8-11]。近年来,随着人们生活质量的提高以及饮食结构的改变,NAFLD的发病人群倾向于年轻人,且患病率呈逐年上升趋势[12-13],很有可能成为肝脏疾病中发展为肝硬化甚至肝癌的主要原因。此外,NAFLD还被认为是心血管疾病、2型糖尿病和终末期肾病的一大危险因素[14]。针对NAFLD的治疗,目前以适当运动、清淡饮食、禁酒等为主,辅以保肝降酶、降糖降脂的治疗方案为主,但至今尚无确切有效的药物用于临床治疗NAFLD及相关肝纤维化[15-17]。
在中医学中,NAFLD为本虚标实,其治疗方法为行气疏肝、活血化瘀、化痰利湿、健脾补肾[18]。而丹防胶囊中所包含的丹参、黄芪、汉防己、鳖甲、土鳖、当归、龟板、三七及银杏叶等成分具有活血祛瘀、补中益气、利湿退黄、改善微循环、软坚散结、退黄降酶等作用[19-23]。本研究拟探索丹防胶囊对小鼠非酒精性脂肪性肝纤维化的干预效果及其可能作用机制。
TG、TC的异常主要反应机体血脂是否异常,而ALT、AST在肝细胞受损时释放入血,是反应肝功能是否异常的敏感指标。α-SMA是肝星状细胞(hepatic stellate cell,HSC )活化的标志,Ⅳ型胶原(collagen-Ⅳ,col-Ⅳ)合成异常将导致细胞外基质(extracellular matrix,ECM)沉积,逐步发展为肝纤维化。
通过称量小鼠体质量、肝脏重量、血糖和TG、TC、ALT、AST及观察组织病理学改变发现:正常组肝组织结构完整清晰,无空泡结构形成,未见脂滴蓄积及炎性细胞浸润,汇管区未见胶原纤维增生。与正常组比较,模型组肝脏组织空泡形成明显,大量脂滴蓄积伴炎性细胞浸润,汇管区见大量胶原纤维增生。同时,小鼠体质量、肝脏重量、血糖及TG、TC、ALT、AST含量明显升高(P<0.05)。此外,肝组织α-SMA、col-Ⅳ表达升高(P<0.05),提示非酒精性脂肪性肝纤维化模型建立成功。与模型组比较,经丹防胶囊干预后,肝组织空泡结构及脂滴蓄积减少,肝纤维化程度减轻;小鼠肝脏重量、ALT、AST减轻(P<0.05),肝组织中α-S MA、col-Ⅳ表达下降(P<0.05),但体质量、TG、TC含量差异无统计学意义(P>0.05),提示丹防胶囊对非酒精性脂肪性肝纤维化有一定的干预作用,并在减轻肝脏重量及改善肝功能异常状态方面具有明显优势,可减轻肝脏损伤,但对体质量、TG、TC的改善并不理想,达不到血脂平衡的作用。
研究认为,TGF-β/smad信号通路在肝纤维化的进程中发挥重要作用,具有调控细胞增殖、分化、凋亡及迁移等作用,已证实TGF-β/smad可介导NAFLD相关肝纤维化的发生发展[24]。该通路主要包括细胞外TGF-β1、胞膜上的TGF-β受体(TβR)及胞内的Smad蛋白。当肝细胞受外界刺激后,TGF-β1活化与胞膜上的TβR-Ⅰ、TβR-Ⅱ结合,激活下游因子Smad2、Smad3,启动TGF-β/smad通路,从而活化HSC分化为肌成纤维细胞,导致α-SMA、Ⅰ型胶原蛋白(collagen Ⅰ,col Ⅰ)、Ⅲ型胶原蛋白(collagen Ⅲ,col Ⅲ)、colⅣ含量增加,致使大量ECM沉积,最终导致纤维化的发生[25-26]。结合本研究Western blot及RT-qPCR实验结果:与正常组相比,模型组中TGF-β1、Smad2基因及蛋白表达水平上升(P<0.05),验证了TGF-β1、Smad2过表达促进了肝纤维化的发生进程。与模型组相比,丹防组小鼠肝组织中TGF-β1、Smad2基因及蛋白表达水平降低(P<0.05),提示丹防胶囊对非酒精性脂肪性肝纤维化的干预作用可能与降低肝组织中TGF-β1、Smad2的表达,从而抑制TGF-β/smad通路激活参与肝纤维化有关。
综上,丹防胶囊对非酒精性脂肪性肝纤维化的具有一定的治疗效果,可作为非酒精性肝纤维化的潜在治疗药物,丹防胶囊可降低非酒精性脂肪性肝纤维化的肝脏重量、ALT、AST水平,其机制可能与降低肝组织中TGF-β1及Smad2的表达有关。



