唐丽, 秦明敏, 张苏炯, 叶常虹, 夏媛玲, 陈炜
(贵州医科大学附属医院 眼科, 贵州 贵阳 550004)
白内障术后视觉效果主要取决于人工晶体度数的精确测算,眼轴测量的准确性关系到术后屈光误差的大小[1]。在不合并黄斑病变的白内障术眼中,光学相干生物测量仪(intraocular lens master,IOL Master)方法比超声生物测量术具有更大的优势[2],然而在黄斑前膜合并白内障眼轴测量时存在误差[3],且对视网膜脱离的眼轴长度测量并不准确;在黄斑脉络膜新生血管合并白内障的患者,用IOL Master和A型超声(A ultrasound scan,A-scan)测量的眼轴计算的人工晶体度数有屈光误差[4]。究竟哪种方法对白内障合并黄斑病变患者测量的准确性更高,国内鲜有报道,本研究分别采用IOL Master和A-scan测定眼轴,并将测定结果代入到人工晶体计算SRK-T公式或Haigis公式,分析患者术后3月的屈光误差,评价2种眼轴测量数值对这类特殊人群人工晶体度数测算的准确性。
1 资料与方法
1.1 一般资料
收集2017年12月—2019年5月超声乳化吸出术联合人工晶体植入术的白内障合并黄斑病变患者,裂隙灯提示白内障核级Ⅲ级(采用LOCSⅢ来评价晶状体混浊程度),光学相干断层扫描仪(optical coherence tomography,OCT)提示眼底黄斑病变(黄斑前膜、黄斑水肿及湿性老年性黄斑病变),患者双眼前节无明显其他异常、无角膜屈光手术史,自愿情况下参与本实验研究并签定知情同意书;排除先天性白内障、外伤性白内障者,合并青光眼、葡萄膜炎、眼内炎及玻璃体切割术后硅油填充等其它因素导致的晶状体浑浊,合并视网膜脱离、高度近视者,患者白内障混浊重无法测得清晰的IOL Master测量值,无法合作或非自愿合作者。纳入患者38例、46只眼,男17只眼、女29只眼,年龄55~90岁、平均(67.35±10.25)岁,视力<0.3者21只眼、0.3~0.5者18只眼及≥0.5者7只眼,黄斑水肿15只眼、黄斑前膜5只眼及湿性老年性黄斑病变26只眼。
1.2 方法
1.2.1视力检查 所有患者术眼分别于术前和术后3个月采用国际标准视力表检查视力,术眼术前视力和术后3月视力比较。
1.2.2光学相干断层扫描(optical coherence tomography,OCT) 术前采用光学相干断层扫描(optical coherence tomography,OCT)检查术眼的中央视网膜厚度(central retinal thickness,CRT)按照CRT的厚度对黄斑病变分类。
1.2.3眼轴测量 分别采用IOL Master和A-scan测量所有患者术前眼轴。IOL Master系患者注视设备的注视灯,得到清晰的图像,术前5次眼轴测量取均值,根据眼轴的长度(axial length,AL)选择不同的公式(当AL<25 mm时,用SRK-T公式;当AL≥25 mm时,用Haigis公式)[5],根据AL等测量参数,结合医生的临床经验、患者工作和生活的习惯等因素决定植入人工晶体的度数、目标屈光度和预留的屈光度数。A-scan系术前患者同一只眼在B超辅助下用A-scan测量眼轴,确保患者黄斑注视,测量AL10次取平均值,标准差0.05以内[6]。
1.2.4手术方法 手术由同一有经验的医生实施,做颞侧透明角膜3.0 mm切口,顺利完成超声乳化吸出术,并囊袋内植入单焦可折叠人工晶体,手术中未发生后囊破等并发症。
1.3 评价指标
术前采用IOL Master和A-scan测量方法测量术眼眼轴,同时记录和计算2种测量方法AL差值与视网膜中央厚度的相关性,比较预留度数;术后3个月验光分别得到2种测量方法术眼实际屈光度数,计算目标屈光度和实际屈光度差值即为绝对屈光误差(absolute error,AE),比较术后2种测量方法屈光漂移和AE在0.00~1.00 D的百分比。
1.4 统计学分析
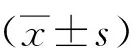
2 结果
2.1 术前与术后3月视力
患者术后3月裸眼视力较术前提高,差异有统计学意义(P<0.05)。见表1。

表1 患者术眼手术前后视力的比较Tab.1 Comparison of vision acuity among patients before and after operation
2.2 测量结果的一致性
Bland-Altman分析结果显示,IOL Master与A-scan两种方法所测术眼得到AL测量差值的95%医学参考范围为-0.77~0.89 mm,95.65%(44/46)在范围内,28.26%(13/46)为2组测量AL差值为0,其中AL测量最大差值的绝对值为0.45 mm。见图1。
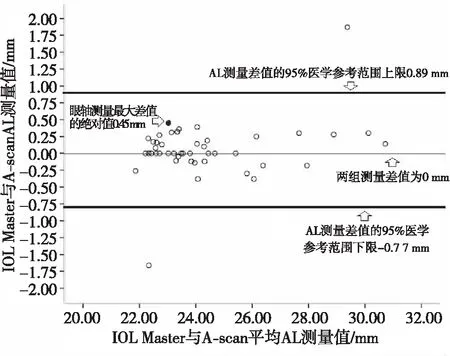
图1 2种测量方法眼轴值的Bland-Altman分析Fig.1 Bland-Altman figures of AL difference value between two measuring methods
2.3 2种方法获得的AL与黄斑中心凹厚度的相关性
IOL Master与A-scan所测术眼AL分别为(24.35±2.28)mm和(24.28±2.15)mm,比较差异无统计学意义(Z=-1.778,P=0.075);Pearson相关性分析结果显示,2种测量方法获得的AL与黄斑中心凹厚度无相关性(r=0.087,P=0.564)。
2.4 预留屈光度数
IOL Master和A-scan对术眼预留屈光度数比较,差异无统计学意义(P>0.05)。见表2。

表2 IOL Master与A-scan检测术眼的预留屈光度数Tab.2 Comparison of reserved diopter between IOL Master and A-scan measurements
2.5 术后3个月AE
术后3个月的AE比较,IOL Master较A-scan组测定方法更接近于0 D,差异有统计学意义(P<0.001)。见图2。
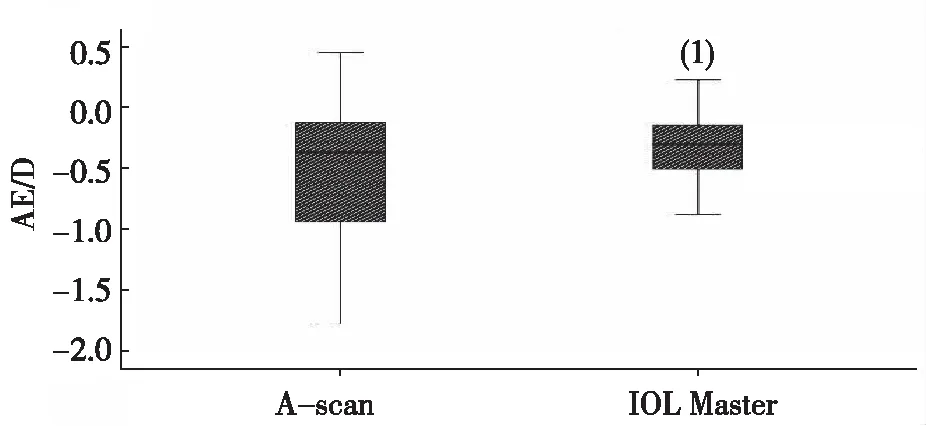
注:(1)与A-scan比较,P<0.001。图2 IOL Master和A-scan两种方法术后3个月时的AE比较Fig.2 Comparison of AE between IOL Master and A-scan in 3 months after operation
2.6 屈光漂移和AE
所有患者术眼术后3个月屈光漂移均以近视漂移为主,IOL Master方法近视漂移检出高于A-scan(P<0.001),术后3个月AE介于0.00~1.00 D的比例高于A-scan,差异有高度统计学意义(P<0.01)。见表3。
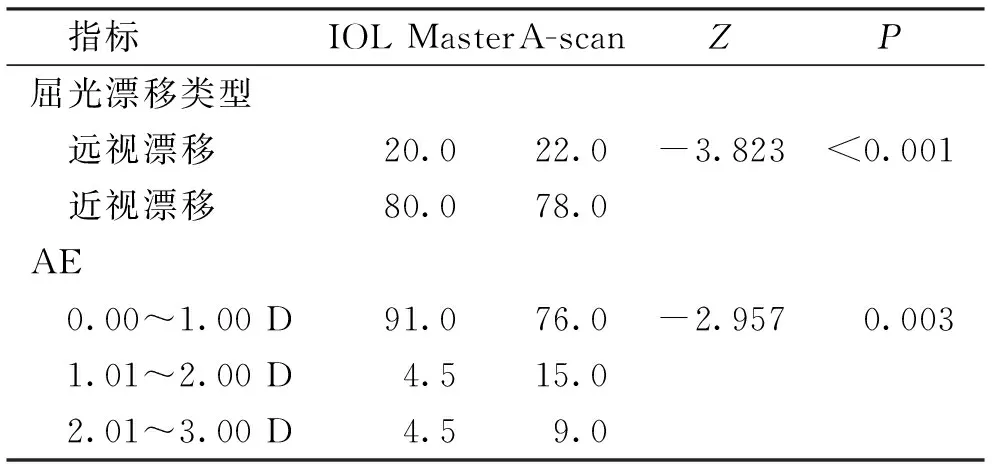
表3 IOL Master和A-scan两种方法术后3月屈光漂移和AE比较/%Tab.3 Comparison of the refractive drift and percentage of AE between IOL master group and A-scan group in 3 months after operation/%
3 讨论
白内障患者术后视力恢复取决于术前精确的生物测量,其中0.1 mm的眼轴测量误差会造成术后0.28 D的屈光度差异[7]。目前眼轴长度测量的仪器主要有IOL Master和A-scan。A-scan测量的AL是角膜前表面的顶点到视网膜内界膜的距离,不包括神经上皮层的厚度[8]。而IOL Master测量的AL为角膜前表面至视网膜色素上皮层(retinal pigment epithelium,RPE)的距离,包含视网膜神经上皮层的厚度,且IOL Master测量的黄斑区面积为0.05 mm2 [9-10]。测量时患者只需注视红光点;而A-scan测量黄斑区面积为0.3 mm2[9,11],较大的黄斑区面积可能导致患者注视时看到的是光斑,眼轴测量方向则可能从中心凹转移到黄斑旁区域,使得眼轴测量结果不准确。在黄斑病变患者IOL Master作为一种非接触式光学测量仪,加之其较高的分辨率和精确性,用于传统A-scan不能检查的特殊眼,如硅油填充眼等优势[2],目前公认IOL Master是作为白内障术前首选检查[12],但测量有其局限性[13],对于重度混浊的白内障则无法测量AL,此时A-scan则成为了可替代的测量仪器。综上,由于2种测量仪器的原理和方法不同,对眼轴测量存在差异,而差异来源于眼内测量界面的不同(是否包含视网膜神经上皮层)。对于黄斑水肿患者,因其视网膜神经上皮层隆起,角膜前表面顶点到视网膜内界膜的距离缩短,A-scan测量的AL减小,但对IOL Master测量的AL没有影响,理论上认为IOL Master对于白内障合并黄斑病变的患者眼轴的测量更有优势[10],但有研究观察到黄斑的脉络膜新生血管的患者合并白内障用IOL Master和A-scan进行人工晶体测算度数存在差异[14]。可见对于黄斑病变合并白内障的患者究竟是哪种测量眼轴方法更精确,国内鲜有报道。本研究从2种测量方法术后3个月视力与术前视力相比较,2种测量方法眼轴测量的一致性,2种测量方法术眼AL差值与CRT相关性,比较2种测量方法术后预留度数,术后3月的屈光状态及屈光误差的在0.00~1.00 D百分比分布,客观评价IOL Master和A-scan测量眼轴在白内障合并黄斑病变术后人工晶体度数测算的准确性。本研究结果显示,术后裸眼视力与术前相比差异有统计学意义(P<0.05),证实对于白内障合并黄斑病变患者,白内障手术可以改善患者术后视力。
通过Bland-Altman分析法对A-scan和IOL Master眼轴测量结果进行一致性评价,结果显示AL最大差值的绝对值为0.45 mm,这个差值与孙靖等[15]研究的眼轴测量误差结果为0.47 mm基本一致,提示2种方法测量AL结果一致性较好。因此,在重度混浊的白内障合并黄斑病变,当用IOL Master不能测出眼轴时,用A超来测量眼轴同样准确。本研究相关性分析结果显示,2种测量方法检测术眼AL差值与中央视网膜厚度无相关性(P>0.05),这与Kymionis等[16]的研究结果相符合,提示目前尚不能将黄斑中心凹厚度作为一个变量纳入白内障合并黄斑病变患者的人工晶体度数计算的公式中。
本研究结果显示,IOL Master预留的(-0.773±1.230)D和A-scan预留的(-0.582±1.238)D,与术后“宁负勿正”的原则相符,患者的远视力恢复较好,但对于部分黄斑病变严重的患者,如果按照常规选择预留-0.25 D,一味追求患者的远视力,术后不仅远视力得不到有效改善,还会造成患者近距离视力明显下降,因此可考虑植入预留-3~-4 D的屈光度的人工晶体。既往研究[17]认为白内障手术后预留一定的近视屈光度。可以增加人工晶体的聚焦深度,它的中心视效率和实用调节范围较正视时更佳,可以帮助患者术后取得更好的近视力;张佳晴等[18]对高度近视白内障术后建议预留-2 D左右的近视。但是对白内障合并黄斑病变患者术后预留近视屈光度数的具体值,国内外还没有研究。
白内障患者术后的屈光状态不稳定,这种动态的屈光状态的改变称为屈光漂移[19-20],屈光漂移的趋势有产生近视漂移的结论,亦有产生远视漂移[21]。术后3个月A-scan与IOL Master术眼近视漂移比例差异无统计学意义(P>0.05),均提示术后屈光状态表现为近视漂移。这与Attas等[22]对21位糖尿病性黄斑水肿的合并白内障术后患者出现近视漂移结果一致。考虑到是黄斑病变患者术后的视觉质量,这个近视漂移的误差是不可忽视的。结合患者眼部的生物测量参数对预留屈光度数进行相应的调整[23],可进一步减小黄斑病变合并白内障术后屈光误差,提高术前预测的准确性。
AE是某一个时间点的静态测量值,常常作为衡量人工晶体度数准确与否及白内障术后效果优劣的标准,人工晶体目标屈光度和实际屈光度差值(绝对屈光误差)越接近0,则说明人工晶体的测算越准确[24]。本研究结果显示,IOL Master方法术后AE值宽度更接近于0,准确性更高,IOL Master方法术后AE在0.00~1.00 D的比例比A-scan方法多(P<0.05)。此结果与Kojima等[25]研究一致,可认为对于白内障合并黄斑病变的病人,IOL Master较A-scan在人工晶体度数预测中准确性更佳。
综上所述,对于白内障合并黄斑病变的患者,用IOL Master和A-scan在测量AL时一致性好,AL与CRT无相关性,建议临床上2者结合使用,尽可能减少误差;白内障合并黄斑病变患者术后都易出现近视飘移;通过比较2种测量方法术后屈光误差分布特点,IOL Master生物测量方法准确性优于A-scan。对于这类特殊的病人是否能将黄斑中心凹厚度作为一个变量纳入人工晶体计算的公式中有待进一步研究。鉴于本研究黄斑病变合并白内障的患者例数少,2种测量方法在黄斑水肿,黄斑前膜以及黄斑脉络膜新生血管的分类病例中的应用还需更广泛及深入的探讨。



