聂微,刘泽莹,严芝强,成兴真,刘丽荣,杨芳*
(1.贵州医科大学 医学检验学院 临床检验基础与血液学教研室,贵州 贵阳 550004;2.贵州医科大学附属肿瘤医院 检验科,贵州 贵阳 550004;3.贵州医科大学附属医院 胃肠外科,贵州 贵阳 550004)
胃癌是消化系统常见的恶性肿瘤,2020年全球胃癌发病率在全球癌症排名第5,死亡率排名第4,中国胃癌新增病例占全球胃癌新增病例的44%[1]。由于胃癌早期症状无特异性,诊断十分困难,在大多数国家,5年存活率介于20%~40%[2]。因此寻找特异性高的诊断指标,用于提高胃癌的早期诊断率迫在眉睫。可变剪接(alternative splicing,AS)是一种重要的基因转录后修饰方式,是指基因的mRNA前体经过不同的剪接方式产生多个不同的成熟mRNA剪接异构体的过程,最终产生不同的蛋白质亚型[3-5]。研究表明,AS产生的多个转录本在肿瘤生物学特征,如增殖、凋亡、血管发生、药物抵抗、侵袭和转移等方面具有不同的作用,甚至有的功能截然相反[6-13],其产生的不同蛋白质亚型在癌症的许多病理生理过程中也表现出了不同的作用[14]。通过美国国家生物技术信息中心(national center for biotechnology information,NCBI)查询可知β-内酰胺酶基因(lactamase β,LACTB)位于15号染色体长臂(15q22.2),共有7个外显子,通过AS可形成3个编码蛋白的转录本(NM_032857.5、NM_171846.4及NM_001288585.2)。已有研究表明,LACTB在肝细胞癌[15]、乳腺癌[16]、结直肠癌[17-19]、胶质瘤[20]等肿瘤中表达下调,提示高表达LACTB可抑制肿瘤细胞的增殖、迁移及侵袭;在鼻咽癌中,LACTB表达升高却是促进癌细胞恶性行为的原因之一[21],这与LACTB在其他实体肿瘤中的研究完全不相符,其原因尚不能确定。LACTB在胃癌中的研究较少,涉及LACTB转录本在胃癌中的表达特点未见报道,因此,本研究主要探讨LACTB转录本在胃癌细胞中的表达特点,检测胃癌细胞中主要表达的转录本类型,初步分析LACTB转录本与胃癌的关系,现将结果汇报如下。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 人正常胃黏膜细胞株GES-1,不同分化程度胃癌细胞株AGS(高分化)、MKN-28(中分化)、MKN-45(低分化),未分化胃癌细胞株HGC-27均购自中国科学院细胞库。
1.1.2主要试剂及仪器 RPMI 1640培养液和胎牛血清(美国 Gbico),UNlQ-10 柱式 Trizol总RNA抽提试剂盒和柱式DNA胶回收试剂盒(上海生工),PrimeScript RT reagent Kit with gDNA Eraser 逆转录试剂盒和TB Green Premix Ex Taq Ⅱ荧光定量PCR试剂盒(日本Takara);ND ONE微量分光光度计(美国Thermo Scientific),凝胶成像分析仪(美国BIO-RAD),荧光定量PCR仪LightCycler 480 System(美国Roche Diagnostics)。
1.2 实验方法
1.2.1细胞培养 所有细胞均使用含10%胎牛血清(fetal bovine serum,FBS;北美BI)的完全培养基于5%CO2、37 ℃条件下培养;倒置显微镜下观察细胞生长状态,每2~3 d传代1次,收取对数生长期的细胞用于后续研究。
1.2.2LACTB的特异性引物设计 通过美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)查询LACTB(GeneID:114294)相关的信息,可知LACTB共有7个外显子,有3个注释为NM序列的标准mRNA:转录本1(V1,NM_032857.5)、转录本2(V2,NM_171846.4)和转录本3(V3,NM_001288585.2),2个注释为XR序列的非编码mRNA:XR1(XR_931745.2)和XR2(XR_429442.2)。转录本1、2、3前4个外显子完全一样,可设计相同的前向引物(F445),而其3′末端不同,所以在其3′端不同序列部分设计不同的反向引物。转录本1包含1个特有的外显子6,可在此设计反向引物;转录本2和转录本3的DNA序列区别仅在于转录本2比转录本3在第5个外显子5′端多4个碱基,区别两个转录本的反向引物主要在此设计。PCR实验所用引物如图1、表1所示,F445、R1174、R1158用于反转录PCR(reverse transcription PCR,RT-PCR),F445、R842、R981、R982用于巢式PCR,F148、F945-2、F945-3、F1092、R266、R1158、R1230用于反转录荧光定量PCR(real-time quantitative PCR,RT-qPCR)。
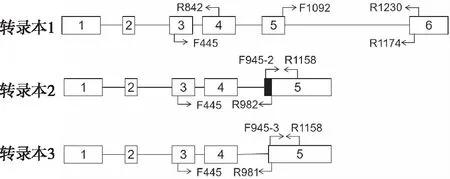
图1 LACTB不同转录本引物设计

表1 引物序列
1.2.3总RNA提取 胃癌细胞株用6孔板培养至对数生长期,贴壁细胞取1孔用缓冲液清洗2次,加Trizol 1 mL吹打混匀,半悬浮细胞收集细胞沉淀加Trizol 1 mL吹打混匀,氯仿、无水乙醇、UNlQ-10柱式 Trizol总RNA抽提试剂盒按照试剂说明书提取并纯化总RNA;提取的总RNA通过琼脂糖凝胶电泳验证RNA完整性,采用微量分光光度计测量RNA浓度及A260∶A280的比值,A260∶A280为2.0提示RNA纯度较好,比值过高则提示RNA有降解,比值较低则提示有残余的蛋白质存在[22]。验证合格的RNA用逆转录试剂盒中的随机六聚体引物逆转录为cDNA。
1.2.4RT-PCR检测胃癌细胞中LACTB3个转录本的表达 cDNA用引物对F445/R1174,F445/R1158进行RT-PCR,产物用1.5%琼脂糖凝胶进行电泳,目的条带切胶后用柱式 DNA 胶回收试剂盒纯化DNA,纯化的DNA用于巢式PCR、DNA测序、T-A克隆。RT-PCR反应体系为20 μL,扩增条件为:95 ℃预变性5 min,95 ℃变性30 s、58 ℃退火30 s、72 ℃延伸40 s,72 ℃完全延伸7 min,共40个循环。
1.2.5巢式PCR验证RT-PCR产物特异性 F445/R1174扩增的产物回收纯化后用引物F445/R824进行巢式PCR,进一步验证目的条带;F445/R1158扩增的产物回收纯化后分别用引物F445/R982(针对转录本3),F445/R981(针对转录本2)进行巢式PCR,以此鉴别标本中表达的是转录本2还是转录本3。
1.2.6DNA测序验证RT-PCR产物特异性 F445/R1174扩增的产物回收纯化后直接使用DNA测序仪进行测序;F445/R1158扩增的产物通常包含2个目的条带,因此先将回收纯化的产物通过original TA cloning kit(T-A)方法克隆后挑选阳性菌落再进行DNA测序,测序结果通过NCBI BLAST功能进行比对,确定是否是目的基因LACTB相应的转录本。
1.2.7T-A克隆验证LACTB转录本2和3的序列情况 由于Taq DNA 聚合酶等扩增的PCR产物带A尾,将F445/R1158进行RT-PCR的扩增产物通过琼脂糖凝胶电泳将目的条带纯化回收后,与pUCI-T Zero Cloning Vector连接并转化到感受态细胞中,取菌液200 μL涂板含氨苄抗性的luria-bertani(LB)培养基 或super optimal broth with catabolite repression(SOC)培养基固体培养液,培养过夜用牙签挑取白色菌落,以通用引物 M13F/R(M13F:TGTAAAACGACGGCCAGT;M13R:CAGGAAACAGCTATGACC)进行测序从而获得目的条带DNA序列,结果通过NCBI BLAST功能进行比对确定该条带是否是LACTB的转录本2或3。
1.2.8RT-qPCR检测胃癌细胞中LACTB3个转录本mRNA表达水平 从胃癌细胞株中提取总RNA并逆转录为cDNA,cDNA采用 TB Green Premix Ex TaqⅡ进行RT-qPCR分析。引物对F1092/R1230用于分析转录本1,F945-2/R1158用于分析转录本2,F945-3/R1158用于分析转录本3,计算LACTB转录本相对表达量时使用HPRT作为内参。反应体系为20 μL,扩增条件为:95℃预变性30 s,95 ℃变性10 s,60 ℃退火延伸30 s,共40个循环。结果采用2-ΔΔCt法分析各个转录本的相对表达量。
1.3 统计学分析
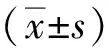
2 结果
2.1 LACTB 3个转录本的表达
从对数生长期的胃癌细胞中提取合格的RNA并逆转录为cDNA进行RT-PCR。使用针对LACTB转录本1的引物F445/R1174进行RT-PCR,扩增产物回收DNA并进行巢式PCR和DNA测序后发现在胃黏膜细胞株(GES-1)和4株胃癌细胞(AGS、MKN-28、MKN-45、HGC-27)中只检测到LACTB的转录本1,未发现转录本XR1、XR2(图2A~B)。再使用能够同时扩增出转录本2和3的引物F445/R1158进行RT-PCR,并将目的条带回收进行巢式PCR和T-A克隆以进一步验证产物。巢式PCR可扩增出特异性产物;T-A克隆结果共有9个阳性克隆子,通过测序确定其中6个为转录本2,3个为转录本3(图2C~E)。
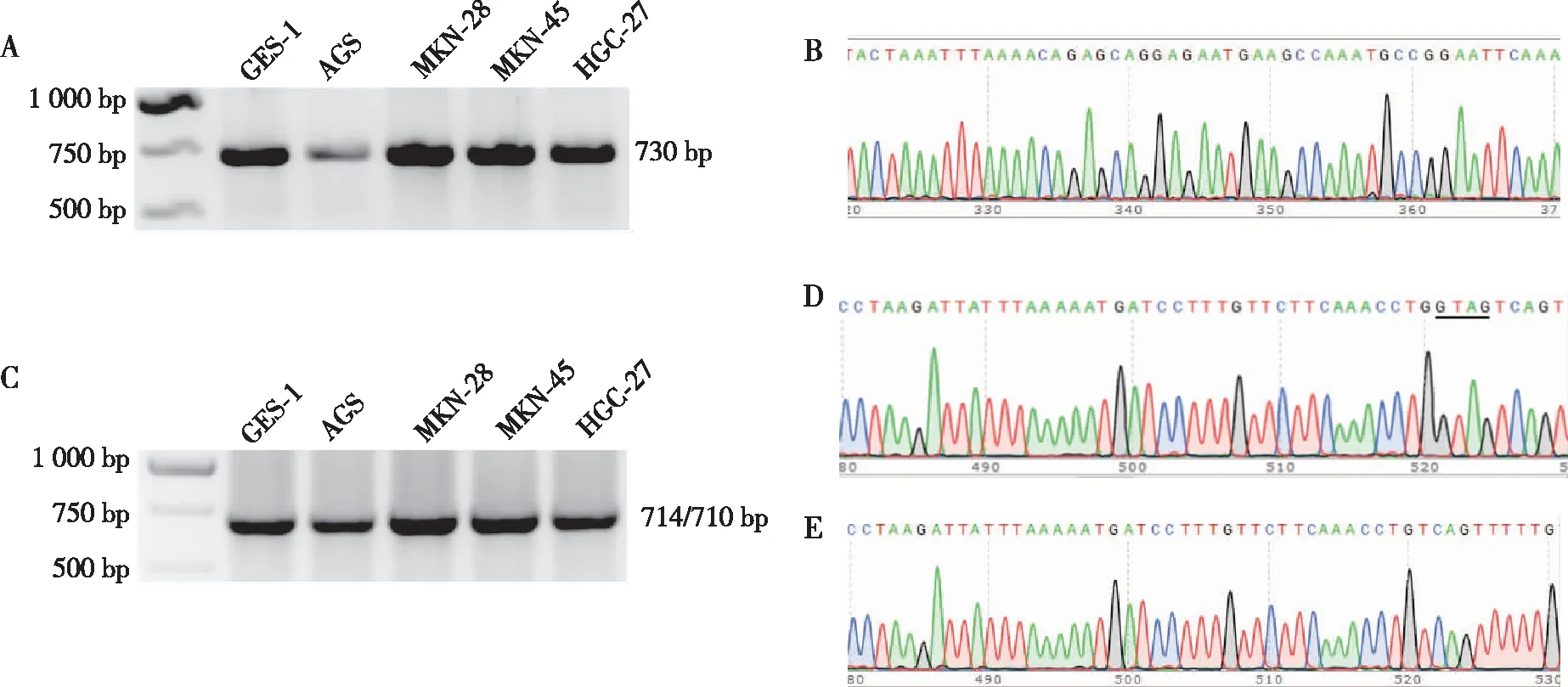
注:A为 LACTB 转录本1在胃癌细胞株中的表达情况,B为转录本1测序结果,C为LACTB转录本2和3在胃癌细胞株中的表达情况,D、E分别为LACTB 转录本2、3的测序结果;绿色峰代表碱基A,红色峰代表碱基T,黑色峰代表碱基G,蓝色峰代表碱基C。
2.2 LACTB 3个转录本在胃癌细胞中的定量
结果显示(图3),以胃黏膜细胞株GES-1为对照,转录本1在胃癌细胞株AGS、MKN-28及MKN-45中高表达(P<0.05),在HGC-27中低表达(P<0.05);以胃黏膜细胞株GES-1为对照,转录本2在胃癌细胞株AGS、MKN-28、MKN-45、HGC-27中低表达(P<0.05);以胃黏膜细胞株GES-1为对照,转录本3在胃癌细胞株MKN-28、MKN-45、HGC-27中低表达(P<0.05),在AGS(0.75±0.21)中表达差异无统计学意义(P>0.05);提示LACTB转录本1在胃癌细胞中高表达,转录本2和3在胃癌中则为低表达。
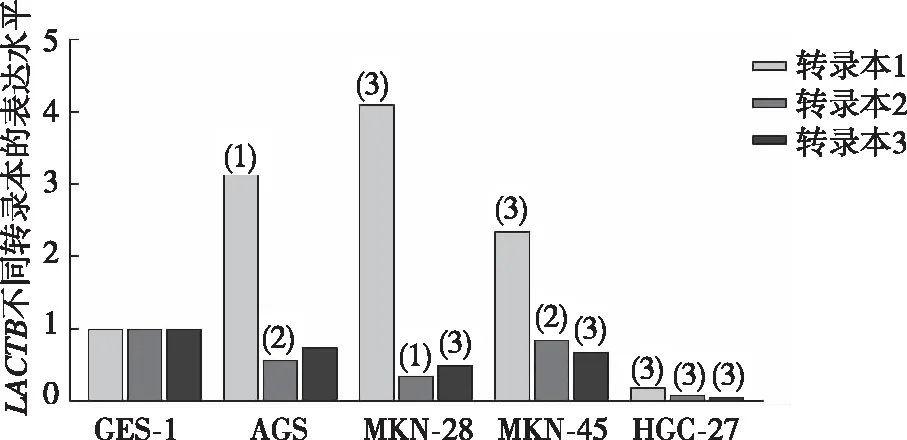
注:与GES-1细胞同转录本比较,(1)P<0.01,(2)P<0.05,(3)P<0.001。
3 讨论
AS在癌症的发生发展中起重要作用,在细胞生物学的各个方面都有直接的影响[23-24]。Sneath等[25]研究显示,CD44的AS产生的某些特定的CD44变异体与许多人类恶性肿瘤有关。例如,通过hnRNPK调节CD44E选择性剪接可促进胃癌发生[26]。因此不同AS形成的转录本可能发挥正常生理功能,也可能产生病理作用甚至导致肿瘤发生。LACTB与肿瘤密切相关,包含3个不同的转录本,可通过抑制线粒体磷脂酰丝氨酸脱羧酶进一步降低溶血磷脂酰乙醇胺和磷脂酰乙醇胺的水平,从而抑制肿瘤细胞的增殖,诱导肿瘤细胞出现高分化表皮细胞形态[27]。在乳腺癌和结直肠癌中,LACTB主要受MicroRNA的负调控[16,19];在结直肠癌细胞中诱导LACTB过表达后可通过PI3K/AKT/mTOR信号通路调节自噬进而抑制上皮间质转化(epithelial-mesenchymal transition,EMT)并增加上皮细胞标记物的表达,抑制胃癌细胞的恶性行为[18]。而在鼻咽癌中,是通过沉默LACTB抑制ERBB3/EGFR信号转导增加组蛋白H3的稳定性进而抑制鼻咽癌转移[21],LACTB在不同肿瘤中的作用可能完全相反,原因可能是LACTB在不同肿瘤中发挥作用的机制不同,也有可能是LACTB产生功能作用的转录本不同,并且,不同的转录本表达模式还可预测癌症的预后[28]。因此,探索LACTB基因在胃癌中的功能及作用机制前,首先需要了解该基因的转录本在胃癌细胞中的表达特点。
通过NCBI查询可知,LACTB存在3个编码蛋白的转录本和2个预测的转录本,针对转录本1的引物可同时扩增2个预测的转录本XR1、XR2,但在RT-PCR及DNA测序实验结果中均未发现XR1、XR2,结果提示胃癌细胞中XR1、XR2的表达水平很低甚至不表达;虽然转录本2和3的DNA序列仅相差4个碱基,但扩增产物通过巢式PCR可扩增出特异性产物,同时将扩增产物进行T-A克隆后通过DNA测序进行序列比对,结果证实产物为LACTB的转录本2和3。
本研究中不同分化程度的胃癌细胞株中均表达LACTB的3个编码蛋白的转录本,且在胃癌细胞中LACTB转录本1表达水平升高,转录本2和3水平降低。由此提示胃癌的发生发展过程中主要表达的转录本类型为转录本1。此外,还发现LACTB转录本1在分化水平较好的细胞株中为高表达,而在未分化胃癌细胞株中表达水平显着低于对照株,转录本2和3均为低表达,提示LACTB转录本1的表达水平可能是胃癌细胞分化的一个标志物,由于LACTB可维持细胞的正常生长和分化[17],因此当胃癌细胞处于未分化阶段时,转录本1表达水平低。当胃癌细胞3个转录本表达水平显着减低时可能预示细胞分化差,恶性程度高,这一结论需要进一步的实验验证。
综上所述,在胃癌中主要表达LACTB转录本1,可能主要通过LACTB转录本1相关的作用途径影响胃癌的发生发展。目前所有的研究中只检测了LACTB总mRNA的表达量,均未提及LACTB转录本的表达特点。而本研究涉及了LACTB转录本的表达情况,且研究结果显示胃癌细胞中LACTB转录本1表达水平显着上升,推测LACTB转录本1与胃癌发生发展存在一定的联系,而在其他实体肿瘤中主要表达的可能是其他转录本,从而呈现完全相反的作用。但目前对于LACTB在胃癌中的作用机制尚不清楚,因此后期可以此为实验基础进行下一步研究。



