袁 伟,张尚杰
血管内皮除具有天然屏障作用外,尚能分泌内皮素-1(ET-1)、一氧化氮(NO),两者共同维持血管及血液内环境的平衡。有研究表明,高胆固醇血症可引起血管内皮功能损伤,与内皮源性NO生物利用度的降低有关,它的异常预示着动脉粥样硬化的进行性发展,并于冠脉事件、血管手术后事件相关联[1]。同时,研究发现他汀类调脂药物降低心血管疾病的危险程度与血脂水平的改善程度不完全一致,说明此类药物除了降低胆固醇的作用外,还存在非调脂作用[2]。本研究通过观察高胆固醇血症病人和正常人NO、ET-1、NO/ET-1比值、血管内皮依赖性舒张功能的变化,旨在探讨阿托伐他汀抗动脉粥样硬化的机制。
1 资料与方法
1.1 研究对象 随机选择心脏内科门诊就诊的高胆固醇血症病人35例作为病例组,其中男15例,女20例,年龄(56.75±11.59)岁。根据《中国成人血脂异常防治指南》[3],上述病人血清总胆固醇(TC)≥6.20 mmol/L和(或)低密度脂蛋白胆固醇(LDL-C)≥4.14 mmol/L,并在治疗前3个月均未服用过降脂药物。排除标准:冠心病、严重心功能不全、心律失常、糖尿病、甲状腺疾病、大量饮酒、妊娠、肝肾疾病、有雌激素使用史。选择33名血脂检测均在正常范围内的正常人作为对照组,其中男14名,女19名,年龄(51.28±13.44)岁。两组病人在年龄、性别、吸烟方面具有可比性。吸烟病人的吸烟情况及所有病人的饮食习惯在试验期间保持不变,禁用影响血脂代谢的其他药物。
1.2 方法 研究对象在采血前24 h禁酒及高脂饮食,空腹12 h后采静脉血,分离血清,采用东芝TBA-40FR型全自动生化分析仪,酶法测定三酰甘油(TG),氧化酶法测定TC、高密度脂蛋白胆固醇(HDL-C)及LDL-C。并采用硝酸还原酶法测定NO和放射免疫法测定ET-1。病例组给予阿托伐他汀(美国辉瑞制药公司生产)10 mg,每晚顿服,8周后重复测定上述检验指标。采用超声多普勒按文献[4]的方法对血管内皮功能的进行测定。反应性充血及含服硝酸甘油后血管内径的变化,以第一次测量基础值的百分数表示,即△%=(D1或D2-D0)/D0×100%。
1.3 统计学处理 所有数据均采用SPSS 11.0统计软件包进行统计分析,计量资料采用均数±标准差(±s)表示,组间比较采用两样本均数非配对资料t检验,组内比较采用配对t检验。计数资料做卡方检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组血脂指标比较 治疗前,病例组 TG、TC、LDL-C水平较对照组明显增高;病例组治疗后与治疗前比较,TG、TC、LDL-C、HDL-C水平差异有统计学意义(P<0.05)。详见表1。
表1 两组血脂指标比较±s) mmol/L
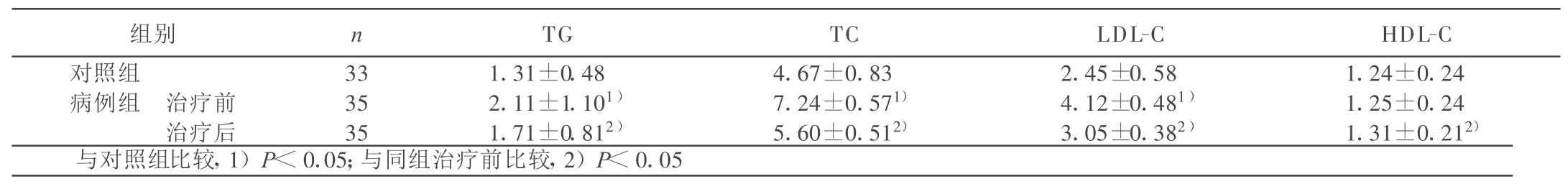
表1 两组血脂指标比较±s) mmol/L
组别 n TG TC LDL-C HDL-C对照组 33 1.31±0.48 4.67±0.83 2.45±0.58 1.24±0.24病例组 治疗前 35 2.11±1.101) 7.24±0.571) 4.12±0.481) 1.25±0.24治疗后 35 1.71±0.812) 5.60±0.512) 3.05±0.382) 1.31±0.212)与对照组比较,1)P<0.05;与同组治疗前比较,2)P<0.05
2.2 两组 NO、ET-1水平比较 病例组治疗前 NO、ET-1水平,与对照组比较差异有统计学意义(P<0.01)。病例组治疗前后NO、ET-1水平差异有统计学意义(P<0.01)。详见表2。
表2 两组NO、ET-1水平比较(±s)

表2 两组NO、ET-1水平比较(±s)
组别 n NO(μ mol/L) ET-1(pg/mL) NO/ET-1对照组 33 67.88±8.17 51.80±24.34 1.31±0.28病例组 治疗前 35 40.09±13.031) 72.85±34.741) 0.56±0.241)治疗后 35 56.57±15.361)2) 54.20±24.352) 1.05±0.462)与对照组比较,1)P<0.01;与同组治疗前比较,2)P<0.01
2.3 阿托伐他汀对血管内皮舒张功能的影响 病例组肱动脉内径的基础值与对照组肱动脉内径的基础值比较无统计学意义(P>0.05)。同时,病例组治疗后的基础内径与治疗前比较也无统计学意义(P>0.05)。病例组含服硝酸甘油后、反应性充血时肱动脉内径较对照组有明显降低(P<0.05或P<0.01)。反应性充血时病例组治疗前后肱动脉内径差异有统计学意义(P<0.01)。详见表 3。
表3 两组超声检测肱动脉内径的变化(±s)
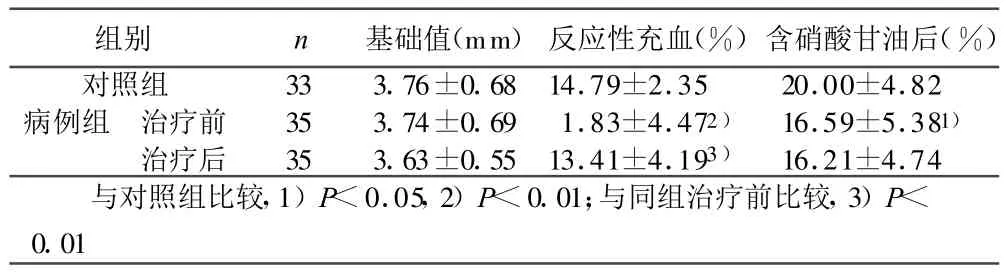
表3 两组超声检测肱动脉内径的变化(±s)
组别 n 基础值(mm) 反应性充血(%)含硝酸甘油后(%)对照组 33 3.76±0.6814.79±2.35 20.00±4.82病例组 治疗前 35 3.74±0.69 1.83±4.472) 16.59±5.381)治疗后 35 3.63±0.5513.41±4.193) 16.21±4.74与对照组比较,1)P<0.05,2)P<0.01;与同组治疗前比较,3)P<0.01
2.4 血管内皮依赖性舒张功能与血脂的相关性 单因素相关分析显示肱动脉内皮依赖性舒张功能改善的程度与病人的血清TG、TC、LDL-C的基础值无相关性(r分别为0.010 4,0.008 7和0.106 8,P>0.05),与血清 TG、TC、LDL-C的降低程度也无相关关系(r分别为0.139,0.164和0.119,P>0.05),提示阿托伐他汀对内皮依赖性舒张功能的改善可能是独立于调脂作用之外的。
3 讨 论
病例病人的血管和微血管内皮细胞功能障碍明显早于血管形态学异常[5]。这是因为内皮细胞对进入内膜的LDL氧化修饰成氧化型LDL(ox-LDL),后者具有细胞毒性,可以促进内皮细胞凋亡,引起内皮细胞的功能障碍。巨噬细胞吞噬LDL后形成泡沫细胞。当摄取的LDL超过巨噬细胞清除ox-LDL的能力时,导致巨嗜细胞坏死,释放溶酶体酶,引起内皮细胞的损伤及坏死。此外由于内皮细胞膜上不饱和脂肪酸能与体内的ROS产生脂质过氧化物,通过破坏膜的结构和影响膜的流动性来损伤内皮,导致内皮功能障碍。同时,外周血内皮祖细胞水平降低,机体修复内皮损伤的功能低下,导致内皮功能障碍,促进了动脉粥样硬化的发生和发展[6]。De Jongh等在家族性病例的儿童中发现,其总胆固醇和脂蛋白α的血浆浓度与肱动脉血流介导的舒张效应呈负相关,也说明了病例对内皮产生的脂毒性效应[7]。
有研究表明,病例伴发的内皮功能障碍可以通过他汀类药物的治疗得到逆转[8]。本研究结果表明,经阿托伐他汀干预治疗后,NO提高,ET-1水平降低,血流介导的肱动脉内皮依赖性舒张反应提高,说明阿托伐他汀可明显改善内皮功能,其机制可能是抑制甲羟戊酸通路和蛋白异戊烯化过程,最终将引起多种生物学效应,他汀类对NO合成的影响可能是通过降低降钙素基因相关肽(CGPP)水平,间接抑制Rho蛋白的异戊烯化而实现的[9]。这对参与动脉粥样硬化形成的血管平滑肌细胞、内皮细胞和单核细胞具有稳定作用。
除降脂作用外,他汀类药物对血管内皮细胞有直接的作用。表现在以下几个方面:直接激活内皮型一氧化氮合酶(eNOS),引起内皮细胞NO的迅速释放;增加LDL-C氧化阻力。ox-LDL可降低内皮细胞NOSmRNA及蛋白水平,HMG-CoA还原酶抑制剂可完全阻止ox-LDL对NOS的下调[10];显着减少甲羟戊酸,导致SMC的DNA合成受抑,从而抑制血管平滑肌细胞的增殖及迁移;通过降低血浆C-反应蛋白水平,以及白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和环氧合酶2的表达[11],达到抗炎的目的,这一作用独立于其调脂作用之外。可能为:当机体受到炎性因素刺激时,内皮细胞被诱导表达COX-2[12]。他汀类药物可激活过氧化物酶增殖体激活受体(PPA R-r)表达,通过其负反馈机制下调COX-2表达[13],从而降低严重冠心病炎症水平并改善流速介导的血管舒张和血管内皮功能[14];使CD59表达水平上调 20%[15],阻碍补体C7、C8、sC5b-6的结合,抑制补体sC5b-9形成,从而防止自身组织受到补体活化的损伤,增加了组织细胞对补体活化损伤的防御能力,这也可能是他汀类药物新的血管保护机制;通过减少斑块内膜和中膜巨噬细胞,增加胶原面积,减少细胞外脂质沉积,减少内膜新生血管生成,进而稳定斑块;降低血浆中内皮素的水平。
病例作为心血管疾病独立的危险因素,导致血管内皮依赖性舒张功能障碍,促发心肌缺血。因此,积极的调脂治疗有助于逆转受损的内皮功能,延缓动脉硬化的发展,对于冠心病的防治具有重要意义。
[1]Walter DH,Zeiher AM,Dimmeler S.Effects of statins on endothelium and their contribution to neovascularization by mobilization of endothelial progenitor cells[J].Coron Artery Dis,2004,15:235-242.
[2]冷秀玉,曾武涛,黄润莲,等.不同剂量辛伐他汀对冠心病病人肱动脉内皮依赖性舒张功能的影响[J].国际内科学杂志,2007,34(11):621-624.
[3]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-419.
[4]Loscalzo J.Nitric oxide insufficiency,platelet activation,and arterial thrombosis[J].Circ Res,2001,88:756-762.
[5]Seiler C,Hess OM,Beuchi M,et al.Influence of serum cholesterol and other coronary risk factors vasomotion of angiographically normal coronary arteries[J].Circulation,1993,88(5Pt 1):2139-2148.
[6]朱军慧,王兴祥,陈君柱,等.高胆固醇对内皮祖细胞数量和功能的影响[J].中华内科杂志,2004,43:261-264.
[7]T yroler H.Overview of clinical trials of cholesterol lowing in relationship to epidemiologic studies[J].Am J Med,1989,87(suppl 4A)14-19.
[8]Vogel RA,Corretti MC,Plotnick GD.T he mechanism of improvement in endothelial function by pravastatin:Directeffector through cholesterol lowering[J].J Am Coll Cardiol,1998,31:60A.
[9]陈红,蒋宝琦.他汀类药物对参与动脉粥样硬化的主要细胞成分的直接作用[J].中国医药导刊,2000,2(6):9-12.
[10]Lafs U,Fata VL,Plutzky J,et al.Upregulation of endothelial nitric oxide synthase by HMG-CoA reductase inhibitors[J].Circulation,1998,97:1129-1135.
[11]Engelmann M,Svendsen JH.Inflammation in the genesis and perpetuation of atrial fibrillation[J].Eur Heart J,2005,26,2083-2092.
[12]邓平,赵水平,吴洁,等.阿托伐他汀降低急性心肌梗死病人外周血单核细胞环氧化酶2表达并改善早期炎症反应[J].中华心血管病杂志,2005,33(11):1018-1022.
[13]Bishop-Bailey D,Warner TD.PPA Rgamma ligands induce prostaglandin production in vascular smooth muscle cell:Indomethacinacts as a peroxisome proliferator-activated receptor gamma antagonist[J].FASEB J,2003,17:1925-1927.
[14]Chenevard R,Hurlimann D,Bechir M,et al.Selective COX-2 inhibition improves endothelial function in coronary artery disease[J].Circulation,2003,107:405-409.
[15]刘永铭,严祥,刘艳英.补体与动脉硬化[J].中华心血管病杂志,2005,33:866-869.



