宋建波,杨晓棠,彭 琨,冯艳林,沈 伟,刘起旺
脑梗死为临床最常见的一种致残率和致死率较高的脑血管疾病,脑梗死的早期诊断和治疗明显影响预后,一直是医学界一大难题。弥散加权成像(diffusion weighted imaging,DWI)是目前公认的可定性、定位诊断超急性脑梗死的成像方法,但DWI只能反映弥散梯度方向上水分子的弥散强度,不能反映生物组织水分子弥散呈各向异性的特征,难以显示白质纤维受累情况[1]。弥散张量成像(diffusion tensor imaging,DTI)是 DWI技术的延伸,是目前唯一无创性活体研究脑白质纤维束形态结构的方法,近年来已逐步应用于临床科研[2-7]。本研究侧重应用DTI对脑梗死区弥散程度的改变进行初步研究,探讨DTI对脑梗死诊断及评估预后的价值。
1 资料与方法
1.1 一般资料 收集临床诊断考虑为脑梗死并行常规磁共振成像(M RI)和DWI检查证实为单侧梗死病变病人行DTI检查。共48例,其中男28例,女20例,年龄 34岁~88岁(57.8岁±4.2岁)。其中超急性期(<6 h)5例,急性期(6 h~3 d)14例,亚急性期(3 d~14 d)16例,慢性期(>14 d)13例。病变部位:基底节区25例(左 15例,右 10例),左、右额叶各2例,顶叶 7例(左4例,右3例),枕叶9例(左5例,右4例),颞叶6例(左2例,右4例)。
1.2 图像数据采集 使用GE公司SIGNA1.5T Twin speed with EXCITE超导MR扫描仪扫描,采用头部8通道相控阵线圈,常规FLAIR及FSE序列轴位扫描,T1WI(T R 2 175 ms,TE 10.4 ms),T2WI(TR4 700 ms,T E102 ms),T2FLAIR(TR 8 500 ms,TE 120 ms),矩阵384×256,层厚 5 mm,间距 1.5 mm;DWI采用 DW-EPI序列,TR 6 000 ms,TE 60.4 ms,矩阵 128×128,层厚5 mm,间 距1.5 mm 。DTI扫描 采用DW-EPI序列,TR6 000 ms,TE79.9 ms,FOV240 mm×240 mm,b值为1 000 s/mm2,采集矩阵 128×128;横轴位扫描,层厚5 mm,间距0 mm,共 21层,弥散方向 25个,采集时间 5分 24秒。
1.3 图像分析 采用GE公司Advantage Windows工作站FunctoolⅡ软件进行DTI图像处理,重建平均表观弥散系数(average apparent diffusion coefficient,ADCAV)图、各向异性分数(fractional anisotropy,FA)图,测量梗死区及健侧相应正常对照区ADVAV值、FA值。对累及锥体束病例并大脑脚、脑桥水平测量锥体束走行区ADCAV值、FA值。应用日本东京大学影像计算和分析实验室开发的Volume-One 1.64下的dTV.II.R1软件对DTI数据处理,重建三维彩色编码弥散张量纤维束成像图(diffusion tensor tractography,DTT),观察白质纤维束是否受累,及其位置、连续性及破坏等情况。
1.4 统计学处理 采用SPSS 11.0统计分析软件包,对患侧与健侧 ADVAV值、FA值进行比较,分析方法采用配对t检验,P<0.05为差异有统计学意义。
2 结 果
5例超急性期病例ADVAV值明显减低,DWI出现明显高信号,FA值则变化不明显;3例轻度减低,2例轻度升高,重建DTT图无明显异常。14例急性期病例患侧较健侧ADCAV值和FA值均明显减低,DTT图示4例病人患侧白质纤维束无明显受累改变,6例显示患侧白质纤维束有变形移位改变,结构基本完整,4例显示有患侧白质纤维局部缺损。16例亚急性期病例患侧ADVAV值变化不一致,其中 7例ADVAV值减低,但不及急性期病例明显,5例ADVAV值接近健侧对照区,4例ADVAV值增高,其FA值均明显减低。DT T图显示4例患侧白质纤维束无异常,4例可见患侧白质纤维受压移位改变,无中断缺损表现。8例显示有患侧白质纤维局部缺损伴或不伴有移位改变。13例慢性期病例ADVAV值高于健侧,而FA值减低。DT T图显示3例患侧白质纤维束无异常,10均有不同程度的白质纤维束缺损和/或移位改变。急性期及亚急性期锥体束受累病人双侧大脑脚、脑桥水平锥体束ADVAV值、FA值无统计学意义。慢性期锥体束受累病人在大脑脚、脑桥水平显示患侧ADVAV值无统计学意义,FA值则较健侧降低,具有统计学意义。详见表1、表2。
表1 梗死区及健侧对照区ADVAV值、FA值(±s)

表1 梗死区及健侧对照区ADVAV值、FA值(±s)
时期 n ADVAV(10-3mm2/s)病灶 对照 P FA病灶 对照 P超急性期 5 4.35±0.48 7.51±0.87 <0.05 0.21±0.03 0.22±0.08 >0.05急性期 4 3.54±0.64 7.24±0.38 <0.01 0.18±0.06 0.34±0.06 <0.01亚急性期 16 5.73±0.99 6.31±0.58 >0.05 0.12±0.03 0.29±0.05 <0.01慢性期 13 8.74±0.41 6.09±0.91 <0.01 0.11±0.05 0.26±0.08 <0.01
表2 锥体束受累病人双侧大脑脚、脑桥ADVAV值、FA值(±s)
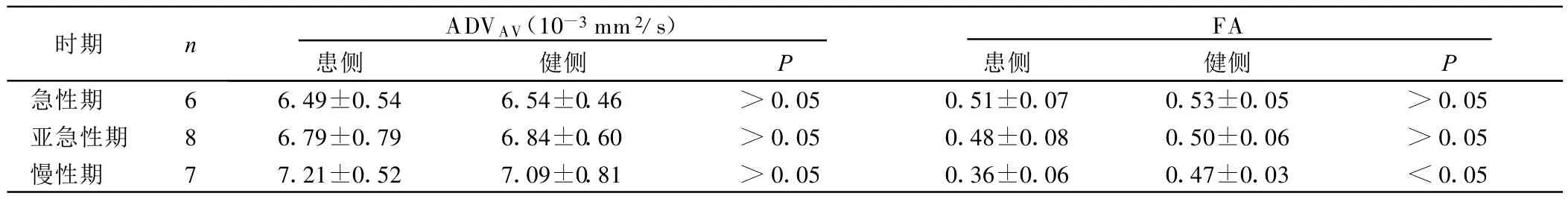
表2 锥体束受累病人双侧大脑脚、脑桥ADVAV值、FA值(±s)
时期 n ADVAV(10-3mm2/s)患侧 健侧 P FA患侧 健侧 P急性期 6 6.49±0.54 6.54±0.46 >0.05 0.51±0.07 0.53±0.05 >0.05亚急性期 8 6.79±0.79 6.84±0.60 >0.05 0.48±0.08 0.50±0.06 >0.05慢性期 7 7.21±0.52 7.09±0.81 >0.05 0.36±0.06 0.47±0.03 <0.05
3 讨 论
3.1 弥散张量成像基本原理 DTI是DWI技术的进一步发展,基本原理是利用水分子在生物组织中弥散具有各向异性特征,从多个方向上施加弥散梯度,分别采集数据,在三维空间内定量分析组织内水分子的弥散运动,利用所得多种参数值成像。其中最常用参数的是各向异性分数ADVAV值、FA值。ADVAV值消除了ADC值受方向的影响,较真实地反映了组织内水分子的弥散强度,不反映组织内弥散的各向异性特征。组织破坏可致各向异性逐渐丧失,水分子自由弥散增强,ADVAV值升高。FA值是最常用来反映组织各向异性特征的指标,是弥散张量的各向异性部分与总弥散张量之比,取值范围是0~1,1代表最大各向异性[8]。FA值的大小与髓鞘的完整性、纤维的致密性和平行性等有关。重建FA图可显示脑白质纤维束的分布,清楚区分白质与灰质。DTT图则是利用每个体素的方向信息重建整个白质纤维束,直观显示脑白质纤维的正常解剖及走行。DTI已成为功能磁共振成像的一个重要组成部分。
3.2 DTI在脑梗死中的应用
3.2.1 DTI对评价白质纤维束受累程度及梗死灶范围的价值FA图和DTT图可清晰显示白质纤维结构,本组5例超急性期病例未见明显白质纤维结构异常,14例急性期病例中10例白质纤维束有受累改变,16例亚急性期病例中12例白质纤维受累,13例慢性期病例中10例白质纤维束受累。脑梗死后DTI观察急性期或亚急性期白质纤维束结构改变,对超急性期梗死后白质纤维束结构改变尚不明显,DTI检查存在困难。收集病例中有9例病人因梗死灶体积小或邻近白质纤维,常规MRI及DWI不能判定纤维束是否受累,重建FA图和DT T图则显示5例纤维束受累。Kunimatsu等[9]利用 DTI对8例急性或亚急性早期的脑梗死病人研究后发现,梗死区接近但未累及锥体束的病人,治疗后运动功能恢复较好,而梗死灶累及锥体束的病人,肢体肌力试验下降,恢复不理想或持续时间长。结合常规MRI及DWI,DTI可在判断梗死灶范围、白质纤维束损伤程度及评估预后等方面为临床提供有价值信息。
3.2.2 DTI对脑梗死的临床分期价值 5例超急性期病例常规M RI表现基本正常,DWI显示梗死灶,DTI示梗死区ADVAV均减低,与健侧相应对照区比较有统计学意义,FA值则变化不明显,无统计学意义。在脑梗死的超急性期梗死区脑组织产生细胞毒性脑水肿,此阶段组织内水含量及T2弛豫时间尚没有明显变化,所以常规M RI显示正常。因细胞毒性脑水肿,细胞外水分减少,引起组织水分子弥散强度下降,ADVAV值减低。有动物实验显示[10,11]显示FA值在脑梗死发生后最初1 h~3 h内升高,但在随后即开始下降。但临床多项研究[12-15]报道超急性期脑梗死组织FA值变化非常不一致,原因尚不清楚,可能主要与各研究者所获取的观测时间点不同有关,需进一步研究。
对急性期和亚急性期病例数据统计显示,14例急性期病例梗死区较健侧相应对照区ADVAV值和FA值均减低,具有统计学意义。亚急性期病例16例梗死区与健侧ADVAV值比较变化不一致,7例ADVAV值减低,5例ADVAV值接近健侧对照区,4例ADVAV值略增高,总体无统计学意义,而FA值均减低,具有统计学意义。本组急性期和亚急性期病例所观察结果与同类研究结果相似[4,16]。在脑梗死急性期和亚急性期逐渐形成血管源性脑水肿,梗死区内组织微结构受到破坏,组织中水含量增加,T2弛豫时间延长,常规M RI可以显示梗死灶。在急性期ADVAV值仍然低于正常值,但随着组织中水含量逐渐增加,水分子弥散程度增大,在梗死发生数天后ADVAV值逐渐增高可接近正常而出现假阴性。Knight等[17]认为ADVAV值出现假阴性期与梗死区内细胞膜的完整性丧失,继发中性粒细胞增多有关。Copen等[18]研究显示在成人假阴性期大约出现在脑梗死发生后9 d左右,而新生儿大约出现在脑梗死发生后7 d左右,在临床上基本对应脑梗死亚急性期。而此阶段内FA值呈持续下降,FA值下降与脑梗死后有序的脑组织微结构破坏,各向异性特征逐渐丧失有关。
对于13例慢性期病例,梗死区ADVAV值高于健侧,FA值低于健侧,均具有统计学意义。在脑梗死慢性期随着限制水弥散的障碍物的进一步降解,使水分子在相同的弥散时间内可以有更大的位移空间,水分子弥散强度加大。同时各向异特征进一步丧失,致使ADVAV值持续增高,FA值持续减低。
总结本研究所观察结果并结合文献分析认为ADVAV值结合FA值可以大致将梗死后脑组织水弥散异常分为以下四个阶段。超急性期:ADVAV值减小,FA值正常或增大;急性期:ADVAV减小,FA值减小;亚急性期:ADVAV值由减低逐渐升高,可接近正常而呈现假阴性,FA值减小;慢性期:ADVAV值增大,FA值减小。然而对于超急性期FA值改变,不同学者观测结果尚不尽一致,有待进一步研究。DWI是诊断超急性脑梗死最重要的手段,联合运用DTI脑梗死分期可以更准确[19]。
3.2.3 DTI对脑梗死后锥体束Waller变性的评估 Waller变性是由于其上运动神经元或轴突损伤而引起的远端轴突和髓鞘的顺行性变性,脑梗死是引起锥体束Waller变性的最常见原因。本组资料中慢性期锥体束受累病例的可观察到远离梗死灶的患侧大脑脚、脑桥锥体束走行区信号降低,与健侧比较FA值差异有统计学意义,组织各向异性弥散特征的改变,反映了Waller变性的存在,ADVAV值则无统计学意义。在较慢性期早的病例(距发病时间小于14 d)中FA值、ADVAV值均无统计意义[20-23]。以往的多项研究也证实,锥体束Waller变性的表现为FA值进行性下降,伴或不伴ADVAV值升高,脑梗死后有无锥体束Waller变性与病人运动功能缺损程度有关。Werring等[21]研究证实发病后2个月~6个月脑梗死病人,患侧大脑脚FA值降低15%,而ADVAV无显着改变,认为各向异性改变是由于轴突分解产生的细胞碎屑以及神经胶质增生导致神经纤维束的完整性受到了损害。Uswatte等[23]报道,幕上脑梗死同侧锥体束FA值进行性降低与持久性偏侧肢体中至重度瘫痪相关,FA值降低越显着,梗死早期和3个月后运动功能受损越严重。
DTI是一种崭新的MR成像技术,反映了脑组织内水分子弥散的各向异性特征,可清晰显示脑内白质纤维束的走行和分布,为了解脑功能与白质通路间关系提供了强有力研究手段。在脑梗死诊断应用中,DTI与常规MRI及DWI相结合对梗死灶的解剖定位更准确,明确是否累及白质纤维束及其损伤范围。FA值与ADC值联合应用有助于对脑梗死进行更精确的临床分期,评估梗死发生时间。本研究仅对DTI应用于脑梗死进行了初步研究,时间短,样本例数少,存在一定局限性,对梗死后白质纤维改变与预后相关性,有待进一步研究。
[1]Sotak CH,Li L.M R imaging of anisotropic and restricted diffusion by simultaneous use of spin and stimulated echoes[J].Magn Reson M ed,1992,26:174-183.
[2]Thomalla G,Glauehe V,Koch M A,et al.Diffusion tensor imaging detects early Wallefian degeneration of the pyramidal tract after ischemic stroke[J].Neuroimage,2004,22:1767-1774.
[3]Le Bihan D,Mangin JF,Poupon C,et al.Diffusion tensor imaging:Concepts and applications[J].Neuroimage,2001,13:1174-1185.
[4]Parmar H,Golay X,Lee KE.Early experiences with diffusion tenso r imaging and magnetic resonance tractography in stroke patients[J].Singapore Med J,2006,47:198-203.
[5]Guo AC,MacFall JR,Provenzale JM,et al.Multiple sclerosis:Diffusion tensor M R Imaging fo revaluation of normal appearing white matter[J].Radiology,2002,222(3):729-736.
[6]Ciccarelli O,Parker GJM,T oosy AT,et al.From diffusion tractography to quantitative white matter:A reproducibility study[J].Neuroimage,2003,18(2):348-359.
[7]Nelles M,Gieseke J,Flacke S,et al.Diffusion tensor pyramidal tractography in patients with anterior choroidal artery infarcts[J].AJNR,2008,29:488-493.
[8]Sundgren PC,Dong Q,Gómez-Hassan D,et al.Diffusion tenso rimaging of the brain:Review of clinical applications[J].Neuroradiology,2004,46:339-350.
[9]Kunimatsu A,Aoki S,Masutani Y,et al.T hree-dimensional white matter tractog raphy by diffusion tensor imaging in ischaemic stroke involving the corticospinal tract[J].Neuroradiology,2003,45(8):532-535.
[10]Carano RA,Li F,Irie K,et al.Multispectral analysis of the temporal evolution of cerebral ischemia in the rat brain[J].J Magn Reson Imag,2000,12:842-858.
[11]杨艳梅,冯晓源,倪建明,等.大鼠急性脑缺血扩散张量成像各参数变化的实验研究[J].中国医学影像技术,2007,23(2):184-187.
[12]Harris AD,Pereira RS,Mitchell JR,et al.A comparison of images generated from diffusion-weighted and diffusion-tensor imaging data in hyper-acute stroke[J].J Magn Reson Imaging,2004,20(2):193-200.
[13]Bhagat YA,Hussain MS,Stobbe RW,et al.Elevations of diffusion anisotropy are associated with hyper-acute stroke:A serial imaging study[J].Magn Reson Imaging,2008,26(5):683-693.
[14]钟进,张云亭.MR扩散张量成像在急性脑梗死的临床应[J].中华放射学杂志,2005,39(7):766-681.
[15]Ozsunar Y,Grant PE,Huisman TA,et al.Evolution of water diffusion and anisotropy in hyperacute stroke:Significant correlation between fractional anisotropy and T2[J].AJNR Am J Neuroradiol,2004,25(5):699-705.
[16]Gillard JH,Papadakis NG,Martin K,et al.M R diffusion tensor imaging of white matter tract disruption in stroke at 3T[J].Br J Radiol,2001,74:642-647.
[17]Knight RA,Dereski MO,Helpern JA,et al.MRIassessment of Evolving focal cerebral ischemia:Comparison with histopathology in rats[J].Stroke,1994,25:1252-1262.
[18]Copen WA,Schwamm LH,Gonzalez RG,et al.Ischemic stroke:Effects of etiology and patient age in the time course of the co re apparent diffusion coefficient[J].Radiology,2001,221:27-34.
[19]Harris AD,Pereira RS,Mitchell JR,et al.A comparison of images generated from diffusion-weighted and diffusion-tensor imaging data in hyper-acute stroke[J].J Magn Reson Imaging,2004,20(2):193-200.
[20]Pierpaoli C,Barnett A,Pajevic S,et al.Water diffusion changes in wallerian degeneration and their dependence on white matter architecture[J].NeuroImage,2001,13(6):1174-1185.
[21]Werring DJ,Toosy AT,Clark CA,et al.Diffusion tensor imaging can detect and quantify corticospinal tract degeneration after stroke[J].J Neurol Neurosurg Psychiatry,2000,69(2):269-272.
[22]Khong P L,Zhou LJ,Ooi GC,et al.The evaluation of wallerian degeneration in chronic paediatric middle cerebral artery infarction using diffusion tensor M R Imaging[J].Cerebrovasc Dis,2004,18(3):240-247.
[23]U swatte G,Taub E,Morris D.The moto r activity Log-28:A ssessing daily use of the hemiparetic arm after stroke[J].Neurology,2006,67:1189-1194.



