丁 平
心房颤动是临床常见的心律失常,可引起血栓栓塞,导致脑卒中及系统性栓塞,诱发心绞痛,加重心力衰竭[1]。心房颤动具有较高的发病率、致残率和死亡率,已成为全球关注的公共卫生问题[2]。心房颤动病因复杂,常见的危险因素包括年龄、性别、高血压及瓣膜病等心脏器质性疾病。随着糖尿病发病率持续增高,糖尿病诱发心房颤动概率升高,流行病学资料发现,糖尿病病人发生心房颤动概率高于非糖尿病病人[3]。有研究显示,炎症反应激活和氧化应激增强可能在糖尿病并发心房颤动的发生发展中发挥着重要的作用,是两种疾病共同发展并相互影响[4-5]。相关研究显示,尿酸(uric acid,UA)和同型半胱氨酸(homocysteine,Hcy)不仅是心血管疾病的独立危险因素,也是氧化损伤和炎症反应过程中的重要标志物[6-8],但关于两者增高与心房颤动发生关系的报道较少。本研究探讨2型糖尿病病人血清UA、Hcy及其与并发心房颤动的相关性,以期为临床诊断和治疗提供新思路,尽早预防和减少心房颤动的发生,最大程度降低其带来的危害。
1 资料与方法
1.1 研究对象 选取2015年2月—2019年2月我院收治的2型糖尿病病人360例,其中男211例,女149例,年龄(63.9±8.7)岁,2型糖尿病病程(7.5±2.1)年。
1.2 病例选择标准
1.2.1 纳入标准 均符合中华医学会糖尿病分会制定的《中国2型糖尿病防治指南2017》[9]糖尿病诊断标准;行心电图或动态心电图监测,并根据《老年人非瓣膜性心房颤动诊治中国专家建议(2016)》标准诊断为心房颤动[10];阵发性心房颤动是指心房颤动发作时间<7 d;持续性心房颤动是指心房颤动发作时间>7 d,不能自行转复需要干预才能转复;永久性心房颤动是指持续时间较长不能转复或转复失败的心房颤动;住院资料完整。所有病人均了解研究内容,并签署知情同意书。
1.2.2 排除标准 先天性心脏病、风湿性心脏病及心肌病、心包炎病人;痛风、肿瘤、炎症疾病、自身免疫性疾病;严重心功能不全和肝肾功能不全病人;有精神疾病或意识障碍。
1.3 研究方法 收集病人年龄、性别、高血压、糖尿病、高脂血症及家族史等临床资料。采用AU5400全自动生化分析仪检测生化指标。入院次日抽取病人空腹静脉血,测定血常规、血生化、Hcy(循环酶法测定)、UA(尿酸氧化酶法测定),详细记录检验结果。所有病人均行心脏彩超,测量左房内径(LAD)、左室射血分数(LVEF)、左室舒张末期内径(LVEDD),并记录各项指标。肾小球滤过率计算采用MDRD公式。病人入院后均接受12导联心电图或24 h动态心电图监测,以心电监护、心电图或动态心电图记录到的心房颤动为标准,并根据是否发生心房颤动将病人分为心房颤动组和非心房颤动组。高尿酸血症诊断标准:男性空腹血UA≥416 μmol/L,女性空腹血UA≥357 μmol/L[11]。根据血清UA是否升高将病人分为高尿酸组和尿酸正常组。

2 结 果
2.1 临床资料 360例2型糖尿病病人中,54例伴发心房颤动,发生率为15%,其中男32例,阵发性心房颤动7例,持续性心房颤动28例,永久性心房颤动19例。根据是否发生心房颤动将病人分为心房颤动组(54例)和非心房颤动组(306例),两组临床资料比较,差异均无统计学意义(P>0.05)。详见表1。

表1 非心房颤动组和心房颤动组临床资料比较
2.2 高尿酸组和尿酸正常组心房颤动发生情况、Hcy水平比较 根据是否存在高尿酸血症,将病人分为高尿酸组(144例)和尿酸正常组(216例)。高尿酸组心房颤动发生率高于尿酸正常组(P<0.001);高尿酸组Hcy水平高于尿酸正常组(P<0.001)。详见表2。
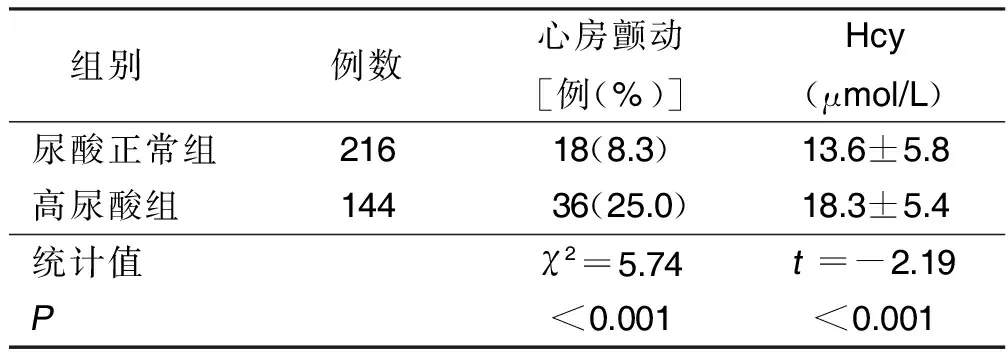
表2 高尿酸组和尿酸正常组心房颤动发生情况、Hcy水平比较
2.3 非心房颤动组和心房颤动组UA、Hcy水平及心脏超声指标比较 心房颤动组UA、Hcy水平和LAD高于非心房颤动组,差异有统计学意义(P<0.001)。两组LVEF和LVEDD比较,差异无统计学意义(P>0.05)。详见表3。
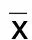
表3 非心房颤动组和心房颤动组UA、Hcy水平及心脏超声指标比较(±s)
2.4 血清UA、Hcy水平与LAD的相关性分析 相关性分析结果显示,血清UA水平与LAD呈正相关(r=0.58,P<0.05);血清Hcy水平与LAD呈正相关(r=0.63,P<0.05);血清UA水平和Hcy水平呈正相关(r=0.52,P<0.05)。
3 讨 论
心房颤动在2型糖尿病病人中较常见,与传统的危险因素(年龄、性别、BMI、高血压等)相比,血糖升高可能促进心房颤动发生[12]。糖尿病病人并发心房颤动后,心脑血管事件(猝死、心力衰竭、急性冠脉综合征及脑卒中)发生率增加61%[13]。糖尿病病程存在多种异常的病理生理状态,可能激活并加重一系列炎症、氧化应激反应,导致心脏电重构和结构重构,这些变化均可能成为心房颤动发生及维持的重要因素[14]。
血清Hcy是人体内蛋氨酸和半胱氨酸代谢的中间产物,与动脉粥样硬化发生发展关系密切,是公认的心血管疾病独立危险因素[15]。有研究显示,Hcy是一种氧化应激标志物[16]。Hcy在自身氧化过程中产生大量过氧化氢、羟自由基等一系列超氧化物,诱导白细胞介素-6、肿瘤坏死因子α等炎症细胞因子表达,引发氧化应激,损伤心肌细胞[17]。Hcy在炎症过程中引起Ⅰ型胶原蛋白降解和细胞外基质(ECM)大量堆积,使心肌细胞肥大、过度纤维化并大量增生,导致心房结构重构[18]。Hcy通过增多的氧化物质直接影响钙调蛋白产生细胞内钙超载、钠电流异常激活和失活、超速钾通道抑制[19],导致心房肌细胞电重构。王雅坤等[20]研究显示,心房颤动病人Hcy水平高于非心房颤动病人。Nasso等[21]研究显示,血清Hcy水平不仅与心房颤动发生相关,还对心房颤动转复治疗后的复发有预测价值。本研究结果显示,心房颤动组Hcy水平和LAD显着高于非心房颤动组,Hcy水平与LAD呈正相关(r=0.63,P<0.05),证实Hcy参与左心房结构重构和电重构过程,进一步表明炎症与心房颤动的发生发展有密切关系。
UA是体内嘌呤代谢的主要产物,其水平受到血糖代谢的影响[22]。糖尿病伴随一系列的代谢紊乱,其中高尿酸血症发病率逐年升高[23]。长期UA升高不仅会侵蚀骨关节,而且累及心血管系统。Kuwabara等[24]研究显示,心房颤动组较非心房颤动组有较高水平的尿酸[OR=1.35,95%CI(1.22,1.50)]。一项纳入80 283例病人的荟萃研究认为,UA升高导致的慢性炎症激活和氧化应激是促使心房颤动发生的重要原因[25]。高尿酸血症促使炎症介质和氧自由基的大量分泌,内皮源性一氧化氮合成减少[26-27],造成内皮功能损伤、平滑肌细胞溶解、心肌细胞凋亡和成纤维细胞增殖,这些均导致左心房体积增大和心房结构重构,为心房颤动的发生发展提供了解剖学基础[28]。高UA通过调节细胞内部分蛋白的表达和钙信号异常[29],激活心房激动的异源性传导,加重去极化后延迟及传导阻滞,导致心房电重构,为心房颤动发生持续提供电生理学基础[30]。本研究结果显示,高尿酸组心房颤动发生率高于尿酸正常组(25.0%与8.3%,P<0.001);心房颤动组UA水平和LAD高于非心房颤动,且UA水平与LAD呈正相关(r=0.58,P<0.05),证实高尿酸血症与心房颤动的发生发展存在密切关系。
心房重构尤其是结构重构,是心房颤动发生和持续的重要基础,LAD可反映心房结构重构的程度[31]。LAD增大引起心房收缩功能减退,心腔内负荷增加,心房超微结构发生改变,导致心肌传导不均一性损害,发生多个微折返,为心房颤动的发生和持续提供了病理基础。本研究结果显示,心房颤动组LAD较非心房颤动组扩大(P<0.001),血清UA、Hcy与LAD呈正相关,血清UA与Hcy呈正相关(r=0.52,P<0.05)。一方面提示糖尿病合并心房颤动病人存在高炎症状态,炎症持续存在引起心肌重构及心房颤动发生发展;另一方面证实血清UA和Hcy通过激活炎症反应和氧化应激,造成心房结构重构和电重构,心房损害越重内径越大,有利于折返发生,心房颤动易持续。
2型糖尿病预防心房颤动除有效控制血糖外,推荐早期联合检测血清UA和Hcy水平,可预测心房颤动发生风险,从而降低心血管事件的发生。



