秦 琦,王有雪,左 芳,王东海
心肌梗死(MI)是在冠状动脉粥样硬化的基础上,因斑块破裂导致急性血供中断,造成心肌缺血坏死的一种疾病,是致死率最高的疾病之一,严重威胁人类健康。近年来,该疾病的发病率急剧上升,而且呈现年轻化趋势,造成病人的生活质量严重下降[1]。近年来在药物治疗缺血性心肌损伤方面有了最新进展,神经调节蛋白1(NRG1)/erb-b2 受体酪氨酸激酶(ErbB)2 通路成了国内外最新研究热点,有研究表明,NRG1-ErbB2 通路可以减少心肌细胞的缺血损伤、凋亡,抑制心肌细胞增殖及平滑肌过度增生[2]。Polizzotti 等[3]研究应用局部冷冻的方法损伤新生小鼠的心肌细胞,应用NRG1 治疗后心肌细胞功能明显保留,而且依然保持了心肌细胞的再生能力。有研究推测NRG1 疗法有可能是通过刺激新生血管来保护心肌免于损伤[4]。而且有研究表明缺氧可以增高内质网压力,并诱导心肌凋亡,而NRG1 疗法可以减少其导致的心肌细胞损伤从而保护心脏[5]。然而大量补充NRG1 存在副作用,如心功能损伤及致癌风险等,因此,合理的剂量及应用疗程成了目前研究的热点。中医学在冠心病治疗上具有安全有效、副作用小等独特的优势。前期临床研究表明,两和辅心饮具有理气和血、宁心安神之功效,能有效改善冠心病病人疼痛及活动后气短等临床症状。另外,还发现部分病人服用两和辅心饮后复查心脏彩超梗死面积较前缩小,但具体作用机制尚不清楚。因此,进一步研究其作用机制是本课题组下一步拟进行的工作。结合前期预实验结果,本研究旨在寻找两和辅心饮与心肌代谢通路NRG1-ErbB2 的关系,并探讨其对心肌细胞损伤的修复作用,以期为冠心病的治疗以及该方剂的进一步临床应用提供科研数据支撑。
1 材料与方法
1.1 实验动物分组与取材
1.1.1 实验动物与分组 3~6 月龄无特定病原体(SPF)级Wistar 雄性大鼠80 只,体质量(200±20)g,实验动物均由辽宁中医药大学实验动物中心提供,动物许可证号:SCXK(辽)2018-0001。适应性喂养1 周。按随机数字表法随机分为5 组:假手术组(Sham 组)、模型组(MIRI 组)、低剂量组、中剂量组、高剂量组,每组16 只。
1.1.2 动物造模方法 参照杨建业等改进的造模方法,制造液氮冷冻大鼠心肌梗死模型[6]。取Wistar 大鼠,按照250 mg/kg 剂量腹腔注射10%水合氯醛,待其麻醉成功后气管切开、插管,应用动物呼吸机正压辅助通气。胸部去毛,消毒,沿左锁骨中线纵行切开皮肤2~3 cm,分别剥离深浅筋膜,在第4 肋间或第5 肋间钝性分离肌层,撕开心包,用棉签推开胸腺,暴露心脏,在主动脉根部约1/3 处找到左冠状动脉,用圆柱形钢钉头部(头直径0.2 cm)迅速置于该区域并冷冻约10 s。此时观察心电图动态变化,如发现两个及以上导联出现ST 段上抬>0.2 mV 且肉眼可见被冷冻的区域心肌逐渐变灰白,结霜,继而呈红色肿胀,即可判断手术成功。术后常规应用青霉素3 d(每只每天10×104U)以预防感染,加强营养支持1 周。
1.1.3 给药方案及取材 按“动物与人体的每千克体重剂量折算系数表”确定低、中、高剂量,折合大鼠生药量为0.96 g/100 g,1.92 g/100 g,3.84 g/100 g;按10 mL/kg 给药体积及大鼠体质量计算给药量,灌胃给药,假手术组及模型组给予等量蒸馏水。两和辅心饮由辽宁中医药大学附属第二医院制剂中心提供。每日灌胃给药2次,连续给药21 d。实验结束后禁食不禁水12 h,予10%水合氯醛麻醉,沿着左锁骨中线用剪刀剪开皮肤,以钝器分离组织,暴露心脏,取左心室前壁坏死区及周围的心肌组织,一部分予10%甲醛溶液固定;另一部分心肌组织存于EP 管中,置于-70 ℃冰箱备用。
1.2 主要试剂与仪器
1.2.1 主要试剂与耗材 苏木素-伊红(HE)染液试剂盒(江苏凯基生物技术股份有限公司,KGA224);苏木素染色液(南京建成公司,D005);二甲苯(国药集团化学试剂有限公司,1330-20-7);中性树胶(国药集团化学试剂有限公司,10004160);磷酸盐缓冲液(PBS)(KGB5001)、柠檬酸钠缓冲液(KGB5001)、免疫组化笔(KGSP10)、全蛋白抽提试剂盒、二喹啉甲酸(BCA)蛋白含量检测试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒(KGP113)、预染蛋白分子量(KGP441)、5×SDS-PAGE 蛋白上样缓冲液(KGP101)、1 × Tris-甘 氨 酸 蛋 白 电 泳 缓 冲 液(KGP103X)、蛋白质免疫印迹(Western Blot)法检测试剂盒,均购自江苏凯基生物技术股份有限公司;NC膜(USA PALL 66485);TRIzol(美国Invitrogen 15596-026);氯仿、异丙醇(南京化学试剂500 mL);70%乙醇[焦碳酸二乙脂(DEPC)处理]、0.1% DEPC Water(江苏凯基生物技术股份有限公司,KGDN4500);cDNA 第一链合成试剂盒(日本TaKaRa RR036B);One Step TB GreenTMPrimeScriptTMRT-PCR Kit Ⅱ(SYBR Green,日本TaKaRa RR086B)。
1.2.2 仪器与设备 电热扶风干燥箱(上海圣欣科学仪器有限公司101AS-3);生物荧光显微镜(日本Olympus,BX43);台式恒温振荡器(中国上海精宏实验设备有限公司,THZ-312);电泳仪(美国Bio-rad Power Supplies Basic);Trans-Blot Turbo 全能型蛋白转印系统(美国Bio-rad,170-4150);凝胶成像系统(英国SYNGENE G:BOXChemiXR5);台式恒温振荡器(上海精宏实验设备有限公司,THZ-312);脱色摇床(江苏正基仪器有限公司);涡旋振荡器(海门其林贝尔,XW-80A);高速冷冻离心机(美国Thermo Sorvall ST,16R);多功能酶标仪(美国 MD Spectramac,M3);pH 计(美国OHAUS STARTER,2C);立式压力锅(上海博讯医疗生物仪器股份有限公司,YXQ-LS-50);电热鼓风干燥箱(上海圣欣科学仪器股份有限公司,101AS-3);分析天平(德国Sartorius,BL310/BL21S);超净工作台(苏州净化设备有限公司,SW-CJ-1FD);台式低速离心机(上海医疗器械有限公司);紫外光度仪(日本SHIMADZU,UV-2450);普通梯度聚合酶链式反应(PCR)仪(美国ABI Veriti 96 well Thermal cycler);荧光定量PCR 循环仪(美国ABI Step one plus Real time-PCR system)。
1.3 HE 染色 按常规方法进行脱蜡,水合,将切片用二甲苯浸泡5 min,更换二甲苯后再浸泡5 min;分别于无水乙醇中浸泡5 min;在95%、85%、70%的乙醇中分别浸泡5 min,PBS 浸洗3 min×3 次;浸入试剂盒中试剂一核染液染缸内染色3~5 min,水洗30~60 s;浸入试剂盒中试剂二分色液Ⅰ中约20 s,水洗30~60 s;浸入试剂盒中试剂三分色液Ⅱ中40 s,水洗30~60 s;置于试剂盒中试剂死浆染液中染色2 min,再用试剂五增色液洗去多余染液,洗2 次,滤纸吸干,封片镜检。用光学显微镜400 倍视野下观察心肌组织病理情况。
1.4 Western Blot 检测 蛋白提取定量,进行SDSPAGE,而后使用半干转移系统转膜,完成后按比例依次加入一抗、二抗进行孵育,孵育最佳时间后进行化学发光、显影、定影、拍照并晾干。用扫描仪扫描图片后结果进行灰度分析(Gel-Pro32 软件)。
1.5 实时荧光定量PCR(RT-PCR) ①RNA 提取:将心肌组织切碎放入研钵中,加入1 mL 预冷的TRIzol,研磨至无明显的颗粒,将样品倒入1.5 mL 离心管中,室温下放置5 min 后;加入氯仿,盖紧管盖后,将其上下振荡约15 s,在室温下再静置3 min;然后以1 200 r/min、4 ℃离心15 min;小心吸取上清至空白离心管,并加入等体积的异丙醇,其后再慢慢混匀,常温静置约10 min;再次以1 200 r/min、4 ℃离心10 min;去除上清,并沿管壁加入70%乙醇1 mL,摇匀;1 200 r/min、4 ℃离心10 min;在室温下干燥沉淀5 min,加入无RNase 水30~50 μL溶解RNA 沉淀,于-70 ℃条件下保存。②cDNA 第一链合成(20μL 体系):混匀,2 000 r/min 条件下离心20 s;取0.2 mL PCR 管,加 入 RNA(2 μg)2 μL,5×PrimeScript RT Master Mix 2 μL,无核酸酶的双蒸水至总体积10μL;轻轻混匀后,然后以2 000 r/min 离心20 s,37 ℃保温15 min,85 ℃保温5 s,然后置于冰上5 min;立即进行下一步的PCR 反应。RT-PCR 正式实验:每个样本基因做3 个复孔,在0.1 mL PCR 管依次加入如下组分:2× RT-PCR Master Mix(SYBR Green)10μL;模板(cDNA 稀释10 倍)1 μL;引物MIX(F/R 各10 μmol/L)2 μL;0.1% DEPC 水7 μL;Total volume 20μL。
1.6 统计学处理 采用SPSS 17.0 软件进行数据分析。符合正态分布的定量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2 结 果
2.1 HE 染色观察心肌组织病理变化 Sham 组:心肌细胞排列整齐,界限清楚,无变性,未见间质充血,未见炎性细胞浸润。MIRI 组:心肌细胞紊乱,界限不清,心肌细胞肿胀明显,无变性,部分间质充血,可见炎性细胞浸润。低剂量组:心肌细胞紊乱,界限不清,心肌细胞肿胀有所减轻,无变性,部分间质充血,可见炎性细胞浸润。中剂量组:心肌细胞紊乱,界限不清,心肌细胞肿胀有所减轻,无变性,部分间质充血,可见炎性细胞浸润。高剂量组:心肌细胞排列整齐,界限清楚,部分心肌细胞肿胀,无变性,部分间质充血,可见炎性细胞浸润。详见图1。可见,经过两和辅心饮治疗后,低剂量组、中剂量组、高剂量组心肌细胞排列逐渐整齐,心肌细胞肿胀明显减轻,间质充血减轻,炎性细胞浸润有所缓解。
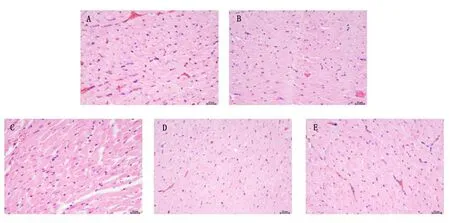
图1 各组大鼠心肌组织HE 染色结果
2.2 各组NRG1、ErbB2 蛋白表达情况比较 以3-磷酸甘油醛脱氢酶(GAPDH)为内参,与Sham 组比较,MIRI 组NRG1、ErbB2 蛋白表达均降低,差异有统计学意义(P<0.05);低剂量组、中剂量组、高剂量组NRG1及ErbB2 蛋白表达随着药物浓度的增加而升高,呈剂量依赖性,差异均有统计学意义(P<0.05)。另外,蛋白相对表达水平(经内参GAPDH 校正后以NRG1/GAPDH、ErbB2/GAPDH)灰度分析显示:与MIRI 组比较,各给药组NRG1/GAPDH 表达水平明显升高,ErbB2/GAPDH 表达水平也升高,并呈剂量依赖性,差异均有统计学意义(P<0.05)。详见图2、表1。
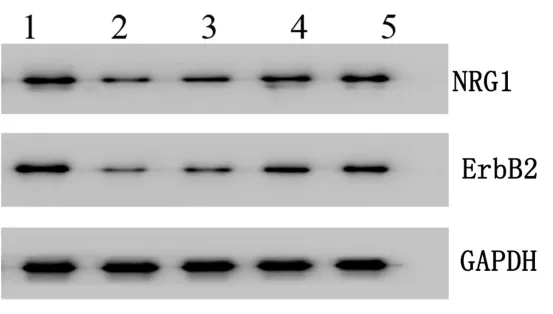
图2 Western Blot 法检测各组大鼠心肌细胞蛋白表达条带图
表1 各组GAPDH 校正值灰度分析(±s)
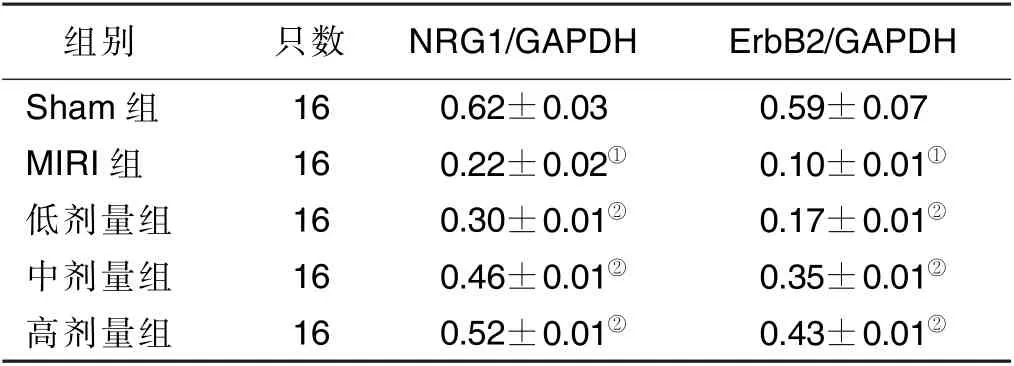
表1 各组GAPDH 校正值灰度分析(±s)
MIRI 组与Sham 组比较,①P <0.05;与MIRI 组比较,②P <0.05。
组别 只数 NRG1/GAPDH ErbB2/GAPDH Sham 组 16 0.62±0.03 0.59±0.07 MIRI 组 16 0.22±0.02① 0.10±0.01①低剂量组 16 0.30±0.01② 0.17±0.01②中剂量组 16 0.46±0.01② 0.35±0.01②高剂量组 16 0.52±0.01② 0.43±0.01②
2.3 各组NRG1、ErbB2 mRNA 表达情况比较 采用RT-PCR 法检测各组NRG1、ErbB2 mRNA 表达情况,与Sham 组相比,MIRI 组NRG1、ErbB2 的mRNA 表达水平明显降低(P<0.05)。表明随着心肌缺血缺氧的发生,NRG1、ErbB2 在心肌中的含量降低。低剂量组、中剂量组、高剂量组NRG1、ErbB2 mRNA 表达水平较MIRI 组明显升高(P<0.05),且剂量越高其mRNA 表达越接近于Sham 组,呈剂量依赖性。详见表2。
表2 各组NRG1、ErbB2 mRNA表达水平比较(±s)

表2 各组NRG1、ErbB2 mRNA表达水平比较(±s)
MIRI 组与Sham 组比较,①P <0.05;与MIRI 组比较,②P <0.05。
组别 只数 NRG1 ErbB2 Sham 组 16 1.00±0.04 1.00±0.06 MIRI 组 16 0.26±0.02① 0.33±0.02①低剂量组 16 0.42±0.02② 0.52±0.01②中剂量组 16 0.70±0.01② 0.74±0.04②高剂量组 16 0.87±0.03② 0.83±0.03②
3 讨 论
冠心病以冠状动脉粥样硬化为基础病理改变,其发生发展机制与炎症反应、氧化应激及细胞损伤等相关。NRG1 作为表皮生长因子家族成员之一,在心血管系统含量最多[6-7],通过激活ErbB2 参与心肌细胞的生长繁殖,具有维持心肌细胞结构及功能的重要作用[8]。NRG1 可激活多重下游信号通路,进而维持心肌细胞的正常功能[9]。酪氨酸激酶受体(ErbBs)分为4 个亚型,其中,分布在心肌细胞的为ErbB2、ErbB4。ErbB2 作为表皮生长因子家族中的一员,有研究发现在单核细胞、巨噬细胞等细胞类型中表达,据报道,其出现在动脉粥样硬化性损伤处,且由配体受体相互作用被激活后参与调节细胞增殖和凋亡的多条信号通路[10-11]。有研究表明,NRG1-ErbB2 通路在心力衰竭心脏修复及心肌再生中起到了很重要的调节作用[12]。还有研究显示,冠心病急性心肌梗死导致心肌肥厚,通过补充重组NRG1 可改善其症状及心肌细胞存活,表明NRG1-ErbB2 信号通路参与心肌细胞生长繁殖并对维持心肌细胞结构和功能发挥重要作用[13-14]。因此,研究中药汤剂对该通路的影响可能提示该药对心肌细胞损伤有修复作用。目前国内研究中药对此通路干预的文献较少,具有很好的研究价值。冠心病属中医学“胸痹”“心痛”范畴,“阳微阴弦”是对“胸痹”“心痛”病机的高度概括,“阳微”意指上焦阳气不足,“阴弦”指下焦阴寒气盛,由于上焦阳气不振,阴寒之邪乘虚而犯,痹阻胸阳,胸阳失展,则发胸痹而痛,乃本虚标实之证。胸痹心痛虚多实少,乃“心气不足,营气不周”,根据“损其心者,调其营卫”的原则,以补为本,以通为用。本研究选用具有益气活血通络功效的两和辅心饮,由党参、丹参、鸡血藤、郁金、石菖蒲、没药、香附、远志、茯神、砂仁、檀香、三七组成。方中以党参一味为君药,大补心气;丹参、鸡血藤为臣药,养血活血;三七为佐药,化瘀止痛;远志、菖蒲、香附子、茯神4 味为使药,化痰开窍、调气安神,这4 味药又暗合《千金要方》定志丸、《杂病源流犀烛》交感丹在内,共同交通心肾,定志宁心。鸡血藤为养血活血药,郁金活血而不伤正气,石菖蒲具有止痛、运中、强心作用,本方目的是“助心气”,意在以补心气则推动血行,合丹参饮活血化瘀,行气止痛,血行通畅,则痰瘀可化解于无形。现代药理研究表明,作为党参主要成分之一的党参苍术内脂Ⅲ具有明显的抗炎作用[15]。另外,丹参还能够扩张动脉,尤其是对于冠状动脉和肢体动脉,扩张作用显着[16]。
本课题组前期临床研究表明该方能明显减少梗死后心绞痛病人的发作次数,但该方的作用机制尚不明确。本研究结果显示,经过两和辅心饮治疗后,大鼠心肌细胞排列逐渐整齐,心肌细胞的肿胀程度明显减轻,间质充血减轻,炎性细胞浸润有所缓解,体现其对心肌细胞具有一定保护作用。应用两和辅心饮能明显提高大鼠心肌细胞NRG1-ErbB2 的蛋白表达,并呈剂量依赖性;另外RT-PCR 结果也表明,应用两和辅心饮后,NRG1-ErbB2 的mRNA 表达上调。提示两和辅心饮对该通路的表达确实存在上调作用。因此,推断两和辅心饮可以通过上调NRG1-ErbB2 通路改善心肌细胞损伤。另外,该方是否对心肌损伤的其他机制存在影响,需要进行下一步研究。
综上所述,两和辅心饮可以上调NRG1-ErbB2 代谢通路,并推断其修复心肌细胞损伤作用可能是通过调节该通路实现的。



