何望安,王 茹,朱宏飞,蔡绍乾,魏 丹,余 成,单苏红
心肌缺血再灌注损伤是指冠状动脉部分或完全急性梗阻后,恢复血流反而促使组织损伤加重,甚至出现不可逆损伤的现象。近年来,随着冠状动脉介入治疗、冠脉搭桥治疗以及冠状动脉溶栓等治疗手段的广泛应用,心肌缺血再灌注损伤所带来的二次损伤一定程度上影响了治疗效果[1]。因此,抑制心肌缺血再灌注损伤已然成为当代临床亟待解决的关键问题之一。目前对于心肌缺血再灌注损伤的防治主要包含缺血预处理和缺血后处理等手段[2],尽管具有一定疗效,但仍存在有一定局限性以及副作用等问题,仍需探索新的高效低副作用的药物。安五脂素源于华中五味子,是组成木脂素重要成分之一,已有研究报道安五脂素对衰老小鼠的心肌损伤具有保护作用[3]。然而安五脂素对心肌缺血再灌注损伤是否也发挥保护作用未知。针对心肌缺血再灌注损伤治疗的关键在于救活尚存活的心肌细胞、抑制心肌细胞凋亡,而再灌注损伤补救激酶(RISK)信号通路是细胞存活的关键机制之一[4]。RISK信号通路是蛋白激酶B(AKT)和细胞外调节蛋白激酶1/2(ERK1/2)信号通路的组合,已有研究表明该通路在心肌缺血再灌注损伤中发挥重要作用[5-7]。然而安五脂素能否通过调控RISK信号通路在心肌缺血再灌注损伤中发挥作用未知。鉴于此本研究选取60只SD大鼠开展动物实验,探究安五脂素通过调控RISK信号通路影响大鼠心肌缺血再灌注损伤的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
60只7~9周龄Sgrague Dawley(SD)大鼠,清洁级,雌雄各半,体质量200~250 g,购自广州锐格生物科技有限公司,实验动物生产许可证号:SCXK(粤)2021-0059,使用许可证号:SYXK(粤)2021-0259。
1.1.2 实验药物与试剂
安五脂素(购自上海信裕生物科技有限公司,生产批号:XY98539);乌拉坦(购自上海联硕生物科技有限公司,生产批号:U2500);大鼠血浆肌酸激酶(CK)酶联免疫吸附实验(ELISA)检测试剂盒、乳酸脱氢酶(LDH)ELISA检测试剂盒(购自上海研生实业有限公司,生产批号:YRX300332R、YS-H5426);2,3,5-氯化三苯基四氮唑(TTC)溶液(购自青岛高科技工业园海博生物技术有限公司,生产批号:HB0268a);苏木素-伊红(HE)染色试剂盒、总核糖核酸(RNA)提取试剂盒[购自生工生物工程(上海)股份有限公司,生产批号:E607318-0200、B511311-0100];AKT、ERK1/2、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-肌动蛋白(β-actin)聚合酶链反应(PCR)引物(由合肥知恩生物技术有限公司合成);原位末端标记法(TUNEL)细胞凋亡检测试剂盒(购自瑞士罗氏公司,生产批号:11684817910-POD);二喹啉甲酸(BCA)蛋白浓度检测试剂盒(购自博士德生物工程有限公司,生产批号:AR0146);兔抗大鼠AKT、磷酸化(p)-AKT、ERK1/2、p-ERK1/2、Bcl-2、Bax、β-actin单克隆抗体(一抗),羊抗兔AKT、p-AKT、ERK1/2、p-ERK1/2、Bcl-2、Bax、β-actin辣根过氧化物酶标记多克隆抗体(二抗)(生产批号:4685S、ab38449、BS6426、ab17942、ab196495、ab53154、ab8227;A0208、QN2742、MBS851214、ALX-810-013-R100、A18415、GOY-D7372、CYB163034)。
1.1.3 实验仪器
DW-3000型小动物人工呼吸机(购自安徽正华生物仪器设备有限公司);CP1200型床边监护仪(购自上海掌动医疗科技有限公司);H2100R型高速离心机(购自长沙高新技术产业开发区湘仪离心机仪器有限公司);iD5型酶标仪[购自美谷分子仪器(上海)有限公司];LW400LJT型光学显微镜(购自上海测维光电技术有限公司);QTOWER2.2型PCR仪(购自德国耶拿)。
1.2 实验方法
1.2.1 建模、分组及给药方法
采用随机数字表法将60只大鼠分为模型组、假手术组、尼可地尔组及安五脂素低、中、高剂量组,每组10只。根据既往研究[8]对除假手术组以外各组大鼠构建心肌缺血再灌注模型。腹腔注射乌拉坦(1 g/kg)麻醉各组大鼠,监测肢体Ⅱ导联心电图;行人工呼吸机正压通气,于左侧开胸,暴露心脏及表面血管,结扎冠状动脉左前降支致其闭塞,结扎30 min后松解结扎线,再灌注120 min;缺血时,心电图S-T段明显抬高,松开结扎线后,抬高的S-T段回落,表明心肌再灌注模型构建成功。假手术组大鼠仅开胸、穿线但不结扎。于缺血前10 min向各组大鼠给药,尼可地尔组予以含尼可地尔100 μmol/L的K-H液1 mL/100 g灌注心肌,安五脂素低、中、高剂量组分别予以含安五脂素1、2、4 mg/kg的K-H液1 mL/100 g灌注心肌,模型组和假手术组仅予以等量K-H液灌注心肌。
1.2.2 各组大鼠CK、LDH水平检测
再灌注结束后,经颈动脉插管取血2 mL,以4 000 r/min(有效离心半径6.2 cm)离心10 min后取血浆,采用ELISA法检测各组CK、LDH含量:酶标板包被相应抗体,向酶标板加待测样品,加生物素标记抗体,孵育,加显色底物,450 nm处检测吸光度值。
1.2.3 各组大鼠心肌梗死面积测定方法
采用TTC染色[9]观察心肌梗死情况。再灌注结束后,自心尖向心底平行于房室沟方向取1/2心脏左室,同样方向将左室切成1 mm厚度切片,放入1%TTC溶液中孵育10 min,生理盐水冲洗。因采取全心缺血,整个左室区域(LV)代表缺血危险区。扫描切片,采用Image J图像分析软件分析,计算梗死区面积与缺血危险区面积比值(AN/LV),取平均值。
1.2.4 各组大鼠心肌组织病理变化
HE染色观察各组大鼠心肌组织病理变化。再灌注结束后,取各组大鼠心肌组织约1 mm×1 mm×1 mm体积组织块,多聚甲醛固定,常规石蜡包埋,脱蜡,切片(5 μm),HE染色:苏木素染色10 min,洗涤,伊红染色1 min,洗涤,中性树胶封片,光学显微镜下观察心肌组织病理变化。
1.2.5 各组大鼠心肌细胞凋亡检测
采用TUNEL染色检测心肌细胞凋亡。再灌注结束后,取各组大鼠心肌组织约1 mm×1 mm×1 mm体积组织块,多聚甲醛固定24 h,常规脱水、包埋、制成厚度为4 μm切片。切片脱蜡水化。滴加过氧化氢溶液37 ℃孵育30 min,洗涤;滴加蛋白酶K溶液37 ℃孵育10 min,洗涤;制备TUNEL反应混合液,5 μL TdT+45 μL荧光素标记脱氧尿三磷酸(dUTP)液,滴加TUNEL混合液,37 ℃孵育1 h,洗涤。滴加转化剂-POD,7 ℃孵育30 min,洗涤。滴加DAB底物溶液,终止反应。苏木素复染切片3 min,水洗,分化,返蓝,脱水脱透明封片。阴性对照仅滴加荧光素标记dUTP液,其余步骤同上。光学显微镜观察细胞凋亡情况,正常心肌细胞被染成蓝色,凋亡心肌细胞被染成棕褐色。每组3张切片,每张切片随机选取10个视野计算心肌细胞凋亡率,取平均值。心肌细胞凋亡率=染色阳性心肌细胞数/总心肌细胞数×100%。
1.2.6 各组大鼠心肌组织AKT、ERK1/2、Bcl-2、Bax mRNA表达检测
实时-逆转录聚合酶链式反应(RT-qPCR)检测大鼠心肌组织待测基因mRNA表达。取大鼠心肌组织100 mg,提取心肌组织中总RNA,核酸蛋白检测仪检测纯度为1.8~2.0合格。逆转录合成互补脱氧核糖核酸,进行PCR反应,反应条件:95 ℃预变性5 min,94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸40 s,循环30次,72 ℃终末延伸7 min。所需引物序列见表1。本研究选取β-actin作为内参,以2-ΔΔCt表示待基因相对表达量[10]。

表1 PCR所需引物序列
1.2.7 各组大鼠心肌组织AKT、ERK1/2、Bcl-2、Bax蛋白表达及p-AKT、p-ERK1/2水平检测
采用蛋白质免疫印迹法(Western Blot)检测大鼠心肌组织AKT、ERK1/2、Bcl-2、Bax蛋白表达及p-AKT、p-ERK1/2水平。取心肌组织100 mg,加组织裂解液,剪碎组织,匀浆,14 000 r/min(有效离心半径6.2 cm)离心20 min,取上清液,二喹啉甲酸法(BCA)检测蛋白浓度,调整蛋白终浓度为10 μg/μL,每组上样3 μL,电泳,转膜,一抗(稀释倍数1∶500)孵育过夜,辣根过氧化物酶标记二抗(稀释倍数1∶1 000)标记孵育1 h,显色,Image-ProPlus图像分析关键分析蛋白条带。
1.3 统计学处理
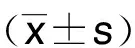
2 结 果
2.1 建模情况
与假手术组比较,模型组大鼠结扎冠状动脉左前降支30 min后,心电图S-T段明显抬高,松开结扎线再灌注120 min后抬高的S-T段回落。
2.2 各组大鼠血浆心肌酶和心肌梗死区面积/缺血危险区面积比较
与假手术组比较,模型组CK和LDH含量、AN/LV显着升高(P<0.01);与模型组比较,尼可地尔组和安五脂素低、中、高剂量组CK和LDH含量、AN/LV降低差异有统计学意义(P<0.05或P<0.01);且以上指标在尼可地尔组与安五脂素低剂量组间比较差异无统计学意义(P>0.05),在安五脂素低、中、高剂量组间呈剂量依赖性(P<0.05)。详见表2、图1。
图1 各组大鼠心肌AN/LV比较
表2 各组大鼠CK、LDH含量比较 单位:U/mL
2.3 各组大鼠心肌组织病理改变和心肌细胞凋亡率比较
假手术组心肌细胞正常;与假手术组比较,模型组心肌细胞边缘基本消失,纹理变乱,明显存在红细胞进入现象,心肌细胞凋亡率上升(P<0.01);与模型组比较,尼可地尔组和安五脂素低剂量组心肌细胞损伤减轻、细胞略变完整、细胞边界变清晰、红细胞减少、心肌细胞凋亡率下降(P<0.01),安五脂素中剂量组心肌细胞损伤进一步减轻、细胞更完整、细胞边界更清晰、红细胞进一步减少、心肌细胞凋亡率下降(P<0.01),安五脂素高剂量组心肌细胞损伤程度最小、细胞完整性边界清晰度趋于正常、心肌细胞凋亡率下降(P<0.01);尼可地尔组和安五脂素低剂量组差异无统计学意义(P>0.05);安五脂素3个剂量组呈剂量依赖性。详见图2~图4。
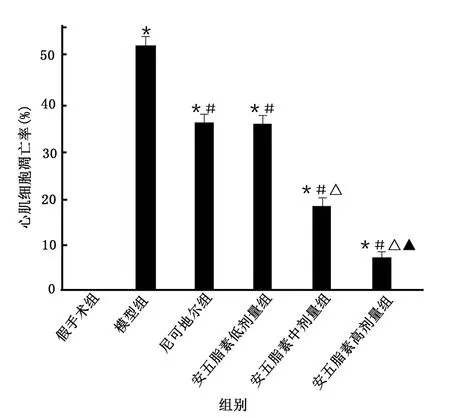
图4 各组大鼠心肌细胞凋亡率比较
2.4 各组大鼠心肌组织AKT、ERK1/2、Bcl-2、Bax的mRNA表达比较
与假手术组比较,模型组AKT、ERK1/2、Bcl-2 mRNA表达降低(P<0.01),Bax mRNA表达上升(P<0.01);与模型组比较,尼可地尔组和安五脂素3个剂量组AKT、ERK1/2、Bcl-2 mRNA表达升高,Bax mRNA表达降低,差异有统计学意义(P<0.05或P<0.01);上述指标尼可地尔组和安五脂素低剂量组差异无统计学意义(P>0.05);上述指标安五脂素3剂量组呈剂量依赖性。详见表3。
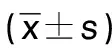
表3 各组大鼠心肌组织AKT、ERK1/2、Bcl-2、Bax mRNA相对表达量
2.5 各组大鼠心肌组织AKT、ERK1/2、Bcl-2、Bax蛋白表达及p-AKT、p-ERK1/2水平比较
与假手术组比较,模型组p-AKT、p-AKT/AKT、p-ERK1/2和p-ERK1/2/ERK1/2水平、Bcl-2蛋白表达降低,Bax蛋白表达升高(P<0.01);与模型组比较,尼可地尔组和安五脂素3个剂量组p-AKT、p-AKT/AKT、p-ERK1/2和p-ERK1/2/ERK1/2水平、Bcl-2蛋白表达升高,Bax蛋白表达降低,差异有统计学意义(P<0.05或P<0.01);AKT和ERK1/2在所有组内差异均无统计学意义(P>0.05);上述指标尼可地尔组和安五脂素低剂量组差异无统计学意义(P>0.05);p-AKT、p-AKT/AKT、p-ERK1/2和p-ERK1/2/ERK1/2水平、Bcl-2安五脂素3个剂量组呈剂量依赖性。详见图5、表4。
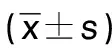
表4 各组大鼠心肌组织AKT、ERK1/2、Bcl-2、Bax蛋白表达及p-AKT、p-ERK1/2水平
3 讨 论
心肌缺血再灌注损伤的病理机制主要包含自由基损伤、细胞凋亡、钙超载和血管内皮损伤等[11]。目前,临床治疗主要包含缺血前治疗和缺血后治疗[12],虽然具有显着疗效,然而因无法预知急性或意外心肌梗死,所以使得当前治疗具有局限性,故寻找更加高效合理的治疗方式对于心肌缺血再灌注损伤治疗具有重要意义。
本研究结果显示,与假手术组比较,模型组大鼠心肌缺血后心电图S-T段明显抬高,再灌注后抬高的S-T段回落,与既往研究[13]模型构建结果一致,证明本研究模型构建成功。有研究报道S-T段抬高型心肌梗死病人中早期应用尼可地尔可降低再灌注损伤的发生率[14],故本研究选取尼可地尔作为阳性药物,确保研究的准确性和严谨性。本研究结果显示,与假手术组比较,模型组CK和LDH含量、AN/LV、心肌细胞凋亡率升高,心肌细胞边缘基本消失,纹理变乱,明显存在红细胞进入现象;与模型组比较,尼可地尔组和安五脂素3个剂量组CK和LDH含量、AN/LV均不同程度降低,心肌细胞损伤逐渐减轻,细胞逐渐变完整,细胞边界逐渐变清晰,存在的红细胞逐渐减少,心肌细胞凋亡率减少,证明安五脂素可有效下调CK和LDH含量,减少心肌梗死面积,抑制心肌细胞凋亡,改善心肌组织损伤病理情况。有报道指出安五脂素可促进细胞抗凋亡蛋白Bcl-2表达,抑制促凋亡蛋白Bax表达,抑制肝组织损伤[15],据此推测安五脂素可能通过调控Bcl-2和Bax表达,抑制心肌缺血再灌注损伤。
本研究结果显示,与假手术组比较,模型组AKT和ERK1/2 mRNA、Bcl-2mRNA和蛋白表达、p-AKT、p-AKT/AKT、p-ERK1/2和p-ERK1/2/ERK1/2水平降低,Bax mRNA和蛋白表达上升;与模型组比较,尼可地尔组和安五脂素3个剂量组AKT和ERK1/2 mRNA、Bcl-2 mRNA和蛋白表达、p-AKT、p-AKT/AKT、p-ERK1/2和p-ERK1/2/ERK1/2水平上升,Bax mRNA和蛋白表达下降。分析结果表明安五脂素可促进AKT和ERK1/2 mRNA、Bcl-2表达,上调p-AKT、p-AKT/AKT、p-ERK1/2和p-ERK1/2/ERK1/2水平,抑制Bax表达发挥保护作用。RISK通路主要由磷脂酰肌醇-3-激酶(PI3K)/AKT和ERK1/2组合而成,两条通路的激活可减小心肌梗死面积。已有研究证明缺血前适应以及缺血后适应均可激活RISK通路,在保护心肌缺血再灌注损伤中发挥重要作用[16-17]。AKT磷酸化后被激活,向下游传递信号,调节生命过程;ERK有两个亚型,ERK1和ERK2,有研究表明当机体受到心肌缺血再灌注损伤刺激时p-AKT和p-ERK在该过程发挥重要作用[18]。心肌缺血再灌注损伤引发心肌细胞死亡,抑制心肌细胞凋亡可减轻心肌缺血再灌注损伤[19]。Bcl-2和Bax分别为抗凋亡蛋白和促凋亡蛋白,两者均为AKT和ERK1/2信号通路的下游分子,在线粒体介导的细胞凋亡过程中发挥重要的调控作用[20]。Yi等[21]指出下调p-AKT水平可促进心肌缺血再灌注损伤,而促进Bcl-2表达、抑制Bax表达可抑制细胞凋亡发挥对心肌缺血再灌注损伤的保护作用;李雯娜等[22]指出上调p-AKT和p-ERK1/2水平可减轻心肌缺血再灌注损伤;孔嫦娥等[23]研究显示上调p-AKT和p-ERK1/2水平可减轻心肌缺血再灌注损伤。本研究与前述研究结果一致,提示安五脂素可能通过促进AKT、ERK1/2表达,上调p-AKT、p-ERK1/2水平,促进Bcl-2表达,抑制Bax表达发挥保护作用。
综上所述,安五脂素可抑制心肌缺血再灌注损伤,可能通过调节RISK信号通路,促进AKT和ERK1/2表达,上调p-AKT和p-ERK1/2水平,促进Bcl-2表达,抑制Bax表达发挥保护作用,安五脂素可通过调控RISK信号通路抑制心肌缺血再灌注损伤。



