刘嘉欣,杨五小
摘要综述RNA结合蛋白的生物学意义,重点介绍其在心房颤动、急性冠脉综合征及特殊类型心脏病方面的作用机制及研究进展,展望RNA结合蛋白转导蛋白β样蛋白2在心肌梗死疾病中的作用。
关键词心血管疾病;RNA结合蛋白;转导蛋白β样蛋白2;心肌梗死;综述
doi:10.12102/j.issn.1672-1349.2024.08.015
随着我国社会经济不断发展及城镇化进程不断加速,人民的生活方式发生了很大的变化,心血管疾病危险因素也日渐增加,因此,心血管疾病的发病率呈逐渐升高的态势。据《中国心血管健康与疾病报告2021》报道,我国因心血管疾病死亡人数分别占农村和城市死亡人数的46.7%和44.3%[1]。尽管心血管疾病的诊疗方法和技术已有很大进展,但目前仍未见到心血管疾病发病率的拐点,这已经成为我国重大的公共卫生问题[1]。因此,提高心血管疾病的预防、治疗以及改善其预后是当务之急。在心血管疾病分子机制的研究中,RNA结合蛋白(RNA-binding proteins,RBPs)的作用越来越被关注。RBPs能够调节基因表达[2],与心血管系统的发育及心血管疾病的发生发展密切相关,如RBPs中的RBM20(RNA结合基序蛋白20)和RBM24(RNA基序结合蛋白24),就已被证明在心脏发育中发挥着重要作用[3-4]。因此,找寻RBPs在心血管疾病发生发展过程中的作用靶点,对心血管疾病靶向治疗方案的研发至关重要。
1RBPs概述
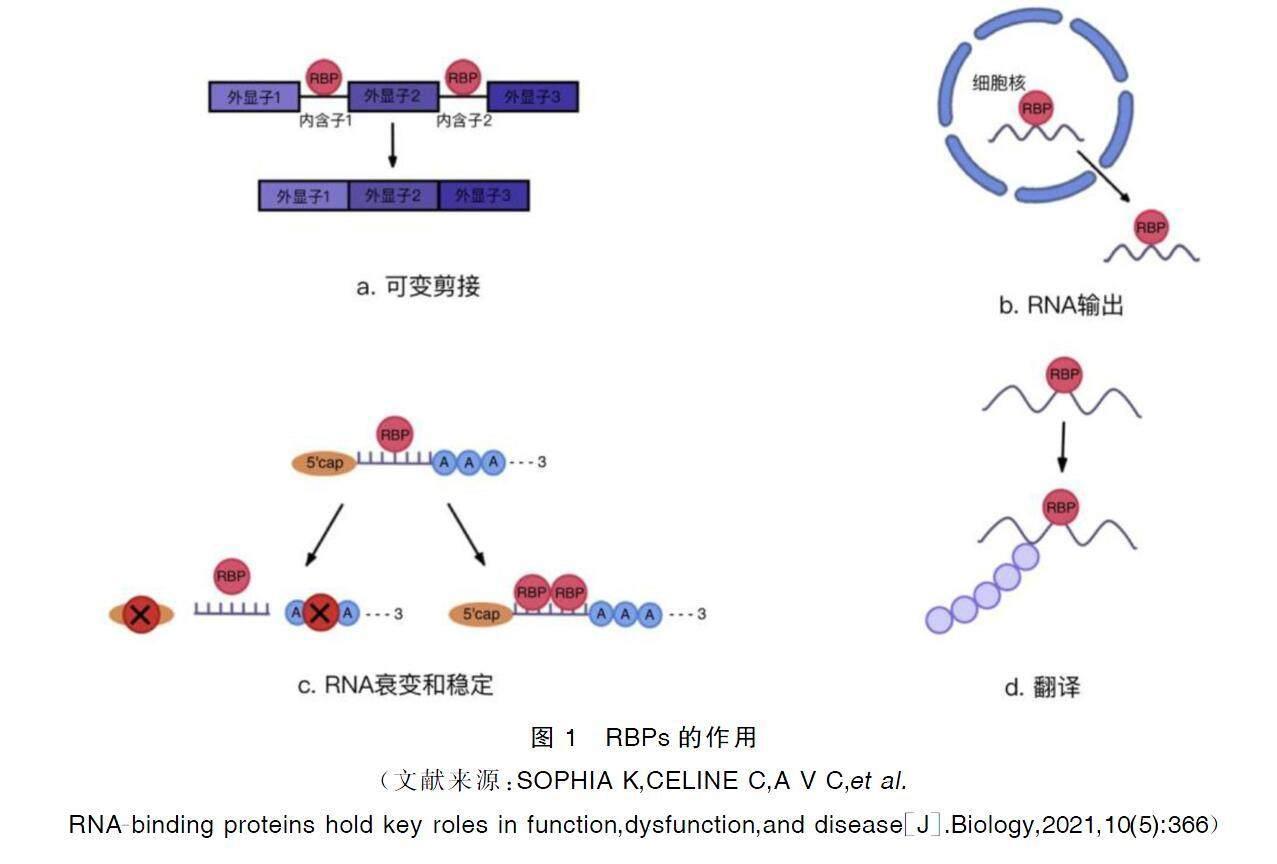
RBPs是一类能够特异性识别和结合RNA分子的蛋白质的总称[5],其通常通过一个或多个RNA结构域,包括RNA的编码区(内含子和外显子)、5′非翻译区(5′UTR)和3′非翻译区(3′UTR)与RNA结合[6-7],参与RNA的可变剪接、RNA输出、RNA稳定与衰变以及翻译后修饰等过程[8-9](见图1)。RBPs可以与编码区内的可变剪接位点相结合来促进可变剪接。RBPs也可以与3′UTR结构域相互作用诱导或抑制RNA衰变,并且可以介导RNA稳定;而缺乏结合3′UTR结构域靶点的RBPs会破坏RNA的稳定性[10]。此外,mRNA成熟的关键是在5′端加“帽”结构和在3′端加多腺苷酸(poly-A)尾;而RBPs可以通过去帽酶去除5′-帽结构,并通过去氨基化酶去除3′poly-A尾部,进而启动RNA降解和RNA衰变[11]。
在人类基因组中,至少有1 200个经过验证的RBPs以及一些新发现的RBPs[12],这些RBPs可参与多种重要的生理和病理过程。例如,RNA结合基序单链相互作用蛋白1(Rbms1)在大脑皮层发育过程中促进神经元的分化和放射状迁移[13];DEAD box RNA解旋酶-5(DDX5)通过干预肠道tuft细胞的功能来调节肠道的微生物菌群和疾病易感性[14]。HuD蛋白通过抑制哺乳动物雷帕霉素靶蛋白1(mTORC1)的活性和提高ADP核糖基化因子样6相互作用蛋白1(ARL6IP1)的水平来促进细胞自噬和肿瘤应激生存[15]。此外,有文献报道,异常生成或缺失的RBPs与心血管疾病的发生发展也密切相关。
2RNAs与心血管疾病
2.1心房颤动
心房颤动是临床上最常见的快速性心律失常,其发生增加了心脑血管疾病的发病率和死亡率[16]。目前,人们对心房颤动的发生机制尚不完全清楚。研究表明,RBPs对心肌细胞离子通道有调节作用[17],因此推测RBPs可能参与心房颤动的发生发展。冷诱导RNA结合蛋白(cold-inducible RNA-binding protein,CIRP)是一种可以在低温环境中被诱导表达的RBPs[18],其能够靶向作用于心房肌细胞的离子通道从而诱导心房颤动发生。Xie等[19]构建了CIRP敲除的大鼠模型,经刺激后可诱发心房颤动,通过外部程控心房内起搏评估心房有效不应期(AERP)和心房颤动敏感性,发现CIRP缺失可以使AERP缩短,并使心房颤动敏感性增强,这与Brundel等[20]研究所得AERP缩短可诱发心房颤动的结论一致。为了深入了解CIRP对心房颤动的作用机制,Xie等[19]通过蛋白质免疫印迹法(Western Blot)检测发现CIRP敲除的大鼠模型中,超快速延迟整流电流(IKur)和瞬时外向电流(Ito)增加,并且IKur和Ito相对应的电压依赖型钾通道1.5(Kv1.5)和电压依赖型钾通道4.2/4.3(Kv4.2/4.3)的通道蛋白表达显着增加。这一研究表明,CIRP缺失可上调Kv1.5和Kv4.2/4.3通道蛋白的表达来调节心房电活动,从而诱发心房颤动。因此,CIRP有望成为心房颤动治疗的新靶点。
QKI(quaking protein)是一种RBPs,属于进化上保守的信号转导与 RNA活化蛋白(STAR)家族[21],其有望成为心房颤动治疗的新靶点。目前的研究认为,炎症与心房颤动的关系密切[22],多种炎性细胞如中性粒细胞、巨噬细胞等在心房颤动病人心房组织中的浸润增加[23-24]。孙泽玮等[25]研究发现心房颤动病人心房组织中的巨噬细胞为促炎型,心房肌细胞快速起搏可以诱导促炎型巨噬细胞极化。随后将HL-1细胞与脂多糖(LPS)刺激的巨噬细胞共同培养,发现心房肌细胞L型离子通道α1C亚基基因(CACNA1C)表达受到抑制,而白细胞介素-1β(IL-1β)敲除的巨噬细胞组抑制了这一过程,这表明IL-1β可以使CACNA1C表达下调,从而减少心房肌细胞L型离子通道的表达。Tili等[26]发现LPS刺激抑制QKI的表达,而敲低QKI可以增加IL-1β的表达,孙泽玮[25]在上述实验过程中也观察到了这一现象;同时还发现了敲除QKI能下调CACNA1C表达,因此推测促炎型巨噬细胞能够分泌IL-1β来抑制心房肌细胞中QKI的表达,从而下调CACNA1C表达,使心房肌细胞L型离子通道减少;而L型离子电流减少会下调动作电位时程,缩短有效不应期,诱发心房颤动。
2.2急性冠脉综合征(ACS)
急性冠脉综合征是一种严重危及生命的心血管疾病[27],通常由冠状动脉粥样斑块破裂或糜烂引起,而动脉粥样斑块形成是由于平滑肌细胞异常增殖并向血管内膜迁移导致的[28]。因此,血管平滑肌细胞增殖和迁移是急性冠脉综合征的病理基础。Lin28是存在于真核生物中的一种保守的RBPs,万树威等[29]构建了大鼠静脉移植模型,发现涂抹Lin28-shRNA凝胶慢病毒组的移植静脉内膜厚度相较于其他对照组明显降低,这表明降低Lin28的表达可以抑制血管内膜平滑肌细胞的增殖和迁移。Brennan等[30]发现糖尿病动脉粥样硬化小鼠的主动脉中Lin28表达增加,而let-7表达降低。进一步细胞实验表明,促细胞分裂素血小板衍生生长因子(platelet derived growth factor,PDGF)处理后的平滑肌细胞中let-7表达减少;而沉默Lin28后,平滑肌细胞中PDGF受体表达减少。由此推断Lin28能够上调PDGF受体表达水平,抑制let-7的生成,进而促进平滑肌细胞的增殖和迁移,导致冠状动脉粥样硬化发生。此外,Lin28在心肌梗死中也发挥着作用。Hao等[31]发现在小鼠心肌梗死模型中,高表达的Lin28可以抑制心肌梗死后的心室重构、心功能障碍以及心肌肌钙蛋白I(cTnI)和肌酸激酶同工酶(CK-MB)的释放,并且抑制白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的表达水平。进一步研究发现,敲除沉默信息调节因子1(Sirt1)基因后,高表达的Lin28则不能抑制心肌梗死后心室重构、心功能障碍及cTnI和CK-MB的释放。因此,推测Lin28能够调控Sirt1的表达,减少心肌梗死后心肌损伤标志物的释放,改善心肌梗死后的心功能,从而起到保护心肌梗死后心脏的作用。
CIRP与冠状动脉狭窄程度密切相关,对急性冠脉综合征有较好的预测与诊断价值[32]。有研究表明,炎症与急性冠脉综合征发生有关,如IL-6可诱导白细胞黏附,使斑块处纤维帽变薄,斑块的稳定性下降并出现裂隙,最终导致斑块破裂和血栓形成[33-34];而CIRP可以直接上调炎性因子IL-6的表达[35]。有研究者测定了急性冠脉综合征病人血清中CIRP、IL-6的浓度,发现二者的表达呈正相关,因此,推测在心肌急性缺血、缺氧时,心肌细胞会大量产生CIRP进而上调IL-6的表达,然后二者分泌到细胞外并释放入血,由此可在一定程度上反映急性冠脉综合征病人冠状动脉狭窄的程度[32-34]。
2.3特殊类型心脏病
心肌致密化不全(noncompaction of the ventricular myocardium)是胚胎发育过程中心肌致密化失败所致的一种特殊类型心肌病。研究表明,胚胎鼠心肌细胞表现为单核和二倍体,具有高度增殖性,而出生后不久的小鼠心肌细胞就退出细胞周期,变成双核和多倍体,失去增殖能力,这与心脏没有再生能力相吻合[36-37]。Gan等[38]研究发现RBPs RBPMS缺失可导致心脏发育过程中心肌细胞胞质分裂失败,心肌细胞过早出现细胞周期停滞,形成双核和多倍体,从而使心肌细胞数量减少,导致心肌致密化不全。Soonpaa等[39]发现长型Pdlim5在心脏发育过程中高度表达,在出生后逐渐减少,而短型Pdlim5开始显着增加,二者转换的时间与心肌细胞双核化开始的时间一致。Gan等[38]通过RNA测序发现,RBPMS通过剪接出Pdlim5的外显子8来抑制短型Pdlim5,以维持长型Pdlim5在胚胎心肌细胞中的表达;而RBPMS的缺失导致短型Pdlim5的异常积累,其直接抑制心肌细胞胞质分裂,从而减少心肌细胞数量,导致心肌致密化不全。这一研究表明心肌致密化不全的发生与RBPMS缺失密切相关。
左心发育不全综合征(hypoplastic left heart syndrome,HLHS)是心血管系统发育不良所致的先天性心血管畸形,其发生与RBFOX2的基因功能缺失密切相关[40]。RBFOX2是一种RBPs,Verma等[41]构建了RBFOX2敲除小鼠模型,发现在这些小鼠胚胎中卵黄囊脉管系统出现异常,并且观察到这些小鼠的心脏未能显示4个心腔;之后进行RNA测序发现,RBFOX2敲除可以影响Rho GTP酶的表达,使细胞周期停滞,内皮细胞向肌成纤维细胞、平滑肌细胞等细胞转化受到影响。而在HLHS中也同样存在这些发育缺陷,这表明RBFOX2与HLHS之间存在一定的联系。
3展望
目前一系列研究结果表明RBPs参与了多种心血管疾病的发生发展,但仍未完全阐明心血管疾病复杂的发病机制,更多的RBPs在心血管系统中的作用机制亟需进一步研究。例如,RBPs中的TBL2是一种内质网定位蛋白,由N端跨膜区和C端WD40结构域组成,其可以与移行上皮反应基因1(TERE1)相互作用,调控跨膜电位、活性氧/活性氮(ROS/RNS)和SXR基因[42],也可以通过WD40结构域与60S核糖体亚基相关联[43]。此外,TBL2也是一种内质网应激蛋白激酶R样内质网激酶(PERK)结合蛋白,而PERK对于细胞在内质网应激条件下的生存非常重要,TBL2通过与PERK结合,在内质网应激过程中调控细胞生存[44];并且在缺氧条件下,TBL2可以调控激活转录因子4(ATF4)的翻译影响细胞生长[45-46];其次,TBL2基因的甲基化可以通过激活PERK-TBL2-eIF2α-ATF4通路来影响脂代谢[47-48]。而在心肌梗死后内质网持续或过强的应激会引起心肌损伤,最终发生心力衰竭[46];此外,脂代谢异常是动脉粥样硬化的关键,而动脉粥样硬化是心肌梗死的基础。因此,TBL2是否可能通过调控下游基因在心肌梗死中发挥作用将是下一步研究的方向。
参考文献:
[1]《中国心血管健康与疾病报告》编写组.《中国心血管健康与疾病报告2021》要点解读[J].中国心血管杂志,2022,27(4):305-318.
[2]STEFANIE G,MARKUS H,THOMAS T.A census of human RNA-binding proteins[J].Nature Reviews Genetics,2014,15(12):829-845.
[3]LENNERMANN D,BACKS J,VAN DEN HOOGENHOF M M G.New Insights in RBM20 cardiomyopathy[J].Current Heart Failure Reports,2020,17(5):234-246.
[4]ZHANG M,ZHANG Y H,XU E S,et al.Rbm24,a target of p53,is necessary for proper expression of p53 and heart development[J].Cell Death and Differentiation,2018,25(6):1118-1130.
[5]HENTZE M W,CASTELLO A,SCHWARZL T,et al.A brave new world of RNA-binding proteins[J].Nature Reviews Molecular Cell Biology,2018,19(5):327-341.
[6]MARTIN K C,EPHRUSSI A.mRNA localization:gene expression in the spatial dimension[J].Cell,2009,136(4):719-730.
[7]RICHTER J D,KLANN E.Making synaptic plasticity and memory last:mechanisms of translational regulation[J].Genes & Development,2009,23(1):1-11.
[8]LIU-YESUCEVITZ L,BASSELL G J,GITLER A D,et al.Local RNA translation at the synapse and in disease[J].Journal of Neuroscience,2011,31(45):16086-16093.
[9]SOPHIA K,CELINE C,A V C,et al.RNA-binding proteins hold key roles in function,dysfunction,and disease[J].Biology,2021,10(5):366.
[10]MOORE K S,VON LINDERN M.RNA binding proteins and regulation of mRNA translation in erythropoiesis[J].Frontiers in Physiology,2018,9:910.
[11]DHATARIYA K.Diabetes:the place of new therapies[J].Therapeutic Advances in Endocrinology and Metabolism,2019,10:204201881880759.
[12]QUATTRONE A,DASSI E.The Architecture of the human RNA-Binding protein regulatory network[J].Science,2019,21(C):706-719.
[13]HABIB K,BISHAYEE K,KANG J,et al.RNA binding protein Rbms1 enables neuronal differentiation and radial migration during neocortical development by binding and stabilizing the RNA message for Fr3a[J].Molecules and Cells,2022,45(8):588-602.
[14]LONG T Y,ABBASI N,HERNANDEZ J E,et al.RNA binding protein DDX5 directs tuft cell specification and function to regulate microbial repertoire and disease susceptibility in the intestine[J].Gut,2022,71(9):1790-1802.
[15]BISHAYEE K,HABIB K,NAZIM U M D,et al.RNA binding protein HuD promotes autophagy and tumor stress survival by suppressing mTORC1 activity and augmenting ARL6IP1 levels[J].Journal of Experimental & Clinical Cancer Research,2022,41(1):18.
[16]BURSTEIN B,NATTEL S.Atrial fibrosis:mechanisms and clinical relevance in atrial fibrillation[J].Journal of the American College of Cardiology,2008,51(8):802-809.
[17]LI J,XIE D Y,HUANG J,et al.Cold-inducible RNA-binding protein regulates cardiac repolarization by targeting transient outward potassium channels[J].Circulation Research,2015,116(10):1655-1659.
[18]LIAO Y,TONG L,TANG L,et al.The role of cold-inducible RNA binding protein in cell stress response[J].International Journal of Cancer,2017,141(11):2164-2173.
[19]XIE D Y,GENG L,WANG S,et al.Cold-inducible RNA-binding protein modulates atrial fibrillation onset by targeting multiple ion channels[J].Heart Rhythm,2020,17(6):998-1008.
[20]BRUNDEL B J,VAN GELDER I C,HENNING R H,et al.Ion channel remodeling is related to intraoperative atrial effective refractory periods in patients with paroxysmal and persistent atrial fibrillation[J].Circulation,2001,103(5):684-690.
[21]陈锴,宋峣,张幼怡.STAR 蛋白及其成员QKI的结构及功能[J].生理科学进展,2003,34(4):347-349.
[22]GLCK T,ALTER P.Omega-3 highly unsaturated fatty acids and arrhythmia risk[J].Journal of the American College of Cardiology,2015,65(12):1267-1268.
[23]FRIEDRICHS K,ADAM M,REMANE L,et al.Induction of atrial fibrillation by neutrophils critically depends on CD11b/CD18 integrins[J].PLoS One,2014,9(2):e89307.
[24]YAMASHITA T,SEKIGUCHI A,IWASAKI Y K,et al.Recruitment of immune cells across atrial endocardium in human atrial fibrillation[J].Circulation Journal,2010,74(2):262-270.
[25]孙泽玮.巨噬细胞与心房肌细胞交互作用在房颤发生和发展中的作用及机制研究[D].杭州:浙江大学,2017.
[26]TILI E,CHIABAI M,PALMIERI D,et al.Quaking and miR-155 interactions in inflammation and leukemogenesis[J].Oncotarget,2015,6(28):24599-24610.
[27]WANG L,JIN Y.Noncoding RNAs as biomarkers for acute coronary syndrome[J].BioMed Research International,2020,2020:1-11.
[28]刘峰涛,于紫英.血管平滑肌细胞与动脉粥样硬化斑块稳定性的研究进展[J].中国心血管杂志,2021,26(3):299-302.
[29]万树威,曹辉,李楠,等.Lin28a对大鼠移植静脉内膜增生影响的实验研究[J].中华血管外科杂志,2020,5(3):202-205.
[30]BRENNAN E,WANG B,MCCLELLAND A,et al.Protective effect of let-7 miRNA family in regulating inflammation in diabetes-associated atherosclerosis[J].Diabetes,2017,66(8):2266-2277.
[31]HAO Y,LU Q,YANG G,et al.Lin28a protects against postinfarction myocardial remodeling and dysfunction through Sirt1 activation and autophagy enhancement[J].Biochemical and Biophysical Research Communications,2016,479(4):833-840.
[32]潘颖,戴力.冷诱导RNA结合蛋白与冠心病病人冠状动脉狭窄程度的相关性[J].安徽医药,2021,25(2):308-312.
[33]GAGER G M,BIESINGER B,HOFER F,et al.Interleukin-6 level is a powerful predictor of long-term cardiovascular mortality in patients with acute coronary syndrome[J].Vascular Pharmacology,2020,135:106806.
[34]左广锋,谢浩,任晓敏,等.急性冠状动脉综合征患者血清冷诱导RNA结合蛋白的表达及其临床意义[J].江苏医药,2021,47(10):1051-1053.
[35]AZIZ M,BRENNER M,WANG P.Extracellular CIRP(eCIRP) and inflammation[J].Journal of Leukocyte Biology,2019,106(1):133-146.
[36]GAN P H,PATTERSON M,SUCOV H M.Cardiomyocyte polyploidy and implications for heart regeneration[J].Annual Review of Physiology,2020,82:45-61.
[37]PORRELLO E R,MAHMOUD A I,SIMPSON E,et al.Transient regenerative potential of the neonatal mouse heart[J].Science,2011,331(6020):1078-1080.
[38]GAN P H,WANG Z N,MORALES M G,et al.RBPMS is an RNA-binding protein that mediates cardiomyocyte binucleation and cardiovascular development[J].Developmental Cell,2022,57(8):959-973.
[39]SOONPAA M H,KIM K K,PAJAK L,et al.Cardiomyocyte DNA synthesis and binucleation during murine development[J].The American Journal of Physiology,1996,271(5 Pt 2):H2183-2189.
[40]MCKEAN D M,HOMSY J,WAKIMOTO H,et al.Loss of RNA expression and allele-specific expression associated with congenital heart disease[J].Nature Communications,2016,7(1):12824.
[41]VERMA S K,DESHMUKH V,THATCHER K,et al.RBFOX2 is required for establishing RNA regulatory networks essential for heart development[J].Nucleic Acids Research,2022,50(4):2270-2286.
[42]FREDERICKS W J,MCGARVEY T,WANG H Y,et al.The TERE1 protein interacts with mitochondrial TBL2:regulation of trans-membrane potential,ROS/RNS and SXR target genes[J].Journal of Cellular Biochemistry,2013,114(9):2170-2187.
[43]TSUKUMO Y,TSUKAHARA S,FURUNO A,et al.The endoplasmic reticulum-localized protein TBL2 interacts with the 60S ribosomal subunit[J].Biochemical and Biophysical Research Communications,2015,462(4):383-388.
[44]TSUKUMO Y,TSUKAHARA S,FURUNO A,et al.TBL2 is a novel PERK-binding protein that modulates stress-signaling and cell survival during endoplasmic reticulum stress[J].PLoS One,2014,9(11):e112761.
[45]TSUKUMO Y,TSUKAHARA S,FURUNO A,et al.TBL2 associates with ATF4 mRNA via its WD40 domain and regulates its translation during ER stress[J].Journal of Cellular Biochemistry,2016,117(2):500-509.
[46]HU J,HUANG C X,RAO P P,et al.microRNA-155 inhibition attenuates endoplasmic reticulum stress-induced cardiomyocyte apoptosis following myocardial infarction via reducing macrophage inflammation[J].European Journal of Pharmacology,2019,857:172449.
[47]刘帅.脂代谢相关基因DNA甲基化与血脂异常及冠心病相关性研究[D].乌鲁木齐:新疆医科大学,2020.
[48]VAN NOSTRAND E L,FREESE P,PRATT G A,et al.A large-scale binding and functional map of human RNA binding proteins[J].Nature,2020,583(7818):711-719.
(收稿日期:2022-12-15)
(本文编辑王雅洁)



