迟淑勋李宏伟赖敏王梁卢玉丽
1泰国孔敬大学联合医学学院(孔敬府孔敬市泰国40000)2赣南师范学院体育学院
运动性中枢疲劳与外周疲劳的生物反馈研究
迟淑勋1,2李宏伟2赖敏2王梁2卢玉丽2
1泰国孔敬大学联合医学学院(孔敬府孔敬市泰国40000)2赣南师范学院体育学院
目的:探讨生物反馈技术复合指标心率变异性(HRV)、表面肌电(sEMG)、皮电及脑电(EEG)在运动性中枢疲劳与外周疲劳发生时的变化规律,阐明中枢疲劳、外周疲劳包括心肌疲劳之间的关系及可能存在的时序关系。方法:随机选择大学生运动员16名,分为男子组、女子组。采用Bruce方案,以跑台运动的方式,使运动员逐步达到深度疲劳。同时记录即刻心率、反应时、RPE,以确定中枢、外周与心肌疲劳的产生。自身前后对照与男女比较生物反馈技术复合指标在安静、疲劳、恢复时的不同变化特点,同时建立安静、疲劳、恢复的时序特征图。结果:疲劳时当HRV指数显着下降,HRV时域指标(SDNN、RMSSD、PNN50)、频域指标(LF功率值、HF功率值、LFHF)及窦性心律不齐上升时,其sEMG振幅指标(IEMG、RMS)上升,频率指标(MPF、MF)下降;其皮电SCL值男子下降,女子上升;其EEG各脑波(α波、β波、SMR波、θ波)功率谱显着上升。生物反馈技术建立的运动性疲劳时序特征图,显示疲劳的时序为:心肌(HRV)→骨骼肌(sEMG)→脑(EEG)。结论:生物反馈技术可以实现运动性中枢疲劳与外周疲劳的联合监控,并可为运动性中枢疲劳与外周疲劳描绘出程序图。
生物反馈技术;运动性疲劳;心率变异性;脑电图;肌电图;皮肤导电水平
运动性疲劳的时序性问题由于研究方法的限制仍值得探讨。脑电(electroencephalogram,EEG)可反映中枢疲劳,表面肌电(surface electromyography,sEMG)和皮电可反映骨骼肌、皮肤等的外周疲劳,而心率变异性(heart rate variability,HRV)则可一定程度反映心肌疲劳。融合了EEG、sEMG、皮电及HRV等的生物反馈技术(biofeedback technology,BT),以其系统化、集成化、高效精密,无创伤等突出特点,可用于同时评鉴中枢、外周、心肌疲劳出现的先后次序,并建立运动性疲劳时序图。本研究采用实验研究法,探究疲劳时脑电、肌电、皮电及HRV等生物反馈主要指标的变化特征,观察运动性疲劳时序特征,为阐明运动性疲劳的机制及诊断运动性疲劳提供参考。
1 对象与方法
1.1受试者与实验模型的建立
随机选取2012级大学生运动员16名,分为男子组(8名)、女子组(8名),年龄分别为20.00±0.76岁、20.00±0.76岁,身高为1.72±0.04 m、1.61±0.04 m,体重为64.28±5.50 kg、53.20±5.59 kg,运动年限为3.88±1.36年、3.63±1.60年。
正式实验前,实验对象需保证48 h内无失眠、酗酒或任何形式的大负荷训练、比赛,并进行一般医学检查,确保受试者无不适于从事大强度运动的临床医学疾病或运动系统损伤。在多次熟悉运动负荷及实验流程,并详实了解实验可能存在的风险和参与实验可以获得的报酬后,签订知情同意书。
运动方案参照经典的Bruce方案制定[1],即以2.7 km/h的速度,10%的最大坡度开始,每3 min递增一级,递增方式见表1。整个方案共7级,最终将达到最大速度9.6 km/h,坡度22%。
运动中,采用德国产h/p/cosmos pulsar 4.0运动跑台进行运动强度控制。安静及运动时,用芬兰产Suunto远程心率遥测团队系统采集即刻心率、视觉简单反应时(红光)测试反应时、Borg RPE量表测试体力感觉等级,用于疲劳评定。澳大利亚产Schuhfrted生物反馈仪获取安静状态、疲劳状态、以及进行大强度运动后第2天清晨恢复状态下的BT复合指标值。
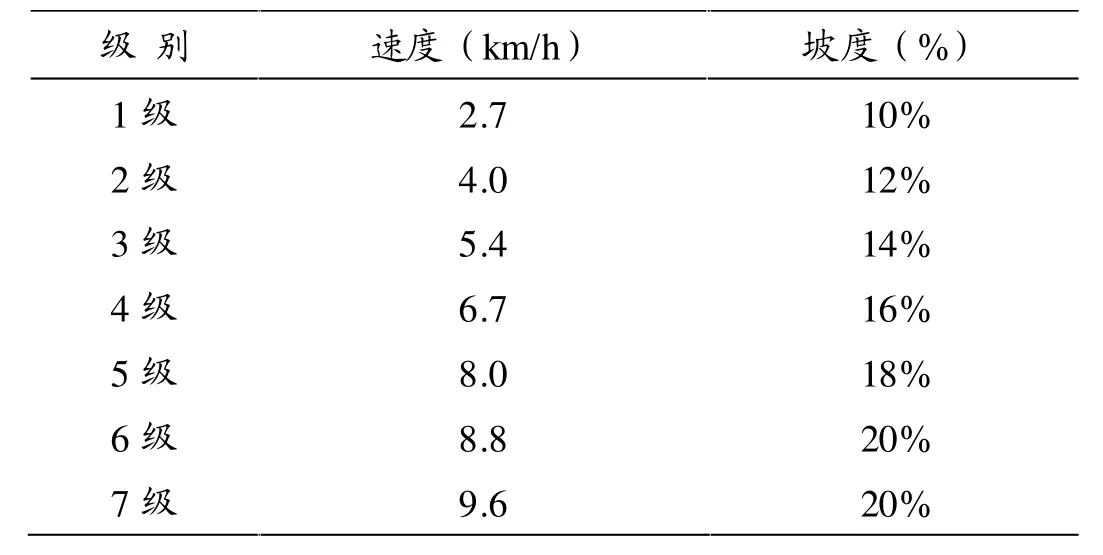
表1 Bruce方案各级运动强度
1.2BT效应指标的选取
HRV生物反馈时域指标:R-R间期的标准差(standard deviation,SDNN)、相邻R-R间期之差的均方根值(root mean square of successive differences,RMSSD)、相邻心搏R-R间期之差值大于50 ms的心搏数占心搏总数的百分比(the percentage of all adjacent NN distances that differ>50 ms from each other,PNN50);频域指标:低频功率值(power low frequency,pLF)、高频功率值(power high frequency,pHF)、低频高频功率比(LFHF)。
心率变异性指数(heart rate variability index,HRV Index)、窦性心律失常(absolute sinus arrhythmia,SAa)。
表面肌电生物反馈振幅指标:积分肌电(integrated electromyography,IEMG)、均方根振幅(root mean square amplitude,RMS);频率指标:平均功率频率(mean power frequency,MPF)、中位频率(median frequency,MF)。
皮电生物反馈指标:皮肤导电水平(skin conductance level,SCL)。
EEG生物反馈指标:α波、β波、SMR波、θ波功率谱。
1.3电极片及传感器的设置
实验中EEG生物反馈电极采用国际10/20系统电极放置法,2导联(双导)电极安置在左右对称的前额。HRV生物反馈的1导联(双导)和EMG生物反馈的2导联(双导)电极以及皮电生物反馈的传感器,则按照仪器自带《生物反馈电极片设置指导手册》,分别选择左侧手掌背面和右侧股直肌、股内侧肌以及右侧中指。
1.4数据及图像处理
采用SPSS 20.0中的单样本t检验分析即刻心率、RPE数据,同时应用相关样本t检验分析安静、疲劳时的反应时数据,用于实验对象疲劳状态的判定。应用单因素方差分析(One-way ANOVA)处理安静、疲劳、恢复状态下生物反馈复合指标数据。实验数据均用平均数±标准差表示,且以P<0.05表示差异具有显着性,P<0.01表示差异具有非常显着性。
使用MATLAB2012b制作分段函数,建立运动性疲劳时序关系图。
1.5运动性疲劳的确定
以反应时、RPE和即刻心率(HR)等指标,作为疲劳判定的依据。实验中,在记录受试者主诉运动感觉的同时,密切观察即刻心率的变化以做出综合判断。运动性疲劳判定的相关指标如表2,从表2可看出,当男子、女子组运动员的即刻心率达到理论最大心率(HRmax,以年龄20为准)的105%~110%时,两组反应时均呈现不同程度的升高,但差异均不显着,不过此时两组RPE却都高于18(很累),且差异显着(P<0.05)。已有研究证实[2,3],心率、反应时、RPE达到或超过一定数值(如心率达到理论最大心率的105%-110%,反应时升高,且RPE达到或超过18),结合运动性疲劳的定义,即可确定运动性疲劳的发生。提示可应用现有数据,论述中枢、外周以及心肌疲劳的相关特征。

表2 疲劳判定指标
2 结果
2.1运动性疲劳的生物反馈技术指标特征性变化
表3显示,与安静状态相比,疲劳状态下男子、女子组HRV Index显着下降(P<0.05)的同时,HRV时域指标SDNN,RMSSD,PNN50和频域指标LFHF、LF功率值、HF功率值及SAa上升,但差异不显着。
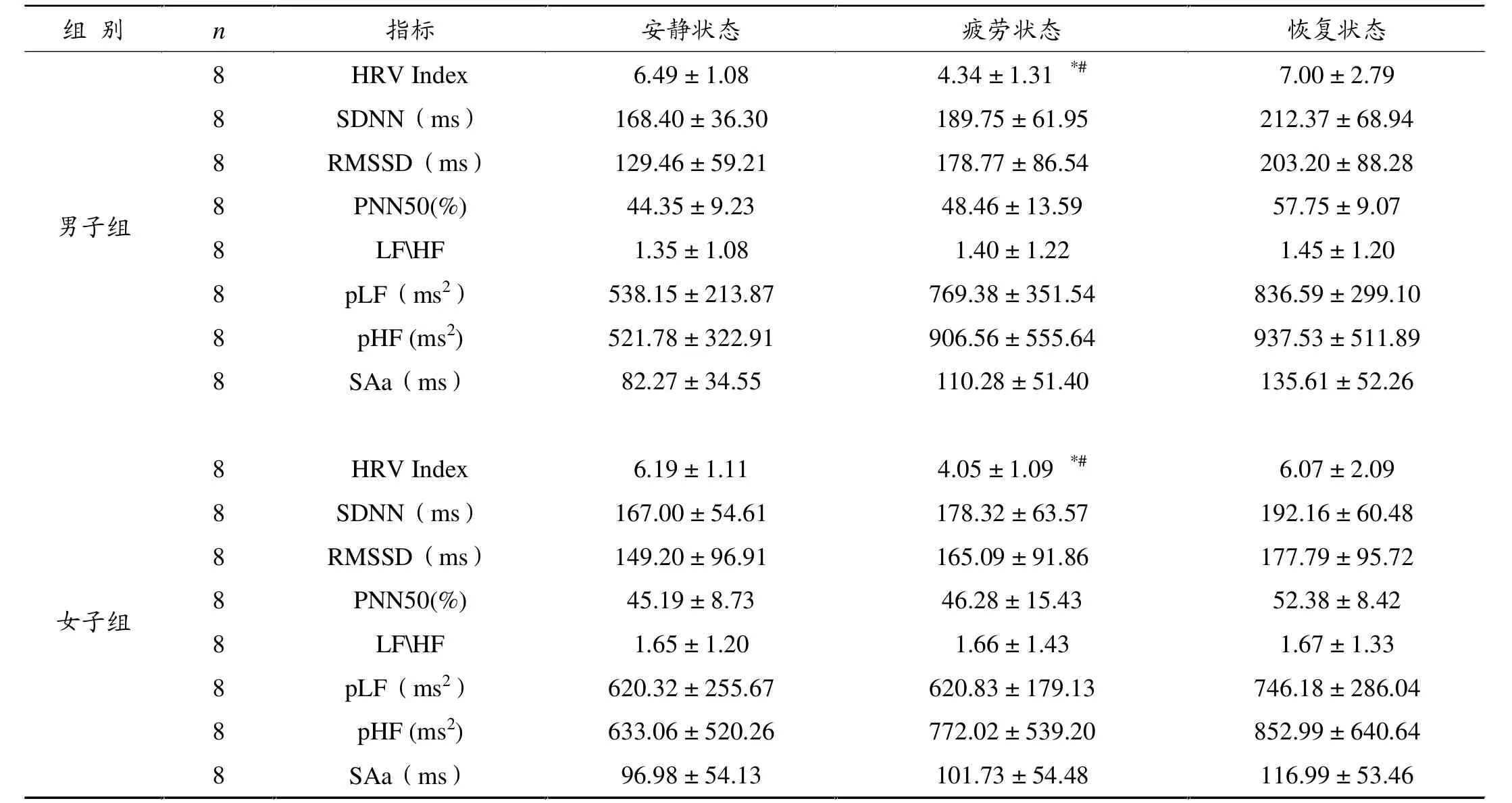
表3 安静、疲劳、恢复状态的HRV生物反馈指标值
表4显示,与安静状态相比,疲劳状态下,男子组IEMG、RMS值呈现不显着上升时,MPF、MF下降,其中MF的下降显着(P<0.05);女子组则疲劳时IEMG、RMS显着升高(P<0.05),MPF、MF下降,其中MPF的下降非常显着(P<0.01)。
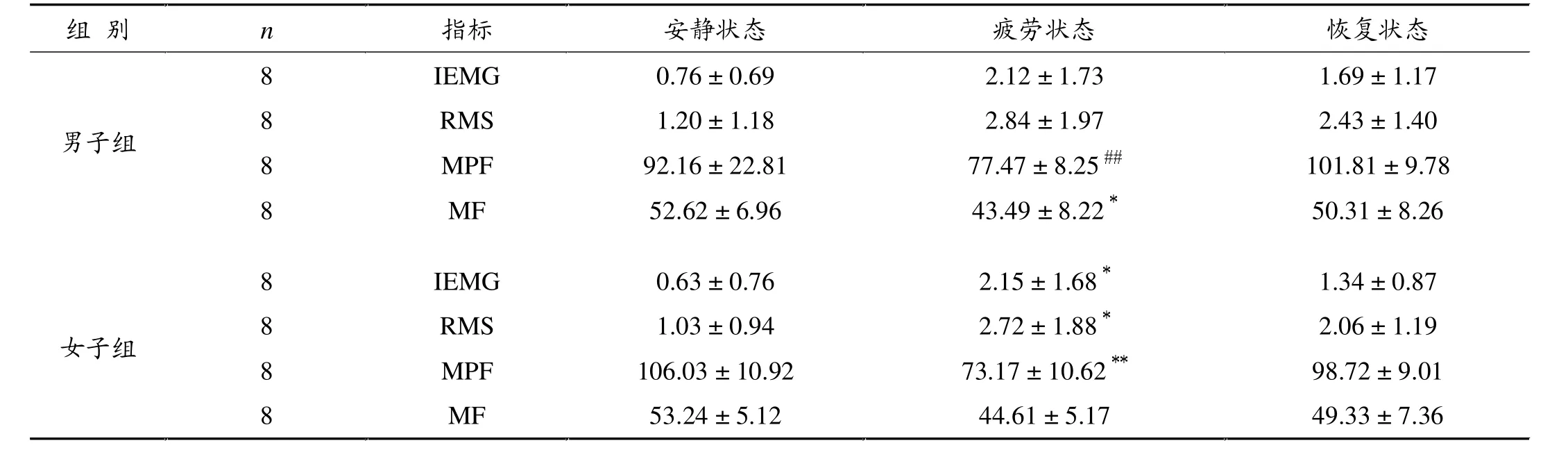
表4 安静、疲劳、恢复状态的sEMG数据值(μV)
表5显示,与安静状态相比,疲劳状态下男子组SCL值非常显着性下降(P<0.01),但女子组非常显着性上升(P<0.01)。

表5 安静、疲劳、恢复状态的皮电SCL值(μS)
表6显示,与安静状态比,疲劳状态下男子、女子组各波功率谱均非常显着升高(P<0.01);与恢复状态比,疲劳状态除女子组SMR波功率谱显着升高(P<0. 05),两组各波功率谱均非常显着性升高(P<0.01)。
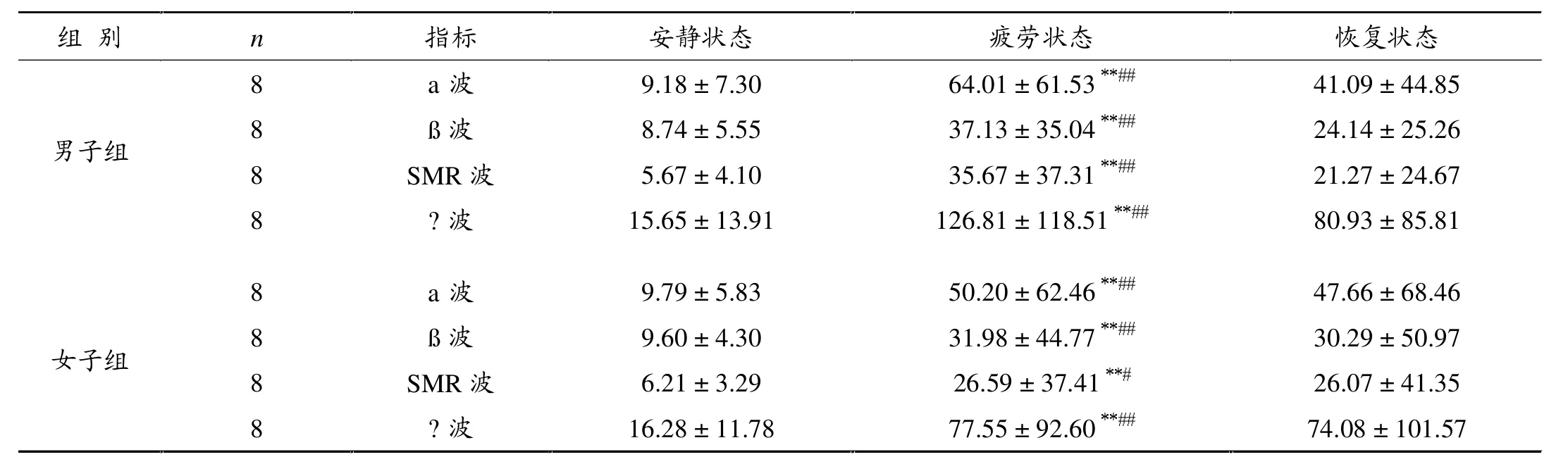
表6 安静、疲劳、恢复状态的EEG生物反馈指标值(μV)
2.2运动性中枢疲劳、外周疲劳及心肌疲劳的时序特点
进入安静、疲劳和恢复时的生物反馈复合指标时序特征见图1、2、3。进入安静状态,皮电起点大约为0 s,之后依次是120 s左右的HRV、180 s左右的sEMG,最后是420 s左右的EEG。故进入安静的时序为:外周皮肤电(SCL)→心肌(HRV)→外周骨骼肌(sEMG)→中枢脑电(EEG)。进入恢复同样为外周皮肤电(SCL)→心肌(HRV)→外周骨骼肌(sEMG)→中枢脑电(EEG)。但进入疲劳,首先是大约1230 s时HRV,之后是1377 s左右的sEMG,紧接着是1407 s的皮电,最后则是1438 s的EEG。故疲劳时的先后次序,转变为心肌(HRV)→外周骨骼肌(sEMG)→外周皮肤电(SCL)→中枢脑电(EEG)。提示生物反馈技术监控的运动性疲劳次序是心肌疲劳→外周疲劳→中枢疲劳。

图1 进入安静生物反馈复合指标时序特征
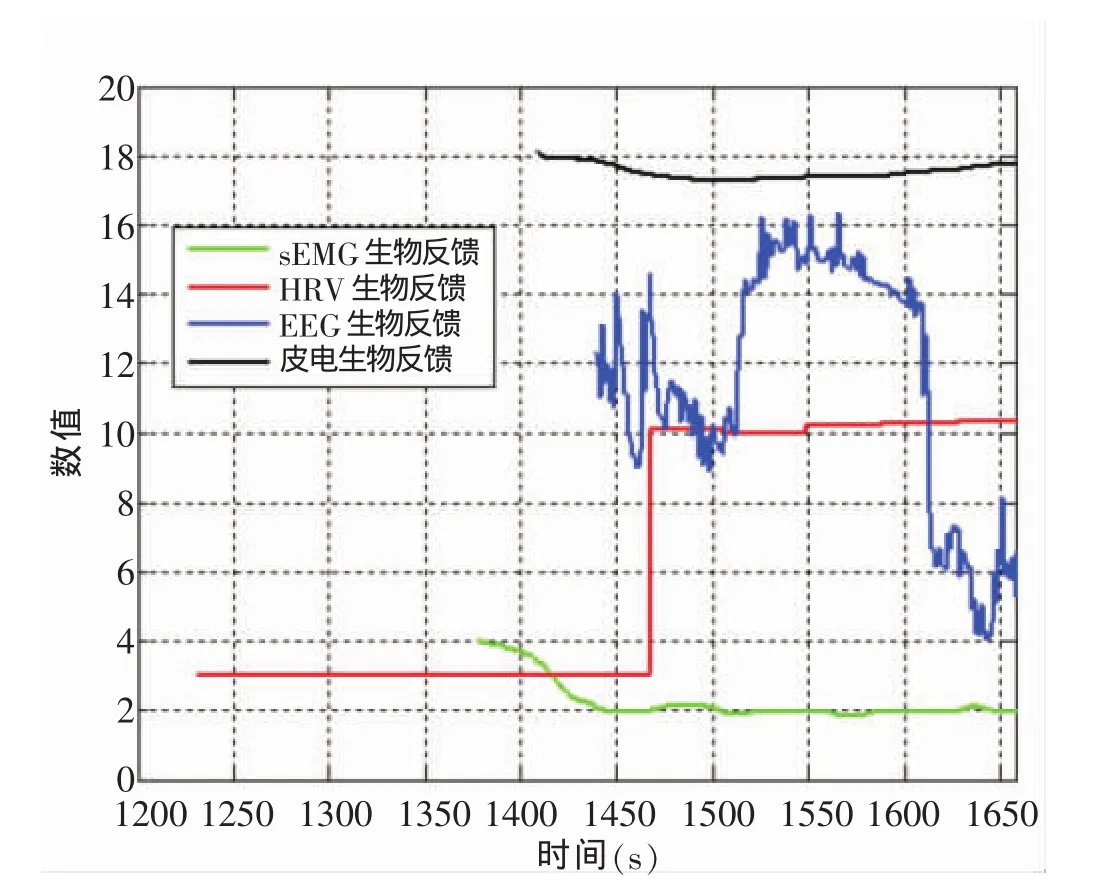
图2 进入疲劳生物反馈复合指标时序特征
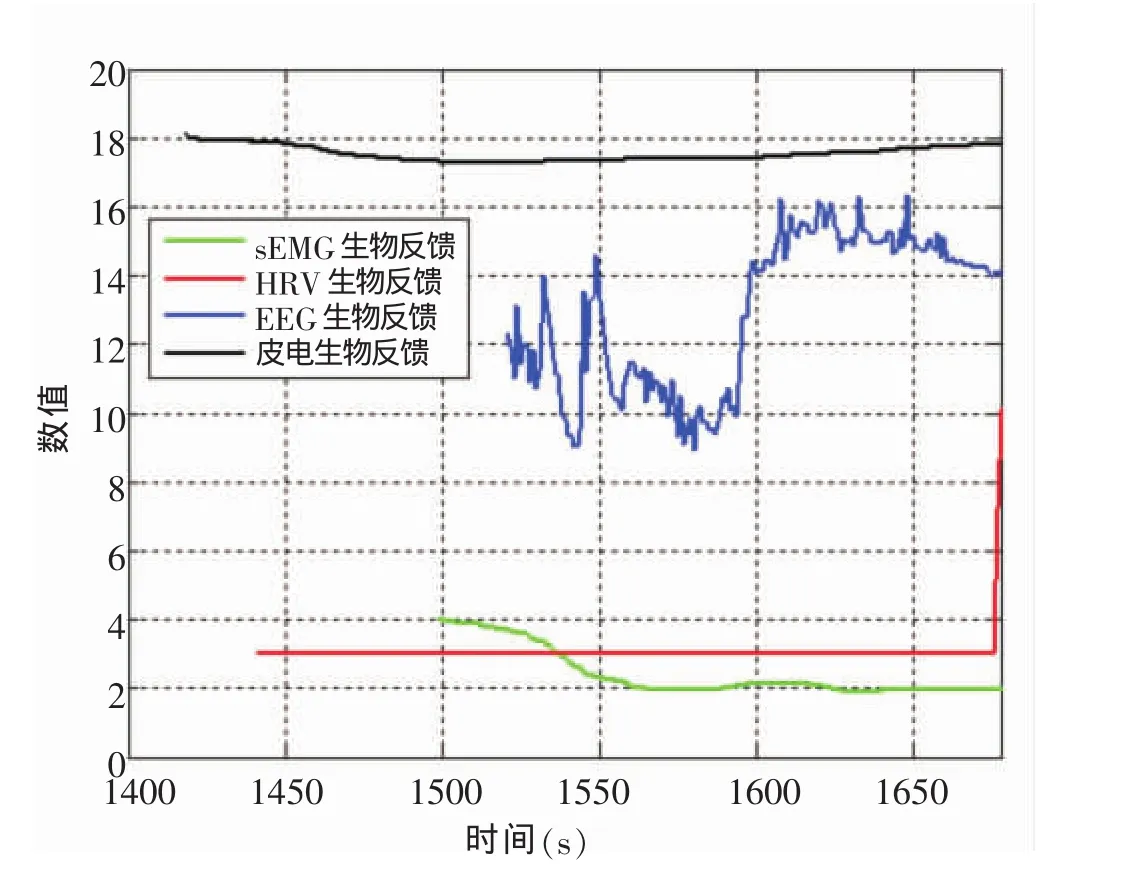
图3 进入恢复生物反馈复合指标时序特征
3 讨论
3.1运动性中枢疲劳与外周疲劳的生物反馈技术指标分析
本研究发生运动性疲劳时,在两组HRV Index显着下降,α波、β波、SMR波、θ波的功率谱显着上升时,男子MF显着下降,女子IEMG、RMS显着上升、MPF显着下降,SCL男子显着上升,女子显着下降。一方面疲劳时EEG生物反馈各脑波功率谱均非常显着上升,这与既往研究有一定差异[4-7],另一方面HRV生物反馈指标仅HRV Index下降,时域指标、频域指标均有上升趋势,这与已有研究存较大差异[8,9]。分析结果可知,生物反馈技术监控疲劳时呈现中枢、外周及性别的特征性变化,提示其应用于运动性疲劳监控时,或不能简单套用分属领域已成熟的评价标准。生物反馈技术监控疲劳时,复合指标具有特征性变化,或存在如下多种机制:①生物反馈技术对多种生物电诊断技术进行了系统化升级,升级过程中进行了某些整合与简化,导致生物反馈复合指标监控疲劳时,具有不同的评价标准。②本研究的运动负荷达到甚至超过100%HRmax,而超负荷运动可能导致血乳酸、肌酐肌酸超限堆积[9],引起终池(SR)中Ca2+大量释放,且回收Ca2+能力急速下降[10],最终导致心肌细胞浆中Ca2+([Ca2+]myo)浓度大幅上升[11],导致心肌Ca2+代谢极度紊乱,引起R-R间期变化,窦性心律不齐增加,导致HRV时域、频域指标上升。心律不齐使心肌骤停风险增加,可能引起前额区大脑皮层的高度警觉,乙酰胆碱大量分泌,β波和SMR波骤升,同时,5-羟色胺(5-HT)、γ-氨基丁酸(GABA)等递质大量分泌[12],引起抑制性脑波α波和θ波表达。此时大脑皮层,可能同时增强了交感神经和迷走神经的张力,导致交感神经控制的汗腺出现功能性紊乱[13],或导致汗腺周围产生某些具有性别差异的代谢产物,引起男、女皮电的不同结果。③深度疲劳时机体产生超量的自由基、脂质过氧化物(LPO)[14],可能引起心肌生物膜通透性改变,细胞外Ca2+内流,线粒体内Ca2+外流,引起线粒体功能极度紊乱,或导致心肌兴奋收缩失偶联[10],窦性心律不齐上升,心率变异大量发生。
3.2运动性中枢疲劳与外周疲劳的生物反馈技术指标时序特点分析
本研究结果显示,生物反馈技术监控下运动性疲劳的发生次序为:心肌疲劳→外周疲劳→中枢疲劳,可能与以下机制有关:①生物反馈技术融合与简化,可能带来新的时序特征。②运动员处于深度疲劳时出现了Ca2+、Na+、K+等离子转运的极度紊乱[15],导致心脏功能下降,从而可能影响骨骼肌血供,减弱甚至阻碍横管活动,抑制肌丝滑行[16],可能反向触发α、γ运动神经元异常放电,引起肌电继发变化。此后,发生异常离子代谢的肌肉组织可能影响汗腺处Ca2+、Na+、K+等离子的代谢。当调控心肌的植物性神经,调控肌肉的脊神经以及调控汗腺活动的交感神经均出现功能紊乱时,脑组织周围或才出现[Pi]myo、ADP、[H]+含量改变及Trp的大量转运。故产生心肌(HRV)→外周骨骼肌(sEMG)→外周皮肤电(SCL)→中枢脑电(EEG)的时序特点。③深度疲劳时,伴随尿素、肌酐肌酸、乳酸和盐类物质等的大量分泌与堆积,以及IgG、IgM、IgA含量的持续下降[17],血浆渗透压、电解质浓度、血液pH值发生变化,血液状态改变可能首先影响心脏。之后影响至骨骼肌,致骨骼肌Ca2+稳定性下降,生物活性物质CaM、cAMP含量改变。接着引起皮肤电反应变化。最后才穿透血脑屏障进入大脑,引起功率谱表达水平的改变。④但深度疲劳时,机体也可超量产生5-HT、GABA等抑制性神经递质[14,18]。其可能不仅作用于中枢,还可作用于α、γ等运动神经元以及肌组织,交感神经、迷走神经甚至是汗腺。故进行大强度运动时,心肌先发生疲劳,而后是骨骼肌、皮肤等外周组织发生疲劳,最后中枢神经系统发生疲劳。
4 小结
生物反馈技术可以实现运动性中枢疲劳与外周疲劳的联合监控,并描绘出运动性中枢疲劳与外周疲劳的时序特征。
[1]Ratter J,Radlinger L,Lucas C.Several submaximal exercise tests are reliable,valid and acceptable in people with chronic pain,fibromyalgia or chronic fatigue:a systematic review[J].J Physiother,2014,60:144-150.
[2]李清正,徐新保,李增民.不同训练周期中运动员疲劳诊断的研究[J].体育科学,2013,38(7):29-33.
[3]谭如坤.运动性疲劳产生机理、监测及恢复方法研究[J].湖北师范学院学报(自然科学版),2013,33(2):60-63.
[4]Krause G,Ullsperger P,Beyer L,et al.Changes in EEG power density spectrum during static muscle work[J].Eur J Appl Physiol Occup Physiol,1983,51(1):61-66.
[5]Nielsen B,Hyldig T,Bidstrup F,et al.Brain activity and fatigue during prolonged exercise in the heat[J].Pflügers Archiv,2001,442(1):41-48.
[6]王霆,王德堃,邓兴国.脑电非线性动力学分析在优秀射箭运动员中枢疲劳研究中的应用[J].体育科学,2010,30(2):64-69.
[7]BaumeisterJ,ReineckeK,SchubertM,etal.Effectsof induced fatigue on brain activity during sensorimotor control[J].Eur J Appl Physiol,2012,112(7):2475-2482.
[8]钟运健.心率变异性(HRV)在运动性疲劳诊断中应用的实验研究[D].南昌,江西师范大学,2004.
[9]朱晓梅,严政,刘凌.女子手球运动员力竭运动后HRV分析[J].体育与科学,2008,29(6):63-64.
[10]许玲.Ca2+,ADP,Pi与运动疲劳[J].北京体育大学学报,2006,29(3):363-365.
[11]Dossett-Mercer J,Green H,Chin ER,et al.Failure of short term stimulation to reduce sarcoplasmic reticulum Ca2+-ATPase function in homogenates of rat gastrocnemius[J].Mol Cell Biochem,1995,146(1):23-33.
[12]马群.不同程度运动性心理疲劳心率变异性与脑电图特征[D].北京,北京体育大学,2009.
[13]GüntherAC,BottaiM,SchandlAR,etal.Palmarskin conductance variability and the relation to stimulation,pain and the motor activity assessment scale in intensive care unit patients[J].Crit Care,2013,51(17):2-7.
[14]张勇,陈家琦,李玉琳.大鼠力竭性运动后心肌和骨骼肌线粒体膜脂质过氧化水平变化[J].天津体育学院学报,1994, 9(1):57–64.
[15]李雷,刘丽萍,陈新民,等.河北女足大强度训练前后Bcl-2基因、Ca2+,线粒体膜电位的变化与细胞凋亡[J].体育科学,2001,21(5):51-54.
[16]Taelman J,Vanderhaegen J,Robijns M,et al.Estimation of Muscle Fatigue Using Surface Electromyography and Near-Infrared Spectroscopy[J].Adv Exp Med Biol,2011,701:353-359.
[17]Morris G,Maes M.Mitochondrial dysfunctions in Myalgic Encephalomyelitis/chronic fatigue syndrome explained by activatedimmuno-inflammatory,oxidativeandnitrosative stress pathways[J].Metab Brain Dis,2014,29(1):19-36.
[18]Su Meihua.The Time Effect of DNA Damage and Oxidative Stress on Mice Liver Cells Induced by Exercise Fatigue[J]. EducationManagement,EducationTheoryandEducation Application,2012,109:661-667.
2014.03.28
江西省体育局局管课题(2013025)
李宏伟,Email:lihongwei1969@126.com



