马涛 王通
齐鲁师范学院体育学院(山东 济南 250200)
运动对废用性骨质疏松大鼠骨代谢和破骨细胞分化OPG-RANKL-RANK系统的影响
马涛 王通
齐鲁师范学院体育学院(山东 济南 250200)
目的:研究跑台运动对废用性骨质疏松的作用以及破骨细胞分化OPG-RANKL-RANK系统在其中的介导作用。方法:6周龄雄性Sprague-Dawley大鼠40只,分为正常对照组、废用模型组、正常恢复组和运动恢复组,每组10只。正常对照组不做任何特殊处理,安静饲养4周后处死;废用模型组尾部悬吊4周后处死;正常恢复组尾部悬吊4周后,安静饲养4周处死;运动恢复组尾部悬吊4周后,跑台训练4周处死。各组大鼠处死后立即进行骨密度(BMD)、骨组织形态计量学、骨组织抗酒石酸酸性磷酸酶5b(TRACP-5b)染色计量、骨代谢以及破骨细胞分化OPG-RANKL-RANK系统相关细胞因子等指标的测试。结果:废用模型组大鼠BMD、骨小梁体积百分比(TBV)、骨小梁宽度(Tb.Wi)、血清碱性磷酸酶(ALP)浓度、骨髓细胞因子OPG基因表达量均显着小于正常对照组(P<0.01),而骨小梁间距(Tb.Sp)、胫骨干骺端TRACP-5b平均阳性染色面积百分比(APSAP)、血清Ca2+和TRACP-5b浓度、骨髓细胞因子RANKL、M-CSF、RANK、IL-6和TNF-α基因表达量则显着大于正常对照组(P<0.01)。运动恢复组大鼠BMD、TBV、Tb.Wi、血清ALP浓度、骨髓细胞因子OPG基因表达量均显着大于正常恢复组(P<0.05或P<0.01),而Tb.Sp、血清Ca2+和TRACP-5b浓度、胫骨干骺端APSAP、骨髓细胞因子RANKL、M-CSF、RANK、IL-6和TNF-α基因表达量均显着小于正常恢复组(P<0.05,P<0.01)。结论:4周的尾部悬吊可导致大鼠废用性骨质疏松症的发生,跑台运动可以促进废用性骨质疏松症的恢复,这均与骨髓微环境破骨细胞分化OPG-RANKL-RANK系统相关细胞因子的表达有关。
运动;废用性骨质疏松;骨代谢;破骨细胞;OPG-RANKL-RANK系统
骨质疏松症是一种以骨质流失为主要特征的骨组织退行性疾病,据国际骨质疏松协会统计,全球每年有近900万人发生骨质疏松性骨折[1]。废用性骨质疏松症可发生于脊髓损伤不能运动的患者以及其它由于疾病或手术而长期卧床休息的患者,此外,由于宇航员长期处于太空微重力的环境下,其骨组织(尤其是下肢承重骨)由于缺乏正常的机械负荷刺激,废用性骨质疏松症也时有发生[2]。废用性骨质疏松导致的骨折不但使患者身心受到巨大摧残,而且也对患者家庭及社会造成巨大的经济负担,因此,废用性骨质疏松症的防治方法研究至关重要[3]。本研究在前人研究的基础上,通过尾部悬吊使大鼠后肢不能正常承重,造成后肢废用性骨质疏松模型,从而研究运动对废用性骨质疏松症的治疗作用。
骨组织是一个代谢活跃的组织,在整个生命过程中骨组织不断地进行着骨质的更新—骨重建,骨重建的过程包括破骨细胞的骨吸收作用和成骨细胞的骨形成作用的协调平衡[4]。在某些情况下,骨吸收和骨形成过程不能保持平衡即可造成骨组织疾病,如在骨吸收作用障碍的情况下可造成骨硬化症,在骨吸收作用亢进的情况下可造成骨质疏松症等[5]。事实上,成骨细胞和破骨细胞之间存在着相互调控的作用。研究发现,成骨细胞可以调控破骨细胞的分化和活性,而OPGRANKL-RANK系统则是目前为止所发现的一个主要信号调节通路[6],本研究从OPG-RANKL-RANK信号通路的角度研究运动对废用性骨质疏松大鼠破骨细胞分化的影响,并通过对骨组织破骨细胞特异性酶抗酒石酸酸性磷酸酶-5b(TRACP-5b)的染色来反映骨组织破骨细胞的骨吸收活性。
1 材料与方法
1.1 实验动物与分组
6周龄健康纯系雄性Sprague-Dawley大鼠40只,体重213.33±18.26 g,由上海西普尔-必凯实验动物有限公司提供,许可证号为SCXK(沪)2003-0002,适应性饲养1周后,分为正常对照组、废用模型组、正常恢复组和运动恢复组,每组10只。各组大鼠采取的干预及测试方案如下:正常对照组:不做任何特殊处理,安静饲养4周后处死,进行指标测试;废用模型组:尾部悬吊致后肢废用4周后处死,进行指标测试;正常恢复组:尾部悬吊4周后,安静饲养4周处死,进行指标测试;运动恢复组:尾部悬吊4周后,进行跑台训练(段式ZH-PT)。跑台训练第1周的前3天为适应性训练,跑速为10 m/min,每次训练时间为20 min,跑台坡度为0。从第4天开始,跑速固定为13 m/min,每次训练时间固定为40 min,跑台坡度为0,每周训练6次(周一至周六每天1次),共训练4周后处死,进行指标测试。
1.2 废用性骨质疏松模型的建立
废用模型组、正常恢复组和运动恢复组大鼠均需要进行废用干预,本实验室通过尾部悬吊的方法自制后肢废用性骨质疏松模型,其具体制作方法在本实验室研究团队前期相关研究文献中已有详述[7],在此就不再重复。
1.3 取材
正常对照组和废用模型组大鼠在安静饲养或尾部悬吊4周后处死,进行指标测试;为了减少急性运动对测试指标的影响,正常恢复组和运动恢复组大鼠的取材,均安排在运动恢复组大鼠最后一次训练结束24 h后进行。断颈椎处死大鼠,在断颈椎后即刻进行心脏取血,待测血清骨代谢生化标志物;取其两侧股骨和胫骨,剔除骨组织上附着的软组织,将左侧股骨用生理盐水浸透的纱布包裹好,放于-20℃冰箱保存,待测骨密度(BMD);将右侧股骨浸泡在PBS中,待测骨髓细胞因子。将两侧胫骨在PBS中清洗后,投入4%PFA溶液中,左侧胫骨待做不脱钙切片,进行胫骨近端干骺端骨小梁组织形态计量学指标;右侧胫骨待进行骨组织TRACP-5b染色。
1.4 指标的测定
1.4.1 骨密度测试及骨组织HHEE染色
将左侧股骨从-20℃冰箱中取出,室温自然解冻24小时,双能X线骨密度仪(型号为Hologic Discovery A)扫描股骨骨密度;将左侧胫骨做不脱钙切片,HE染色,在日本产Olympus IX71显微镜下观察并拍片,通过Image-Pro Plus 5.0图像分析软件统计胫骨干骺端近端骨小梁组织形态计量学指标,指标包括骨小梁体积百分比(TBV)、骨小梁宽度(Tb.Wi)、骨小梁数目(Tb.N)和骨小梁间距(Tb.Sp),统计位置在距骺线1~4 mm范围,其具体步骤已在本研究团队前期发表的论文[8]中详细阐述,在此不在重复。
1.4.2 骨组织TRRAACCPP-- 55 bb染色
使骨组织在4%多聚甲醛(PFA)溶液中4℃过夜,第2天4%PFA换液继续固定24小时,然后10%EDTA溶液脱钙1周,10%EDTA换液继续脱钙1周,双蒸水清洗,梯度酒精脱水,常规二甲苯透明处理,常规石蜡包埋,在Leica石蜡切片机上以5 μm的厚度切片,常规二甲苯脱腊,梯度酒精水化,双蒸水清洗后,加入固定液,室温固定30 s,双蒸水清洗,加入TRACP-5b染色试剂盒中的染液,37℃水浴中染色4小时(Acid Phospha⁃taseLeukocyteKit,Sigma)。双蒸水清洗,Leica DM4000电子显微镜拍片,用Image-Pro Plus 5.0图像分析软件统计胫骨干骺端TRACP-5b阳性染色区域的平均阳性染色面积百分比(Average positive staining area percentage,APSAP)。
1.4.3 血清骨代谢生化标志物的测试
将心脏取血得到的血液在4℃条件下即刻进行离心操作,转速为3000 rpm,离心时间3 min,分离大鼠血清[9],比色法检测血清骨代谢生化标志物血清钙离子(Ca2+)、血清磷离子(P)、碱性磷酸酶(ALP)和抗酒石酸酸性磷酸酶-5b(TRACP-5b),试剂盒均购自南京建成生物工程研究所。
1.4.4 荧光定量PPCCRR测试OPG-RANKL--RRAANNKK系统相关调节因子
骨两端用剪刀剪开,用2~3 ml α-MEM培养基、10 ml注射器和27G针头冲洗出骨髓;常规方法提取骨髓总RNA;琼脂糖凝胶鉴定RNA完整性,NANODROP 2000 spectrophotometer测定RNA纯度和浓度,确认OD260/OD280比值均在1.8~2.0之间并记录各样本的浓度;常规方法逆转录;根据所要检测的目的基因,在NCBI数据库查询各基因引物序列,由上海生工生物技术有限公司进行引物合成,各基因引物序列及扩增长度见表1;荧光定量PCR扩增反应按照以下体系进行,SYBR Premix Ex TaqTM(2×)10 μL、PCR Forward Prim⁃er(10 μm)0.4 μL、PCR Reverse Primer(10 μm)0.4 μL、ROX Reference Dye(50×)0.4 μL、DNA模板2μL、加DEPC水使总反应体系达到20 μL;Real time PCR分3阶段,扩增采用3步法进行,温度循环参数如下:Stage 1(1×):95℃,1 min(预变性)。Stage 2(40×):95℃,15 s;61℃,30 s;72℃,45 s(收集荧光)。Stage3(1×):建立PCR产物的熔解曲线,95℃,30 s;61℃,2 min;95℃,15 s;每1℃收集荧光;反应结束后,PCR仪给出各反应孔的Ct值,以β-actin基因为内参,根据公式2-ΔCt计算各基因的相对表达量。

表1 骨髓细胞因子基因引物设计
1.5 统计学方法
2 实验结果
2.1 骨密度
由图1可知,各组大鼠股骨干骺端骨密度比较结果显示,废用模型组显着小于正常对照组(P<0.01),运动恢复组显着大于正常恢复组(P<0.01)。
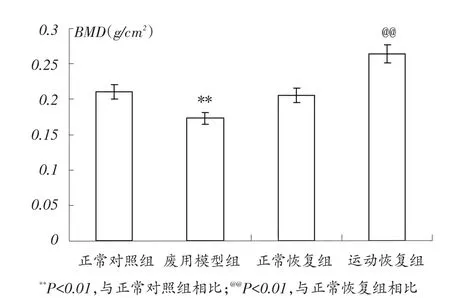
图1 各组大鼠股骨骨密度比较
2.2 骨组织形态计量学指标
由表2可知:各组大鼠胫骨近段干骺端组织形态计量学指标比较结果显示:废用模型组骨小梁体积百分比(TBV)和骨小梁宽度(Tb.Wi)均显着小于正常对照组(P<0.01);废用模型组骨小梁间距(Tb.Sp)显着大于正常对照组(P<0.01);运动恢复组骨小梁体积百分比(TBV)和骨小梁宽度(Tb.Wi)均显着大于正常恢复组(P<0.05或P<0.01);运动恢复组骨小梁间距(Tb.Sp)显着小于正常恢复组(P<0.01);各组骨小梁数目(Tb.N)之间没有显着性差异(P>0.05)。
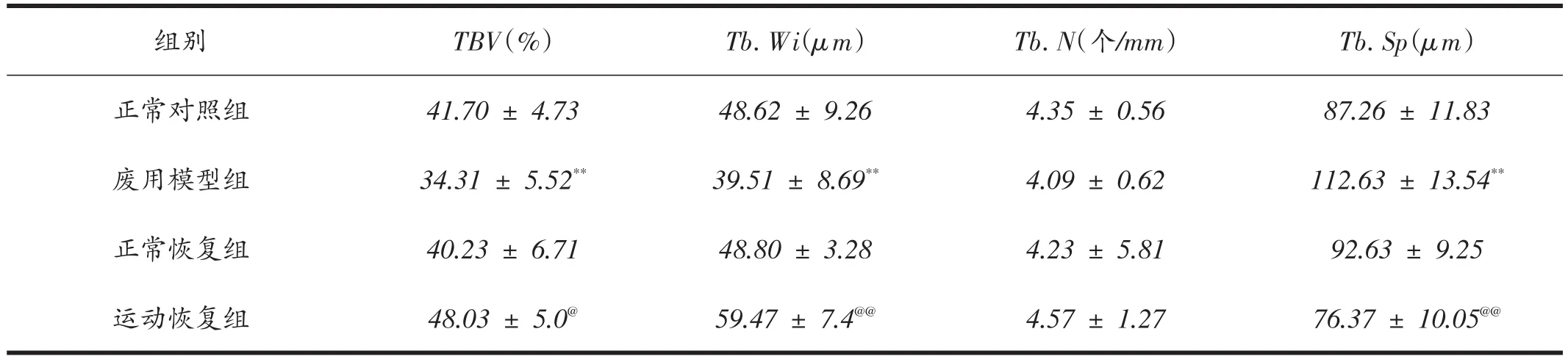
表2 各组大鼠胫骨干骺端组织形态计量学指标(n=8)
2.3 骨组织TRRAACCPP-- 55 bb染色
抗酒石酸酸性磷酸酶-5b(TRACP-5b)是成熟的破骨细胞所分泌的破骨细胞特异性酶,TRACP-5b经染色呈现红色,故染色后破骨细胞的细胞质呈红色阳性,所以通常用TRACP-5b经染色呈现红色的面积来反映破骨细胞的数量。从图2可以看出,大鼠胫骨骨骺、骺板以及干骺端的骨吸收陷窝内的红色阳性染色较多,证明破骨细胞多分布于这些部位,且沿骨吸收陷窝边缘排列,以骺板部位的破骨细胞最为密集,另外在皮质骨的外表面也分布有大量红色阳性染色的破骨细胞。
由图3可知,废用模型组胫骨干骺端TRACP-5b平均阳性染色面积百分比(APSAP)显着大于正常对照组(P<0.01),运动恢复组胫骨干骺端TRACP-5b平均阳性染色面积百分比(APSAP)显着小于正常恢复组(P<0.01)。
2.4 血清骨代谢生化标志物
由表3可知,各组大鼠血清骨代谢生化标志物比较结果显示:废用模型组反映骨吸收的指标血清Ca2+和TRACP-5b浓度均显着大于正常对照组(P<0.01),同时废用模型组反映骨形成的指标血清ALP浓度显着小于正常对照组(P<0.01);运动恢复组反映骨吸收的指标血清Ca2+和TRACP-5b浓度均显着小于正常恢复组(P<0.05或P<0.01),同时运动恢复组反映骨形成的指标血清ALP浓度显着大于正常恢复组(P<0.01);各组血清P浓度无显着性差异(P>0.05)。
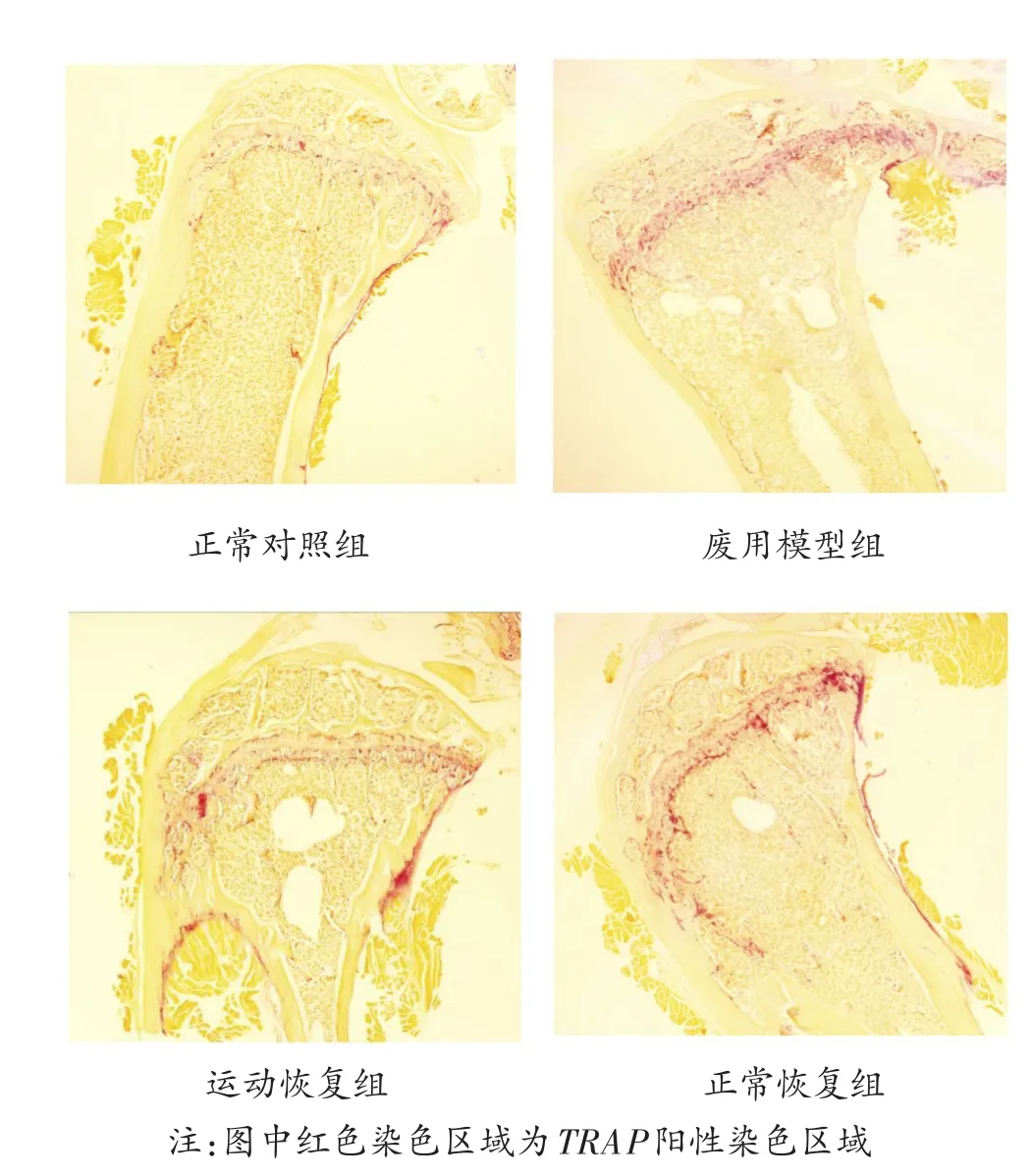
图2 各组大鼠胫骨近段干骺端TRACP-5b染色(40×)
2.5 OPG-RANKL--RRAANNKK系统相关调节因子基因表达
由表4可知,各组大鼠骨髓局部OPG-RANKLRANK系统相关调节因子基因表达量比较结果显示:废用模型组促进破骨细胞分化和形成的骨髓细胞因子RANKL、M-CSF、RANK、IL-6和TNF-α基因表达量均显着大于正常对照组(P<0.01),同时废用模型组抑制破骨细胞分化和形成的骨髓细胞因子OPG显着小于正常对照组(P<0.01);运动恢复组促进破骨细胞分化和形成的骨髓细胞因子RANKL、M-CSF、RANK、IL-6和TNF-α基因表达量均显着小于正常恢复组(P<0.05或P<0.01),同时运动恢复组抑制破骨细胞分化和形成的骨髓细胞因子OPG显着大于正常恢复组(P<0.01)。
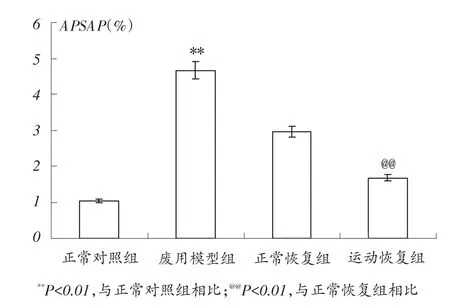
图3 各组大鼠胫骨近段干骺端TRACP-5b平均阳性染色面积百分比
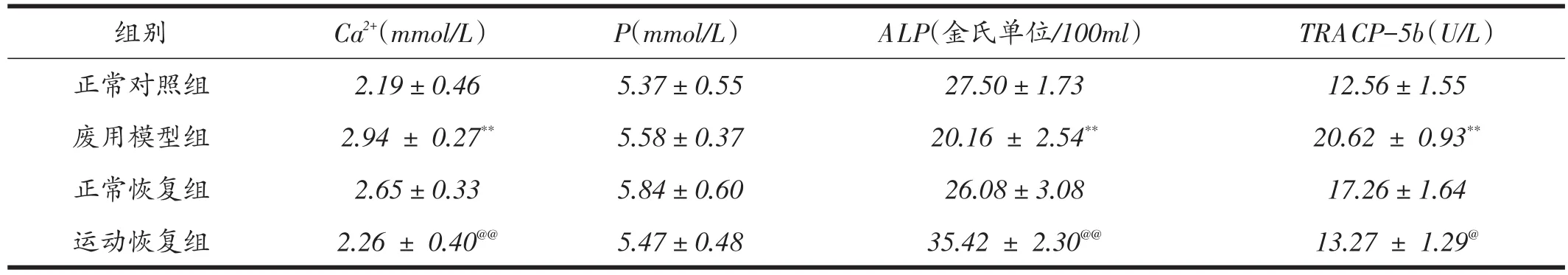
表3 各组大鼠血清骨代谢生化标志物指标(n=8)
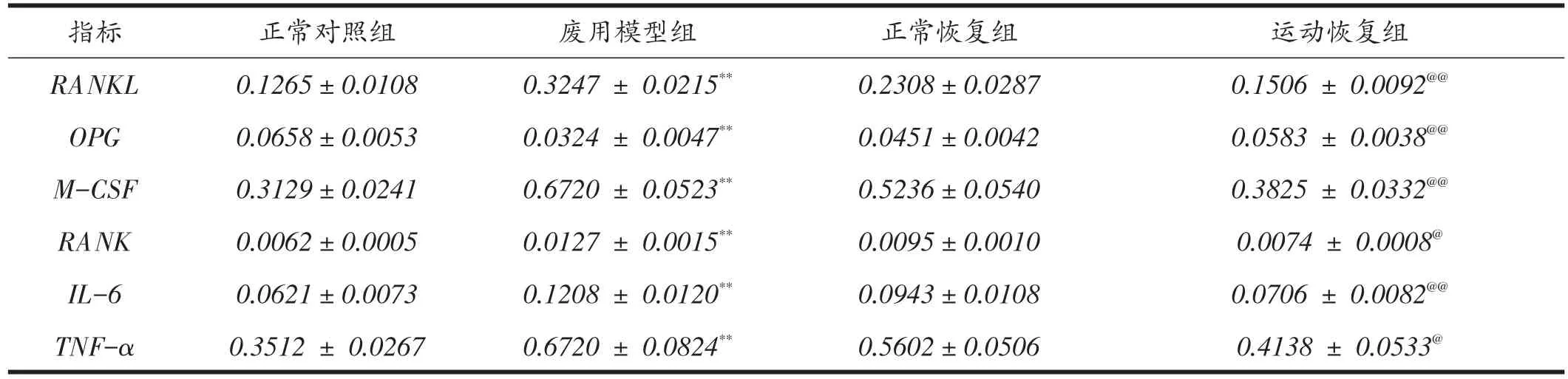
表4 各组大鼠OPG-RANKL-RANK系统相关调节因子基因表达(n=8)
3 分析与讨论
骨质疏松是一种以骨量减少为特征的常见病、多发病。骨质疏松患者由于骨量的减少极易发生骨质疏松性骨折以及一些其它代谢性疾病[10]。业已证明,机械负荷刺激对于维持骨密度和骨量具有重要意义[11],如人体承重骨骨密度明显大于非承重骨骨密度,再如运动员的骨组织由于长期承受较高的冲击性机械刺激,其骨密度显着高于非运动员。而废用(缺少机械负荷刺激)则是骨质疏松症发病的重要原因之一,缺少机械负荷刺激将会使骨代谢的平衡遭到破坏并进而导致骨质的快速流失以及骨组织机械功能的受损,废用导致的骨质流失起因于骨吸收作用的增强和骨形成作用的减弱[12]。在本研究中,废用模型组大鼠骨密度显着低于正常对照组。这说明本研究通过尾部悬吊制造大鼠废用性骨质疏松模型的方法是有效的。目前国内外有关废用性骨质疏松的动物模型主要包括神经切断术、尾部悬吊、石膏固定以及弹性包扎等。本研究在总结前人研究成果的基础上,改进了尾部悬吊模型,主要是通过增加旋转链接装置以提高悬吊模型大鼠的活动自由度以及改进包扎方式以减少大鼠尾部损伤,与以往方法相比,效果较好,在整个废用干预期间废用模型组动物体重变化和正常对照组之间差异较小。此外,废用模型也没有造成动物尾部皮肤的溃烂或者肿胀。
除骨密度之外,本研究还从股骨近端干骺端骨小梁微细结构的形态计量学层面进一步对各组大鼠进行对比。其中,骨小梁体积百分比(TBV)综合反映了测量区域内骨小梁面积和总测量面积的比值,骨小梁宽度(Tb.Wi)反映了测量范围内骨小梁的粗细程度,骨小梁数目(Tb.N)反映了测试区域骨小梁的疏密程度,骨小梁间距(Tb.Sp)反映了测量区域内相邻骨小梁的间隙大小[13]。其中,TBV、Tb.Wi和Tb.N均和骨组织骨密度成正相关,而Tb.Sp和骨组织骨密度呈负相关[14]。无论是从股骨骨密度指标,还是胫骨骨组织形态计量学指标,本研究结果均发现废用模型组大鼠均出现了明显的骨质流失。与正常恢复组相比,运动恢复组大鼠的骨密度和骨结构都得到了较快的恢复。同时,从反映骨代谢的血清生化标志物结果看,废用模型组反映骨吸收的指标血清Ca2+和TRACP-5b浓度均显着大于正常对照组,同时废用模型组反映骨形成的指标血清ALP浓度显着小于正常对照组;运动恢复组反映骨吸收的血清Ca2+和TRACP-5b浓度均显着小于正常恢复组,同时运动恢复组反映骨形成的指标血清ALP浓度显着大于正常恢复组。这说明废用导致大鼠骨形成作用减弱而骨吸收作用亢进,从而导致大鼠骨密度的下降和骨组织形态计量学指标的变化,出现骨质疏松症。与正常恢复相比,运动可以显着促进废用性骨质疏松的恢复。此结果与本实验室前期关于运动防治废用性骨质疏松的相关研究结果相符合[7]。
值得注意的是,在本研究中,不论是股骨骨密度还是胫骨组织形态计量学指标TBV、Tb.Wi和Tb.Sp方面,运动恢复组不但显着高于废用模型组和正常恢复组,而且也显着高于正常对照组。我们认为,出现这一结果一方面是因为运动对骨组织产生了积极的影响,另一方面是由于大鼠骨组织随年龄的自然增长而导致的,因为正常恢复组和运动恢复组大鼠均比正常对照组和废用模型组大鼠多生长了4周的时间。正是由于在废用干预之后骨组织4周的自然生长加之跑台运动对其产生的积极影响,才使得运动恢复组大鼠骨密度和骨组织形态计量学指标均显着大于正常对照组。同时我们也发现运动恢复组大鼠血清骨代谢指标ALP也显着大于正常对照组,这一指标反映的是骨形成作用的强弱,说明跑台运动不但能够使大鼠因废用干预而减弱的骨形成作用得以恢复,而且还可以使其骨形成作用超过正常状态。在本实验室前期关于运动防治废用性骨质疏松的相关研究中也得到了类似的结果[7],在该研究中,我们发现模拟失重+游泳训练组和模拟失重+跑台训练组大鼠股骨以及第5腰椎骨密度均显着大于正常对照组,而且模拟失重+游泳训练组和模拟失重+跑台训练组大鼠股骨以及第5腰椎的结构力学参数和材料力学参数均显着大于正常对照组。
骨重建是一个旧的骨组织逐渐被新的骨组织所取代的动态过程,这包括破骨细胞的骨吸收作用和成骨细胞的骨形成作用的协调平衡。专门负责骨吸收作用的破骨细胞起源于巨噬细胞/单核细胞谱系,在一系列激素和细胞因子的调控作用下,由多能造血干细胞增殖为单核细胞,进入组织后转变为巨噬细胞,巨噬细胞进一步分化和融合,最终形成多核的破骨细胞[15]。研究表明,抗酒石酸酸性磷酸酶-5b(TRACP-5b)是由成熟的破骨细胞在骨吸收过程中特异性分泌的,所以测量骨组织TRACP-5b的含量即可了解骨组织正在进行骨吸收活动的程度[16]。本研究骨组织TRACP-5b的结果显示,废用模型组胫骨干骺端TRACP-5b平均阳性染色面积百分比(APSAP)显着大于正常对照组,运动恢复组胫骨干骺端TRACP-5b平均阳性染色面积百分比(APSAP)显着小于正常恢复组。此结果说明废用导致大鼠骨组织破骨细胞分化加快,活性增加,造成了骨组织较快的骨吸收。与正常恢复组相比,运动可以显着抑制骨组织破骨细胞的分化与活性,降低骨吸收。此外,在反映骨吸收的指标中,除了骨组织TRACP-5b染色外,血清中的TRACP-5b含量也和骨吸收活动高度相关且可以通过免疫技术等方法进行具体测量,可作为评价骨吸收的一个主要血清标志物[17]。血清TRACP-5b作为一项骨吸收标志物已经在大量骨吸收疾病(如骨质疏松症、多发性骨髓瘤、骨转移的乳腺癌,肺癌,前列腺癌等)的检测结果中得到证明[18]。目前,血清TRACP-5b作为骨吸收标志物已逐步应用于临床对骨质疏松等骨吸收疾病诊断的特异性和敏感性指标[19]。
在骨质疏松的细胞与分子机制研究中,成骨细胞与破骨细胞的信号通讯以及由此调控的骨形成与骨吸收的平衡问题是近年来研究的热点问题[20]。成骨细胞可以调控破骨细胞的分化和活性,而OPG-RANKLRANK系统则是迄今为止发现的一个主要信号调节通路[21]。OPG-RANKL-RANK系统调控破骨细胞的分化和活性主要包括三个主要过程:(1)造血前体细胞(这里称为破骨细胞前体细胞)的表面表达核因子κB受体活化因子(RANK);(2)核因子κB受体活化因子配体(RANKL)在成骨细胞表面表达并进而经过蛋白水解释放其可溶性形式的RANKL;(3)成骨细胞表达和释放RANKL的诱饵受体骨保护素(OPG)[22]。破骨细胞前体细胞分化为成熟的、具有骨吸收活性的破骨细胞的过程需要RANKL与RANK的结合并进而激发一系列的细胞内信号通路,而OPG与RANKL的结合可以阻止RANKL与RANK的结合从而抑制破骨细胞的分化和成熟[23]。研究发现,大量的激素和细胞因子均通过OPG-RANKL-RANK信号传导途径发挥其对破骨细胞分化和活性的生理调节作用,如IL-6和TNF-α可通过OPG-RANKL-RANK信号传导途径促进破骨细胞的分化和形成[24]。本研究结果显示,废用模型组促进破骨细胞分化和形成的骨髓细胞因子RANKL、M-CSF、RANK、IL-6和TNF-α基因表达量均显着大于正常对照组,同时废用模型组抑制破骨细胞分化和形成的骨髓细胞因子OPG显着小于正常对照组;运动恢复组促进破骨细胞分化和形成的骨髓细胞因子RANKL、MCSF、RANK、IL-6和TNF-α基因表达量均显着小于正常恢复组,同时运动恢复组抑制破骨细胞分化和形成的骨髓细胞因子OPG显着大于正常恢复组。这说明废用可通过改变骨髓微环境OPG-RANKL-RANK系统相关细胞因子的表达,进而促进破骨细胞的分化,而运动也可以通过调节骨髓微环境OPG-RANKL-RANK系统相关细胞因子的表达而抑制破骨细胞的分化。
4 结论
4周的尾部悬吊可导致大鼠废用性骨质疏松症的发生,跑台运动可以促进废用性骨质疏松症的恢复,废用性骨质疏松症及运动对废用性骨质疏松症的恢复作用与骨髓微环境破骨细胞分化OPG-RANKL-RANK系统相关细胞因子的表达有关。
[1]Papapoulos S,Lippuner K,Roux C,et al.The effect of 8 or 5 years of denosumab treatment in postmenopausal women with osteoporosis:results from the FREEDOM Ex⁃tension study[J].Osteoporos Int,2015,26(12):2773-2783.
[2]Tsukamoto M,Menuki K,Murai T,et al.Elcatonin pre⁃vents bone loss caused by skeletal unloading by inhibit⁃ing preosteoclast fusion through the unloading-induced high expression of calcitonin receptors in bone marrow cells[J].Bone,2016,3(85):70-80.
[3]Lv J,Sun X,Ma J,et al.Involvement of periostin-scleros⁃tin-Wnt/β-catenin signaling pathway in the prevention of neurectomy-induced bone loss by naringin[J].Biochem Biophys Res Commun,2015,468(4):587-593.
[4]Bakker AD,Jaspers RT.IL-6 and IGF-1 Signaling With⁃in and Between Muscle and Bone:How Important is the mTOR Pathway for Bone Metabolism[J].Curr Osteopo⁃ros Rep,2015,13(3):131-139.
[5]Wu PF,Tang JY,Li KH.RANK pathway in giant cell tu⁃mor of bone:pathogenesis and therapeutic aspects[J].Tu⁃mour Biol,2015,36(2):495-501.
[6]Tsukamoto S,Takeuchi T,Kawabata T,et al.Halenaqui⁃noneinhibitsRANKL-inducedosteoclastogenesis[J].Bioorg Med Chem Lett,2014,24(22):5315-5317.
[7]赵贤.运动对模拟失重后大鼠骨形态计量学、骨密度及骨生物力学指标的影响[D].上海,华东师范大学,2009.
[8]李世昌,马涛,尹小俭,等.不同运动方式对生长期大鼠骨密度和组织形态计量学指标的影响[J].体育科学,2008,28(1):54-58.
[9]郑庆云,李世昌,马涛.纵跳对生长期大鼠骨密度、骨代谢生化指标的影响[J].体育科学,2008,28(8):45-49.
[10]Kelly OJ,Gilman JC,Kim Y,et al.Long-chain polyunsat⁃urated fatty acids may mutually benefit both obesity and osteoporosis[J].Nutr Res,2013,33(7):521-533.
[11]马涛,李世昌,梁晓霞,等.上、下坡跑台运动对去卵巢小鼠骨密度及骨组织形态计量学指标的影响[J].体育科学,2011,31(1):48-55.
[12]Thomsen JS,Christensen LL,Vegger JB,et al.Loss of bone strength is dependent on skeletal site in disuse os⁃teoporosis in rats[J].Calcif Tissue Int,2012,90(4):294-306.
[13]Dempster DW,Compston JE,Drezner MK,et al.Standard⁃ized nomenclature,symbols,and units for bone histomor⁃phometry:a 2012 update of the report of the ASBMR Histomorphometry Nomenclature Committee[J].J Bone Min⁃er Res,2013,28(1):2-17.
[14]Kulak CA1,Dempster DW.Bone histomorphometry:a con⁃cisereviewforendocrinologistsandclinicians[J].Arq Bras Endocrinol Metabol,2010,54(2):87-98.
[15]Matsushita Y,Hayashida S,Morishita K,et al.Denosum⁃ab-associated osteonecrosis of the jaw affects osteoclast formation and differentiation:Pathological features of two cases[J].Mol Clin Oncol,2016,4(2):191-194.
[16]Lv Y,Wang G,Xu W,et al.Tartrate-resistant acid phos⁃phatase 5b is a marker of osteoclast number and volume in RAW 264.7 cells treated with receptor-activated nu⁃clear κB ligand[J].Exp Ther Med,2015,9(1):143-146.
[17]Tsuchiya Y,Sakuraba K,Ochi E,et al.High force eccen⁃tric exercise enhances serum tartrate-resistant acid phos⁃phatase-5b and osteocalcin[J].J Musculoskelet Neuronal Interact,2014,14(1):50-57.
[18]Sarvari BK,Sankara Mahadev D,Rupa S,et al.Detection of bone metastases in breast cancer(BC)patients by se⁃rum tartrate-resistant acid phosphatase 5b(TRACP 5b),a bone resorption marker and serum alkaline phospha⁃tase(ALP),a bone formation marker,in lieu of whole bodyskeletalscintigraphywithtechnetium99mMDP[J].Indian J Clin Biochem,2015,30(1):66-71.
[19]Cheng T,Wang M,Chen Z,et al.Tartrate-resistant acid phosphatase 5b is a potential biomarker for rheumatoid arthritis:a pilot study in Han Chinese[J].Chin Med J(Engl),2014,127(16):2894-2899.
[20]Ota K,Quint P,Ruan M,et al.TGF-β induces Wnt10b in osteoclasts from female mice to enhance coupling to osteoblasts[J].Endocrinology,2013,154(10):3745-3752.
[21]TyrovolaJB,OdontXX.The"mechanostattheory"of frost and the OPG/RANKL/RANK system[J].J Cell Bio⁃chem,2015,116(12):2724-2729.
[22]Kassem A,Henning P,Lundberg P,et al.Porphyromonas gin⁃givalis stimulates bone resorption by enhancing RANKL(receptor activator of NF-κB ligand)through activation of toll-like receptor 2 in osteoblasts[J].J Biol Chem,2015,290(33):20147-20158.
[23]Zeng R,Faccio R,Novack DV.Alternative NF-κB regu⁃lates RANKL-induced osteoclast differentiation and mito⁃chondrial biogenesis via independent mechanisms[J].J Bone Miner Res,2015,30(12):2287-2299.
[24]Tyagi AM,Mansoori MN,Srivastava K,et al.Enhanced immunoprotective effects by anti-IL-17 antibody trans⁃lates to improved skeletal parameters under estrogen defi⁃ciency compared with anti-RANKL and anti-TNF-α anti⁃bodies[J].J Bone Miner Res,2014,29(9):1981-1992.
Effects of Exercises on Bone Metabolism and OPG-RANKL-RANK System of Osteoclast Differentiation in Rats with Disuse Osteoporosis
Ma Tao,Wang Tong
College of Physical Education,Qilu Normal Univesity,Jinan 250200,China Corresponding Author:Ma Tao,Email:mthdsfdx@126.com
ObjectiveTo explore the effect of treadmill exercises on disuse osteoporosis and the me⁃dia effect of OPG-RANKL-RANK system of osteoclast differentiation in the process.MethodsForty sixweek-old male Sprague-Dawley rats were randomly divided into a normal control group,a disuse model group,a normal recovery group and an exercise recovery group,each of 10.The normal control group were sacrificed 4 weeks later without receiving any special treatment.The disuse model group were sac⁃rificed after 4 weeks of tail suspension.The normal recovery group were sacrificed after 4 weeks of tail suspension and keeping quiet for 4 weeks.The exercise recovery group were sacrificed after 4 weeks of tail suspension and another 4 weeks of treadmill exercises.The indicators of bone mineral density(BMD),bone histomorphometry,bone tissue TRACP-5b staining,bone metabolism and cytokines related to the osteoclast differentiation OPG-RANKL-RANK system were tested immediately after therats were sacrificed.ResultsThe BMD,trabecular bone volume percentage(TBV),trabecular bone width(Tb.Wi),concentration of serum alkaline phosphatase(ALP)and the gene expression of bone marrow oculopneumoplethysmograph(OPG)of the disuse model goup were significantly lower than those of the normal control group(P<0.01),while the trabecular bone spacing(Tb.Sp),average posi⁃tive staining area percentage(APSAP)of tartrate-resistant acid phosphatase(TRACP)-5b,concentra⁃tion of serum Ca2+and TRACP-5b and the gene expression of bone marrow cytokines including RANKL,macrophage colony-stimulating factor(M-CSF),RANK,interleukin(IL)-6 and tumor necrosis factor(TNF)-α of the disuse model goup were significantly higher than those of the normal control group(P<0.01).The BMD,TBV,Tb.Wi,concentration of serum ALP and the gene expression of bone marrow OPG of the exercise recovery group were significantly higher than those of the normal recovery group(P<0.05 or P<0.01).The Tb.Sp,APSAP,concentration of serum Ca2+and TRACP-5b and the gene expression of RANKL,M-CSF,RANK,IL-6 and TNF-α of the exercise recovery group were signif⁃icantly lower than those of the normal recovery group(P<0.05 or P<0.01).ConclusionThe 4-week tail suspension can lead to disuse osteoporosis in rats.Treadmill exercise can promote the recovery of rats with the disuse osteoporosis.The occurrence of disuse osteoporosis and the effect of exercises on disuse osteoporosis were related with the expressing of OPG-RANKL-RANK system-related cytokines of osteoclast differentiation in bone marrow microenvironment.
exercise,disuse osteoporosis,bone Metabolism,osteoclast,OPG-RANKL-RANK system
2016.09.10
国家体育总局全民健身研究领域课题(2015B059);国家体育总局体育哲学社会科学研究项目(2292SS16029)
马涛,Email:mthdsfdx@126.com



