黄传业 潘明玲 章岚 陈万 毛德伟 隋波 高丽 李荀 韩炜
山东体育学院(山东济南 250102)
动脉硬度是心血管疾病独立风险因素,对于预测心血管事件发生和全因死亡风险具有重要价值[1]。动脉脉搏波传导速度(pulse wave velocity,PWV)是早期评估动脉硬度无创性指标。研究报道,从20岁至91岁,PWV随着年龄增长可增加2.5倍[2]。PWV每增加1 m/s,心血管事件和全因死亡风险将增加15%[1]。另有研究报道,脂肪与动脉血管硬化关系密切[3]。肥胖(BMI≥30 kg/m2)人群的动脉硬度明显高于正常体重者[4]。即便无任何症状年轻成年人,超重/肥胖亦可加速动脉硬化进程[5]。规律性有氧运动在改善动脉硬度方面具有积极作用[4,6,7]。然而,有氧运动对超重/肥胖者动脉硬度影响还存在争议[8]。运动强度可能是造成研究结果不一致的重要因素[8]。
青年时期进行减脂控体重训练,对延缓超重/肥胖人群动脉硬化进程具有深远意义。研究发现,运动中脂肪氧化率与运动强度呈倒“U”型关系,而最大脂肪氧化(maximal fat oxidation,FATmax)强度可能是促进脂肪氧化的最佳运动强度[9],其在减脂控制体重方面的作用备受关注[10]。然而,关于FATmax强度运动能否改善超重/肥胖者动脉硬度的资料缺乏,相关潜在机制也有待探讨。
鉴于有氧运动对超重/肥胖人群动脉硬度影响尚不明确,本研究观察12周FATmax强度运动训练前后超重/肥胖青年男子动脉硬度变化,为控制超重/肥胖青年人群动脉硬化进程提供理论和实践依据。
1 研究对象与方法
1.1 研究对象
选取32名超重或肥胖(BMI≥25 kg/m2)青年男子为研究对象,随机分成运动组(年龄20.7±1.1岁,身高176.3 ±6.9 cm,体重91.3 ±12.0 kg,n=16)与对照组(年龄20.3±1.1岁,身高174.5±4.1 cm,体重89.6±10.9 kg,n=16)。所有受试者无任何心血管疾病、糖尿病等疾病史或临床症状,未使用任何药物,无吸烟等不良嗜好,没有规律性体育锻炼习惯。所有受试者了解本研究实验目的和流程后,自愿参与本实验并签署知情同意书。
1.2 实验设计
受试者经过问卷调查、一般医学检查(空腹血糖、血脂、心电图、安静血压和动脉硬度等)后,在功率车(Lode Corival,Lode B.V.,Groningen,Newtherlands)上完成一次递增负荷运动直至力竭,确定最大摄氧量(VO2max)。受试者随机完成5次不同强度(30%VO2max、40%VO2max、50%VO2max、60%VO2max和70%VO2max)恒定功率车运动,使用CORTEX MetaMax 3B(Biophysik GmbH,Leipzig,Germany)便携式气体代谢分析仪收集运动过程中的氧气(VO2)和二氧化碳(CO2),计算脂肪氧化率并拟合曲线推算FATmax及其对应的运动强度。运动组受试者以FATmax强度进行12周走跑运动训练,对照组不从事任何规律性运动训练。完成最后一次运动训练72 h后,取肘静脉血测试空腹血糖、血脂、血常规和血清C反应蛋白(CRP),测量安静时动脉硬度,同时采用递增负荷运动测试受试者的VO2max。
运动测试前2天,受试者不做任何剧烈运动。测试当日不饮用含咖啡因或酒精饮料,测试前2 h禁食。为了避免生物节律的影响,每名受试者运动测试基本在一天的同一时间(±0.5 h)进行。所有运动测试均在温度和湿度相对恒定的实验室中完成。
1.3 形态学测量
使用电子身体体重计(兴海汇HHTC/ST-300,中国)测量受试者身高和体重后,计算BMI(kg/m2)=体重(kg)/身高(m)2。采用Physion MD高精度肌量仪(Physion Ltd,Kyoto,Japan)测量体脂量与体脂百分比(%FAT)。
1.4 血液指标测试
空腹至少8 h,次日清晨受试者取坐位抽取安静肘静脉血5 ml。采用全自动血液分析仪(XE2100,Sysmex,Japan)测试血常规五分类指标:白细胞总数(WBC),嗜中性粒细胞计数(NEUT)、淋巴细胞计数(LYMPH),血小板计数(PLT),淋巴细胞百分率(%LYMPH),嗜中性粒细胞百分率(%NEUT);,血小板平均体积(MPV),血小板分布宽度(PDW),红细胞分布宽度(RDW)等,并计算嗜中性粒细胞/淋巴细胞数量比值(NLR)、血小板/淋巴细胞数量比值(PLR)。研究表明,NLR和PLR相对经济、易获得,是反映肥胖人群机体炎症状态的敏感指标[11]。
剩余部分血液静置20 min后,3500×g离心20 min,取血清测定CRP、血脂和血糖。采用酶联免疫法测定CRP。酶比色法测定甘油三脂(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白
1.5 动脉硬度(Arterial stiffnneessss,AASS)
欧姆龙BP-203RPEIII动脉硬度检测仪(Colin,Medical Technology,Japan)测量左右两侧上臂-踝脉搏波传导速度(baPWV),取左右侧baPWV平均值反映动脉硬度。baPWV指标已被用于诊断早期动脉硬度[12]。安静室内,受试者取仰卧位休息10 min后,双臂自然放松放置于身体两侧,上肢加压袖带标志线对准肱动脉,下肢加压袖带软管位于脚踝内侧。将测试加压袖带分别捆绑于四肢。双心电(ECG)传感器分别夹住两侧上肢前臂掌侧距腕横纹两横指宽位置,心音图(PCG)传感器放置于第3肋中点处。受试者测试过程中全身放松稳定、均匀呼吸。采用此方法重复测试baPWV结果相关系数r=0.981[13]。
1.6 递增负荷运动测试
热身运动5 min后,受试者进行递增负荷功率车运动测试。 起始负荷为30 W,每2 min增加30 W,受试者保持踏车频率60 rpm直至力竭。Cortex Metamax 3B便携式气体代谢仪分析运动气体代谢变化。VO2max为平均30 s摄氧量的最大值。测试前,根据仪器说明书对气体代谢分析仪进行压力、容量和标准气体校正。采用RS400心率表(Polar,Finland)记录运动心率(HR)。记录每级运动负荷最后10 s主观疲劳感觉(RPE)。满足下列任意3个条件则判定为力竭:(1)运动心率达到最大心率预测值(HRmax=220.年龄)的90%以上;(2)呼吸商(RQ)>1.10;(3)RPE>17;(4)给予鼓励后,受试者仍无法维持60 rpm踏车频率。
1.7 有氧运动方案
FATmax运动强度确定:受试者随机完成30%VO2max、40%VO2max、50%VO2max、60%VO2max和70%VO2max恒定负荷运动。每次恒定负荷运动时间为10 min,踏车频率保持60 rmp,两次恒定负荷运动至少间隔5min,待心率基本恢复至安静水平再进行下一恒定负荷运动。CORTEX Metamax 3B气体代谢仪收集运动中VO2和VCO2,选取各恒定负荷运动后5 min稳态下VO2和VCO2(VO2和VCO2变异系数<10%),依据Peronnet和Massicotte公式[14]计算稳态运动中脂肪氧化率。以运动强度为横坐标,脂肪氧化率为纵坐标制作散点图,拟合二项式曲线确定FATmax及其对应的最大摄氧量百分比(%VO2max),通过FATmax对应的最大摄氧量百分比(FATmax-%VO2max)确定个体运动相应的计数谈话测试(Counting talk test,CTT)值。CTT已被推荐用于监控健康成年人、心血管疾病患者等人群的运动强度[15]。胆固醇(LDL-C)和空腹血糖(Glu),均在全自动生化分析仪(Hitachi,7170,Japan)上进行测试。
根据美国心脏病学会/美国心脏协会实践指南专责组/肥胖协会(AHA/ACC/TOS)公布的控制成人超重与肥胖指南[16],制定12周健身运动训练方案:运动强度为 FATmax,每次运动时间 40~60 min,每周运动 3~5次,通过逐渐增加每次运动时间和每周运动频次,微调运动方案,逐渐达到每周总运动时间200 min。12周运动训练期间,所有受试者保持平常饮食习惯,不进行其他规律性剧烈运动。在运动训练过程中,受试者通过CTT控制FATmax运动强度。为了掌握运动训练方案执行情况,通过咕咚运动+APP软件(成都乐动信息技术有限公司,中国)记录受试者每次运动的路径和时间等情况,并反馈给研究人员加以监督和指导。
1.8 统计学分析
采用SPSS19.0进行数据统计分析。Kolomogorov-Smirnov和Shapiro-Wilk检验数据分布情况,Levene test检验方差齐性。非正态分布数据经自然对数(ln)转换后再予以分析。采用双因素方差(two-way ANOVA)分析两组训练前后指标变化,当主效应出现显着性差异时,组间均值比较采用LSD法。独立样本t检验比较两组受试者基础值。Pearson检验和逐步回归分析baPWV与各指标关联性。数据表示为平均值±标准差(±s)形式,P<0.05为具有显着性差异。
2 结果
所有受试者顺利完成12周实验测试。运动组受试者FATmax运动强度为51.5% ±7.3%VO2max,相应的CTT值(FATmax-CTT)为19.9±4.2。两组受试者训练前体重、BMI、体脂量、体脂百分比、VO2max、baPWV、NLR、PLR和CRP差异无统计学意义(P>0.05)。
2.1 身体形态与机能变化
如表1所示,12周训练后运动组受试者体重、BMI、体脂量、体脂百分比和baPWV均显着降低(P<0.05),VO2max增加(P<0.05);而安静心率和血压无明显改变(P>0.05)。 对照组受试者上述指标无显着变化(P>0.05)。
2.2 血脂与血常规变化
表2显示,运动组血清HDL-C明显升高,而TG、TC和LDL-C水平无明显变化(P>0.05)。 12周后两组受试者空腹血糖(Glu)升高,但基本在正常生理范围内。运动组NLR、PLR、CRP、PLT和RDW等炎症指标均显着降低(P<0.05),LYMPH和%LYMPH显着升高(P<0.05),而WBC略有降低趋势(P>0.05),MPV、PDW和NEUT、NEUT%无显着变化(P>0.05)。对照组受试者PDW、MPV和RDW显着降低(P<0.05),其余血液学指标没有显着性变化(P>0.05)。
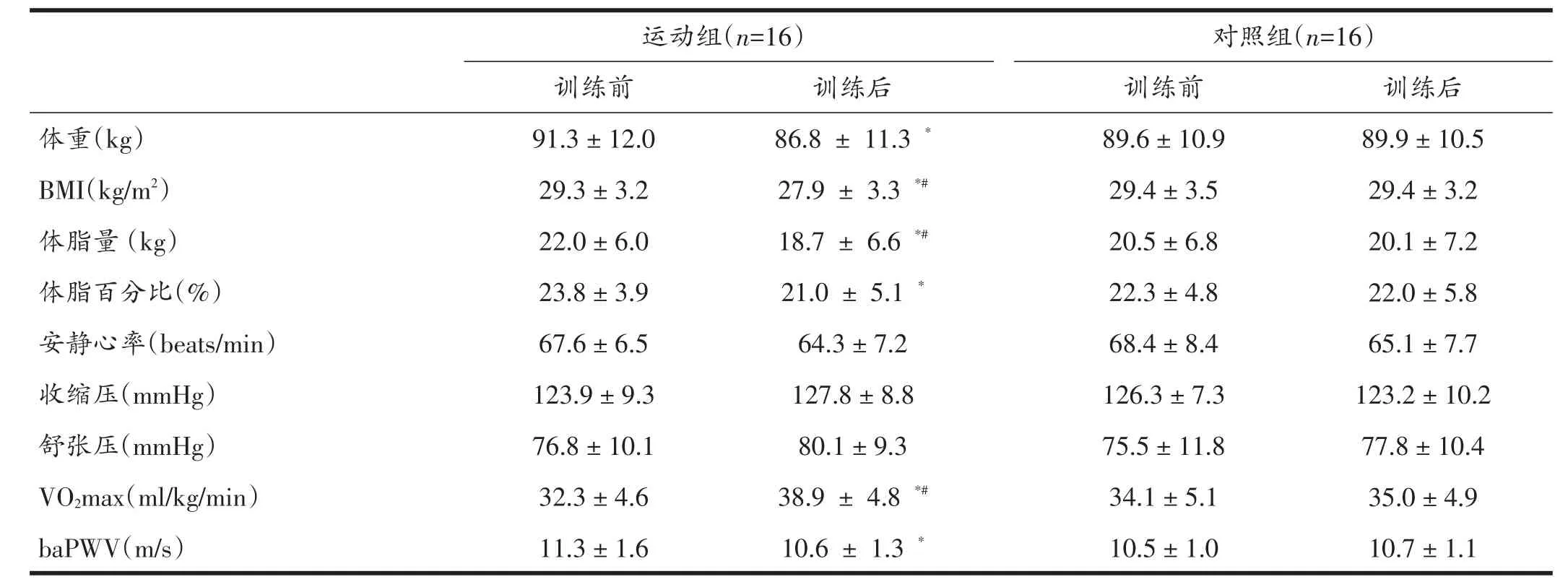
表1 两组训练前后形态学和功能指标变化
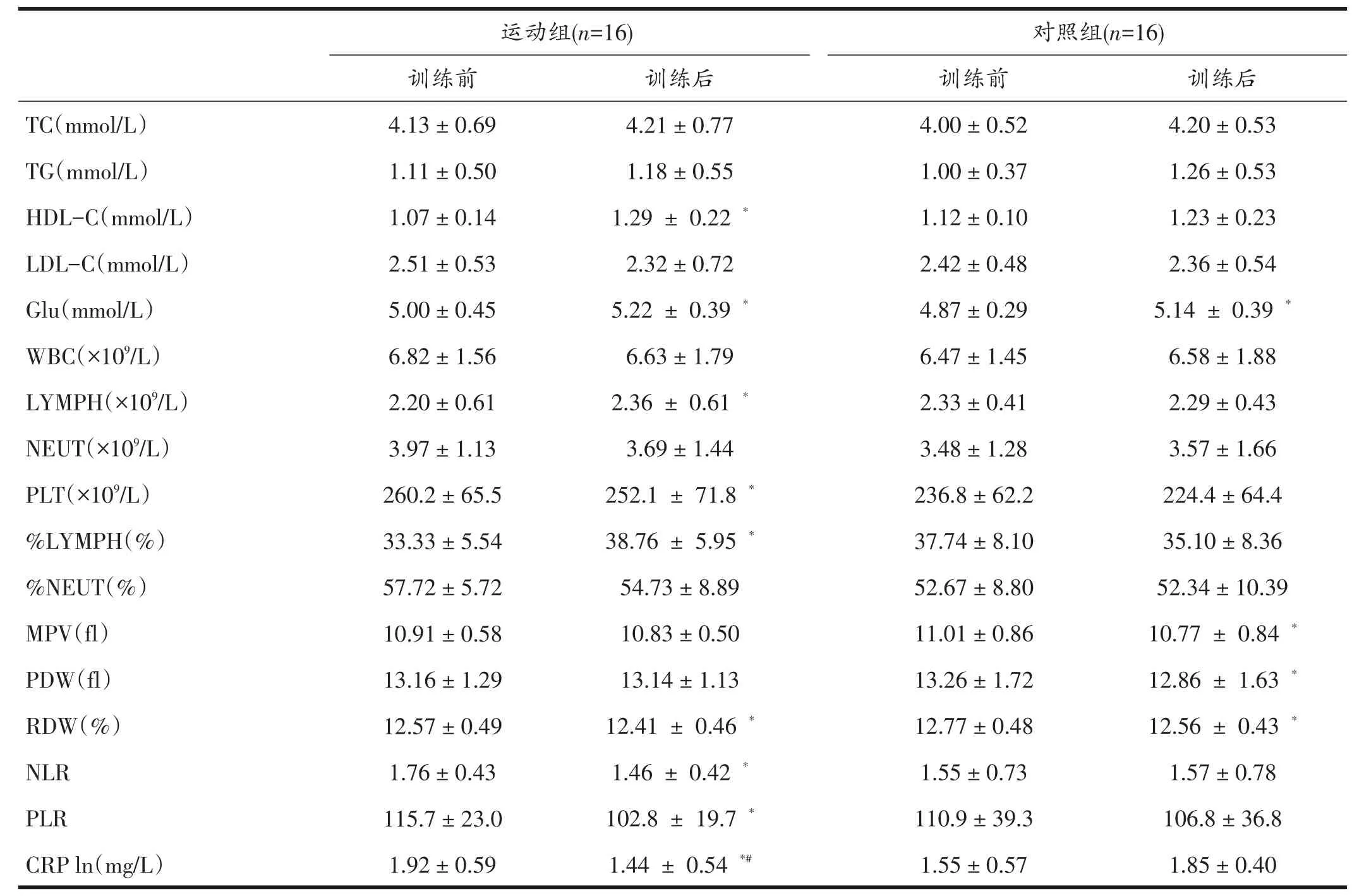
表2 两组训练前后血液学指标变化
2.3 相关分析
表3为训练前后baPWV变化量(△baPWV)与主要指标变化量相关性分析结果(n=32)。Pearson相关分析表明,△baPWV与△体重、△BMI、△体脂量、△体脂百分比、△WBC、△NLR、△PLR和△CRP ln呈正相关关系(P<0.05),与△VO2max呈负相关关系(P<0.05)。逐步回归分析发现,CRP与VO2max是训练前后baPWV变化的重要影响因素(表3)。另外,△CRP与△体重(r=0.457)、△BMI(r=0.487)、△体脂量(r=0.380)呈正相关关系(P<0.05,n=32),△NLR 与△体脂量(r=0.465)、△体脂百分比(r=0.384)密切相关(P<0.05,n=32)。
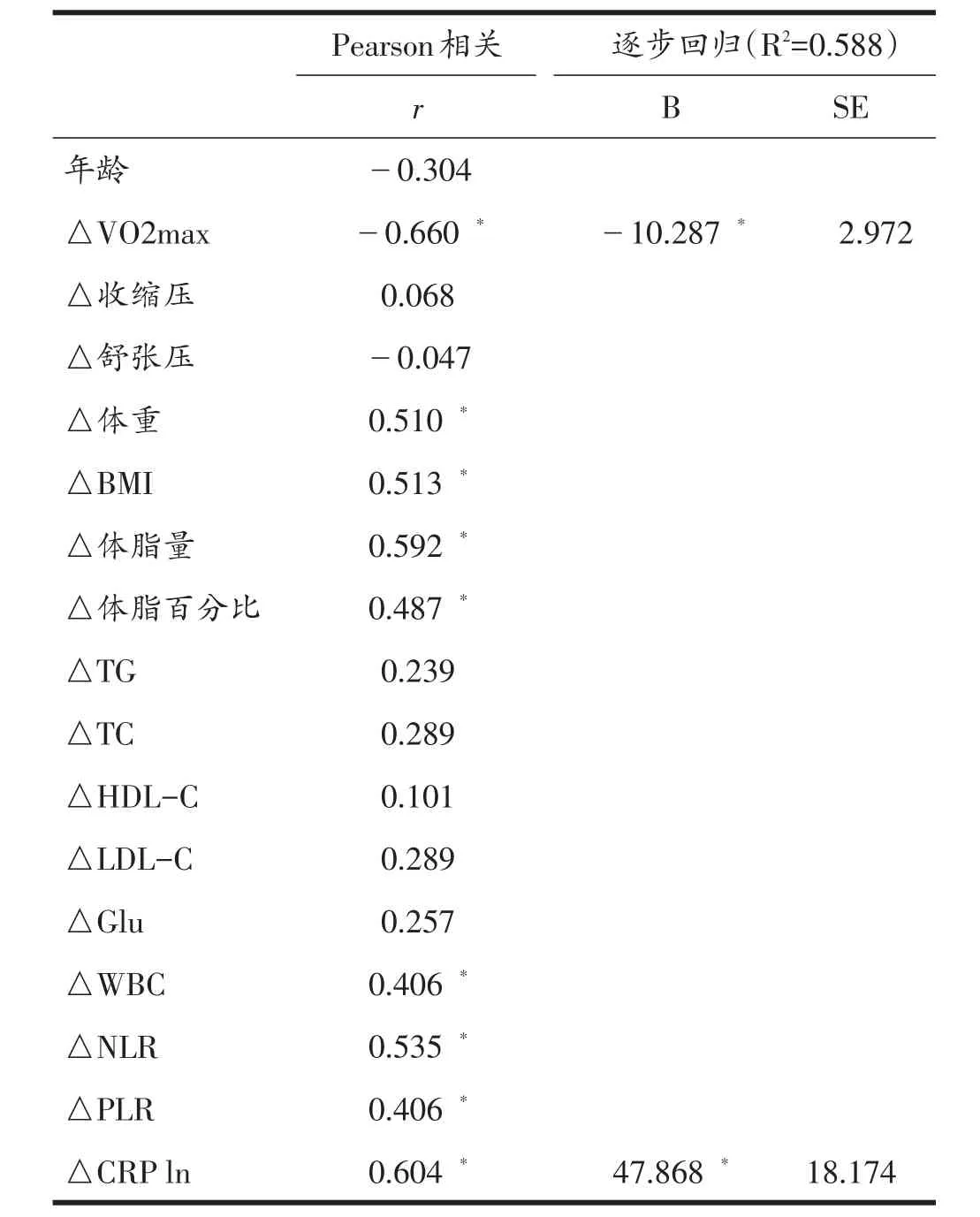
表3 训练前后baPWV变化与各指标变化相关分析(n=32)
3 讨论
研究显示,无任何体征的肥胖青年男子颈动脉与上臂动脉硬度明显高于正常体重和超重个体[5]。动物实验也发现,高脂高糖膳食诱导的肥胖小鼠,其PWV较正常膳食组小鼠高2.4倍[17]。少年时期的肥胖个体进入成年后动脉硬度将明显增高[18]。随着年龄增长,血管壁弹性蛋白和胶原蛋白改变引起动脉硬度增加,肥胖或体脂增多可能又加快了这一进程[18]。
横向研究表明,身体活动水平与动脉硬度呈负相关关系[18]。Meta分析发现,长期有氧运动后VO2max升幅越大,PWV降低越明显[19]。与Jung等[20]研究报道相似,本研究发现12周FATmax强度运动后受试者VO2max与baPWV变化量呈负相关。提示提高身体活动水平可减缓动脉硬度发展进程,降低心血管事件风险。
目前有氧运动训练对肥胖人群动脉硬度的影响仍存在争议[8],可能与运动训练强度、动脉硬度测评方法、受试者健康体适能水平等不同有关[8,21]。Yuan等[6]报道8周中等强度游泳运动使超重青年男子体脂量降低,动脉硬度改善。采用单纯性限制能量摄入或有氧运动结合限制能量摄入方式也能引起体重下降,PWV降低[22]。提示减脂降体重可能有益于动脉硬度改善。FAT-max运动强度略低于个体乳酸阈,是促进脂肪氧化的理想运动强度[9]。在本研究中,12周FATmax强度(51.5% ±7.3%VO2max)运动后,受试者体脂量明显降低,baPWV降低,而且训练后体重、体脂量下降越大的个体,baPWV降幅越显着。然而最近一项研究发现,有氧运动、限制能量摄入或二者组合干预方式引起超重成年人体重(~7%)和体脂(~15%)同等量降低,受试者的PWV均呈下降趋势但无统计学意义[23],这可能与样本量较低有关。有待更为严谨的随机对照试验予以验证。
脂肪组织是慢性低度炎症的重要致炎因素。内脏脂肪组织浸润,伴随巨噬细胞激活和血管促炎细胞因子表达升高[24]。这种促炎状态可激发活性氧(ROS)产生,降低血管平滑肌细胞和内皮细胞NO合成酶活性,抑制NO产生并促进内皮细胞凋亡[25]。可见,炎症在促发血管硬化过程中起着重要作用。研究发现,四氢生物蝶呤辅助因子(BH4)是抵抗心血管因炎症引起内皮功能紊乱的重要机制[26]。机体炎症引起NO生物活性降低,也可能与BH4低表达引起内皮型NO合成酶(eNOS)脱耦联有关[27]。规律性运动可通过BH4调节心血管抗炎症或抗氧化剂表达,从而改善动脉硬度[27]。虽然本研究并未观察12周运动前后BH4水平变化,但是我们发现运动后受试者血液CRP、NLR、PLR等炎症指标明显下降,且与baPWV降低量呈正相关关系(表3)。另外,规律性有氧运动也可能通过抑制核转录因子КB(NFКB)信号途径下调炎症因子,降低主动脉硬度[28]。炎症因子下调可能使血管NO生成增多,改善动脉扩张性和内皮功能[29]。已有研究发现,12周走跑运动后超重/肥胖男子PWV降低,血浆氮氧化物(NOx)升高[30],长期快步走运动后血清NOx上升越高的超重成年人,PWV降低越显着[7]。这也佐证了本研究结果,提示12周有氧运动后baPWV降低可能与炎症水平降低、内皮功能改善密切联系,但尚需深入研究。
本研究逐步回归分析发现,VO2max和CRP是训练后baPWV改变的重要影响因素,但回归系数r2=0.588相对较低。这表明12周FATmax强度运动后baPWV下降还可能与其他因素存在关联。研究报道,低强度有氧运动可降低或减弱肥胖导致的交感神经兴奋性增强、血压增高、心动过速等不良反应,这些因素改变对降低动脉硬度有着积极性影响[8]。与先前研究相似[7],本研究运动训练前后受试者安静血压、安静心率均无明显改变(基本在正常范围波动)。本研究未观察运动训练前后心脏自主神经功能的变化情况,但是前期研究发现,16周中等强度有氧运动引起超重/肥胖成年人副交感神经功能增强,抑制交感神经兴奋性[31]。在本研究中,运动训练后受试者baPWV降低是否与有氧运动训练后交感神经功能受抑制有关,值得进一步探讨。
本研究也支持并验证了早期研究报道[10],发现FATmax(51.5% ±7.3%VO2max)强度有氧运动能够改善超重/肥胖青年男子身体成分、血脂代谢、心肺适能和动脉硬度,提示FATmax强度是减脂控体重的有效运动强度。本研究相关性分析(表3)仅表明,FATmax强度运动改善动脉硬度与体重降低、炎症因子下调等因素相关,这并非是一种因果关系。有氧运动改善动脉硬度的相关复杂机制尚需后续大样本研究予以验证。Meta分析结果表明,与中等强度运动相比,低强度有氧运动对肥胖者动脉硬度改善更具有积极性作用[8]。因此,优化运动强度、运动形式和运动量,预防或减缓超重/肥胖青年动脉硬化发展进程仍是今后研究重点。另一方面,本研究训练后△NLR、△PLR分别与△baPWV密切关联,提示早期观测NLR、PLR水平变化可能将有助于了解超重/肥胖人群血管健康变化情况。
4 总结
FATmax强度运动是改善超重/肥胖青年男子动脉硬度的重要方式。有氧运动后动脉硬度改善与体脂降低、炎症水平下调、心肺适能(VO2max)增高关系密切,相关机制有待今后深入研究。



