王贵平 张庆 万忠晓 申晋波 张林
1 苏州大学体育学院(江苏苏州215123)
2 苏州大学医学部(江苏苏州215123)
3 运城学院体育系(山西运城044000)
瑜伽因其具有减压和促进健康的功效,成为全球范围内最热门的运动项目之一。瑜伽修习的方法包含体式练习(asana)、呼吸控制(pranayama)、静坐入定(Dhyan)及冥想凝思(dharana)[1]。长期进行规律的瑜伽练习可以提高人体免疫系统[2]和心血管系统[3]功能,并有效降低慢性炎症反应[4]。Clay等[5]的研究发现,一次哈他瑜伽练习只可分别增加最大摄氧量(VO2max)、代谢当量、心率以及最大心率百分比,远不及中等速度步行所带来的改变[6]。而长期运动对机体带来的适应和益处是机体对单次运动所产生反应的累积结果。仅仅通过上述观测指标很难发现一次瑜伽练习对炎症反应及心血管生理状态所产生的具体影响及其可能机制。
已知长期瑜伽练习可增强免疫功能,降低炎症反应相关细胞因子的水平[7]。Toll样受体(toll-like receptors,TLRs)在其中起着关键作用,尤其是TLR2和TLR4[8]。内质网(endoplasmic reticulum,ER)是细胞感受应激刺激的重要装置。氧化应激、缺血和钙离子失衡等刺激因素,均会破坏蛋白质折叠的反应,导致未折叠蛋白或折叠错误的蛋白质聚集在内质网内,称为内质网应激(ERS)[9]。ERS 可通过诱导葡萄糖调节蛋白(glucose regulated protein 78 kD,GRP78)产生保护效应,又可直接介导细胞的凋亡、损伤和适应[10]。其与炎症反应存在相互影响,ERS可以影响炎症反应通路,促进白介素(interleukin,IL)-1β、IL-6 和肿瘤坏死因子(tumor necrosis factor,TNF)-α的表达[11],反过来炎症反应可诱导ERS,促炎症反应因子同样可以通过下调内质网分子伴侣,如葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、X-盒结合蛋白1(X-box binding protein 1,XBP1)和CCAAT 增强子结合蛋白同源蛋白(CCAAT enhancer-binding protein homologous protein,CHOP),从而诱导内质网应激的发生[11]。研究发现,一次长时间剧烈运动通常伴随着免疫激活的出现和运动后持续3~24 小时的炎症反应,且发生的程度取决于不同的运动强度和持续时间[12]。不同的运动方式可对ERS 产生不同的影响,且具有组织特异性[13-15],但尚无研究探讨一次瑜伽运动对ERS的影响。一次瑜伽练习通常被认为是一次中等强度有氧运动[6],其会如何影响健康人群体内的炎症反应过程仍有待探讨。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)主要包括单核细胞和淋巴细胞,通常可作为细胞先天免疫和适应性免疫代表。本研究通过检测PBMCs 中ERS 标志物,分析一次瑜伽练习对炎症反应的影响是否与ERS有关。
内皮功能障碍在心血管疾病等炎症相关疾病中起着重要作用。内皮微粒(endothelial microparticles,EMPs)是内皮细胞受到诸如炎症反应等刺激后分泌的复杂的泡状结构[16],内皮细胞分泌不同的内皮微粒,其中内皮微粒CD62E+代表内皮炎症激活,而CD31+/CD42b-代表内皮细胞凋亡[17],内质网应激可以诱导内皮细胞凋亡及相关疾病。运动通过复杂的血流动力学影响增加血管壁的剪应力(或称剪切应力),后者作为有效生理刺激,促进一氧化氮(NO)的释放,从而影响内皮功能[18]。NO 是内皮细胞释放的舒血管物质,对维持内皮功能稳定性起着关键作用。急性运动可以造成血管内皮发生一系列急性变化[19],而长期规律运动则可使血管功能及结构出现适应性变化[20]。与传统的有氧运动相比,瑜伽体式包含大量肌肉等长收缩和离心收缩动作,结合瑜伽的呼吸配合,可使机体心血管功能受到更大的影响[21,22]。本研究检测一次瑜伽练习后血管内皮功能的变化,探讨这些变化与炎症反应及内质网应激的关系,分析瑜伽运动对内皮功能的急性影响与长期瑜伽练习有益作用存在何种联系。
1 研究对象与方法
1.1 研究对象
招募苏州大学健康女性青年15 名(年龄18~25岁),BMI 指数18.5~22.9 kg/m2,通过问卷调查了解病史与运动史。受试者自我报告身体健康,月经规律,实验期间均处于黄体期(为避免不同周期激素水平的干扰,将招募到的受试者进行筛选,最终符合实验要求的共15人),无烟酒嗜好,无服药史,无呼吸系统、心血管系统、免疫系统疾病,无骨骼肌肉疾病,无过敏反应史。受试者于实验前两个月内均未进行规律运动,并要求实验前48 小时不参与运动。本研究遵守赫尔辛基宣言的规定,并得到苏州大学人类研究和伦理委员会的批准,所有参与者都签署知情同意书。
1.2 实验设计
本实验采用平行随机对照法。受试者在专业教练的指导下进行一次瑜伽练习(60 分钟),包括呼吸练习(5分钟)、冥想练习(5分钟)、坐位体式练习(15分钟)、站立体式练习(15 分钟)、仰卧和俯卧体式练习(15 分钟)和放松练习(休息术,5分钟),体式以初级为主,并包含一套热身体式太阳敬礼式(Surya Namaha)序列(中级)的练习。受试者均完整参与本次瑜伽练习,并在练习中较好地跟从教练的指导。分别于瑜伽运动前24 小时以及瑜伽练习后即刻采集肘前静脉血20 ml,保存于EDTA抗凝管中。
1.3 指标检测
1.3.1 血液样品制备
14 ml 血液在4℃、1500 转的条件下离心10 分钟,血浆立即冻存于-80℃冰箱,待后期对血浆细胞因子包括IL-6、IL-8、IL-1β、单核细胞趋化蛋白(Monocyte chemoattractant protein,MCP-1)和TNF-α;以及血浆EMPs进行批量分析;1 ml血液用于全血培养。分离出的PBMCs 用于后续内皮微粒和TLR2、TLR4、CHOP、GRP78及XBP1表达的检测。
1.3.2 实验材料
LPS(cat# L6529-1)从Sigma 公司采购。检测IL-6、IL-8、IL-1β、MCP-1和TNF-α 的抗体从Merk Millipore 公司采购。Pam(cat#tlrl-pms)从InvivoGen 公司采购。人IL-6(cat#DY206)、IL-1β(cat#DY201)、TNFα(cat#DY210)、内皮型一氧化氮合酶(eNOS)(cat#DY008)的ELISA 试剂盒,以及NO(KGE001)试剂盒从R&D system 公司采购。抗体CD42b-PE(cat#555473)、CD31-FITC(cat#555445)、CD62E-APC(cat#551144)从BD Biosciences 公司采购。其他试剂均购自Sigma公司。
1.3.3 全血培养
使用无血清的RPMI-1640(青霉素100 U/ml、链霉素100 μg/ml)培养基将全血1︰10 进行稀释(即540 μl 全血在4.86 ml 培养基中稀释),分成两份加入24 孔板共600 μ-l,分别加入TLR4 激动剂LPS(10 ng/ml)和TLR2激动剂Pam3Cys-SK(10 ng/ml)[23],放入37°C 培养箱内(5%二氧化碳)24 小时。使用离心机4℃、2000转离心15分钟,收上清,保存在-80℃冰箱,待后期使用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)进行细胞因子和eNOS 的批量检测。使用硝酸盐还原酶法测定NO 含量。重复实验变异系数(CV)<5%。
1.3.4 血浆EMPs检测
使用流式细胞仪检测血浆中的EMPs[24]。将离心后冻存的血浆放在室温下解冻20分钟,1500转离心15分钟,将三分之二的上清再次以1500 转离心15 分钟,获得去血小板血浆。取100 μl 上清使用荧光标记抗体(分别为PE-CD42b、FITC-CD31、and APC-CD62E)避光4℃孵育20分钟。接着使用93 -l的2%多聚甲醛固定样品,0.2 μM 无菌过滤PBS 稀释至200 μl。最后使用贝克曼库尔特公司(Beckman Coulter,USA)的FC500流式细胞仪进行检测。
1.3.5 BMCs分离
使用淋巴细胞分离液(Ficoll-Paque Plus),应用梯度密度离心法从血液中分离单核细胞[12]。取5 ml血液倒入5 ml Ficoll-Paque Plus 所在的15 ml 离心管中,20℃800 转离心15 分钟。回收PBMCs 层,用无菌PBS室温250 转漂洗3 次,每次10 分钟。将分离出来的PBMCs 储存在-80℃冰箱,待后续使用PCR 测定mRNA表达。
1.3.6 实时定量PCR
使用RNeasy 试剂盒从PBMCs 中提取RNA。使用SuperScript Ⅱ逆转录酶、寡核苷酸(dT)、dNTP 和总RNA合成cDNA。使用Applied Biosystems公司的7500快速实时荧光定量PCR 仪。将样品分成两份放在96孔板中,每孔20 μl 总量包含:1 μl 样品、1 μl cDNA模板、10 μl PCR 反应体系和8 μl 纯水,使用18s rRNA 作为内参。根据试剂盒说明进行测试。测试结果使用2−ΔΔCT方法进行计算。使用的引物如下:GRP78: Hs00607129_gh; CHOP: Hs00358796_g1;TLR2:Hs01872448_s1;TLR4:Hs00152939_m1。
1.3.7 蛋白免疫印迹法
使用RIPA buffer(50 mM Tris-HCl、150 mM Na-Cl、0.1% SDS、0.2% sodium azide、1% Triton X-100、0.25% sodium deoxycholate 及1×蛋白酶抑制剂)将PBMCs 溶解,在冰上孵育1 小时,随后4℃16000 转离心5 min,收上清,应用BAC 法进行蛋白定量。根据蛋白浓度,将样品、SDS-PAGE蛋白上样缓冲液(6×)和双蒸水按比例加入EP 管中混匀,99℃充分变性10 min,冷却后置于-80℃冰箱保存。采用免疫印迹法测定TLR2、TLR4、CHOP、GRP78及XBP1蛋白表达量。使用β-actin作为内参。
1.4 统计学分析
所有数据以均数±标准差表示。运动前后的数据分析使用配对样本t检验统计方法,P<0.05为差异具有统计学意义。
2 结果
2.1 一次瑜伽练习对血液中促炎症细胞因子、NO 及eNOS和EMPs的影响
表1 和图1 显示,运动后血浆中IL-8、MCP-1 和TNF-α均显着升高(P<0.05),NO 和eNOS 水平均显着升高(P<0.05)。运动后血浆中内皮微粒CD31+/CD42b-水平显着升高,而CD62E+水平则显着降低(P<0.05)。
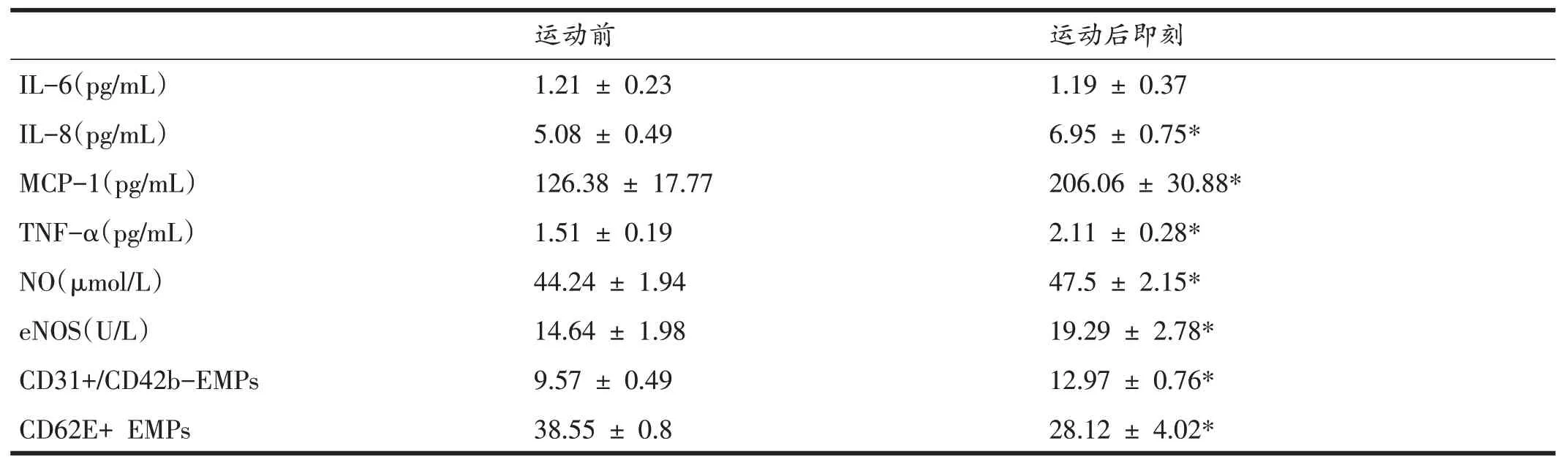
表1 一次瑜伽运动前后血浆中细胞因子、NO及eNOS和EMPs水平的变化(n=15)
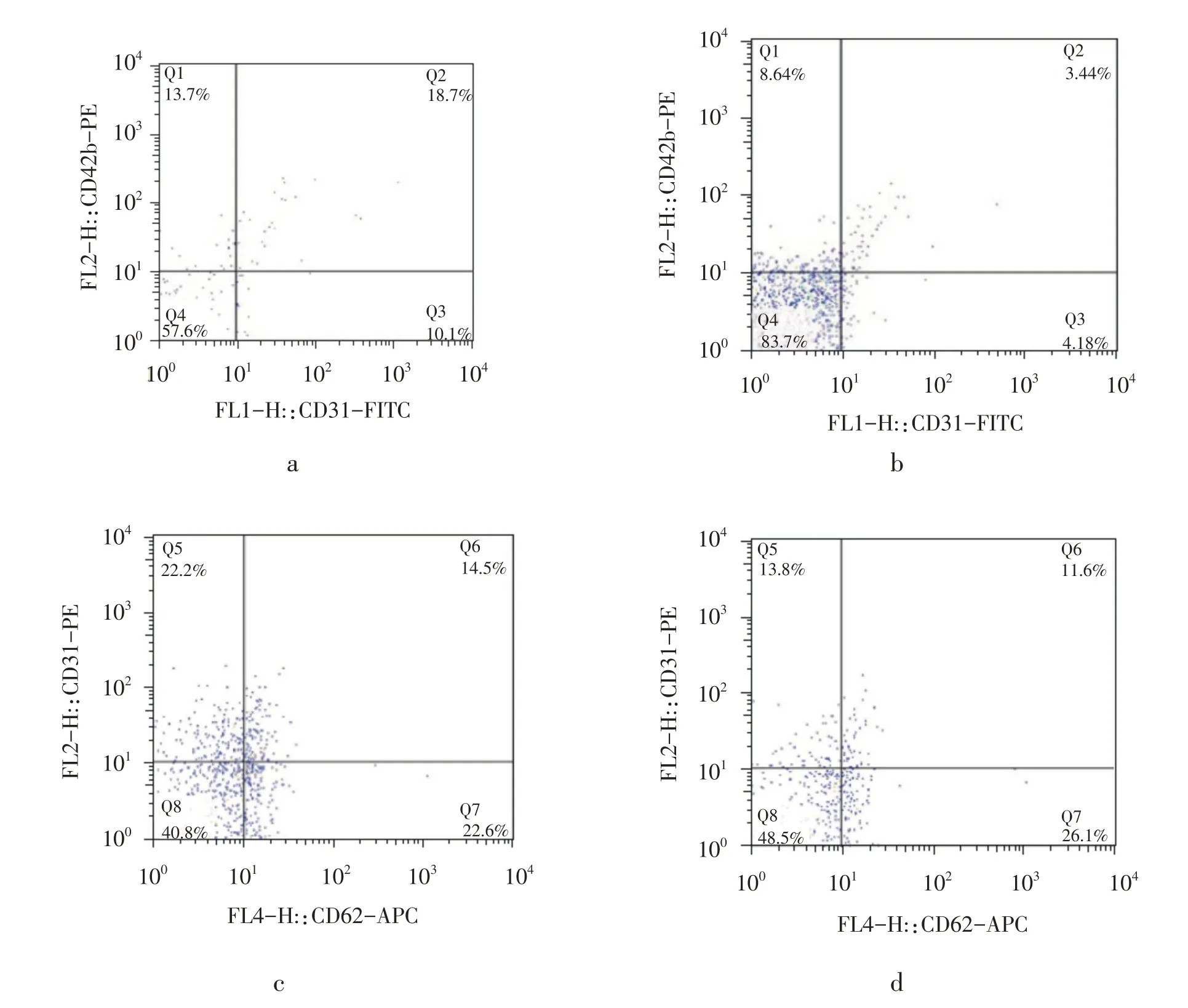
图1 应用流式细胞仪测定一次瑜伽运动前后EMPs水平的变化
2.2 一次瑜伽练习对促炎症细胞因子的影响
运动后,加入刺激剂LPS(1 和10 ng/mL)和Pam3Cys-SK4(1 和10 ng/mL)后培养的全血以及未加刺激剂培养的全血,其上清中细胞因子IL-1β和TNF-α的水平均显着增加(P<0.05,图2a、2b)。只有当刺激剂Pam 的浓度达到10 ng/ml 时,IL-1β 的水平在运动前后未发生显着性变化(P>0.05,图2a)。IL-6 的水平也较瑜伽运动前呈现出上升的趋势,但无显着性变化(P>0.05,图2c)。
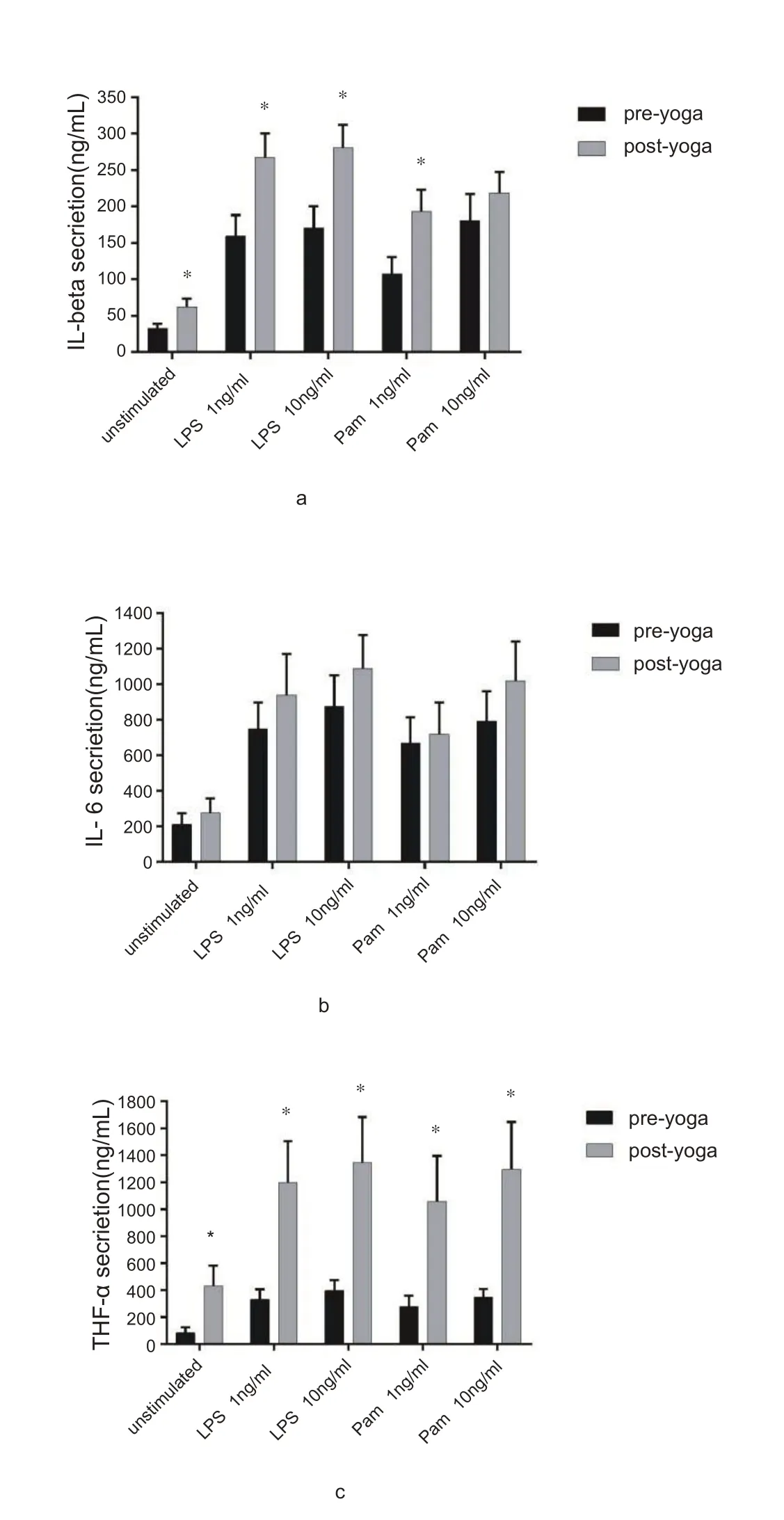
图2 培养的全血中炎症细胞因子IL-1β、TNF-α和IL-6水平的变化
2.3 一次瑜伽练习对PBMCS 中TLR2 和TLR4、以及ER应激标志物CHOP、GRP78和XBP1的影响
运 动 后PBMCs 中TLR2、TLR4、CHOP 和GRP78 mRNA 的表达水平显着升高(P<0.05,图3),蛋白表达水平显着升高(P<0.05,图4)。
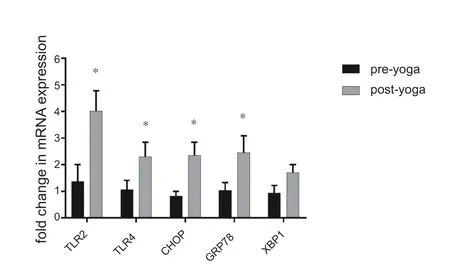
图3 PBMCs中TLR2、TLR4、CHOP 、GRP78和XBP1的mRNA表达水平变化
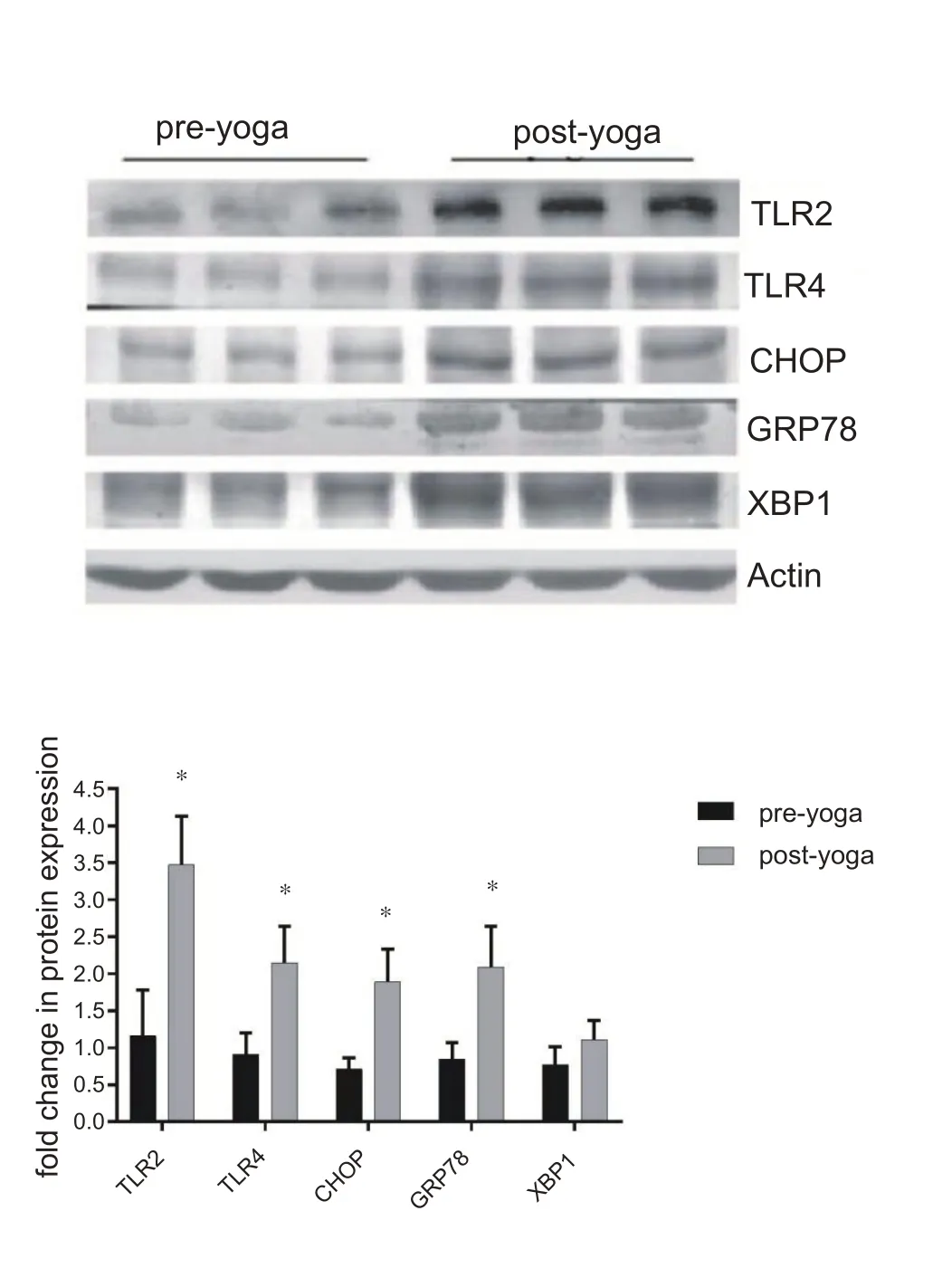
图4 PBMCs中TLR2、TLR4、CHOP 、GRP78和XBP1的蛋白表达水平变化
3 讨论
研究证明,一次急性运动可显着诱导健康个体的炎症反应[25,26]。本研究观察到瑜伽练习后即刻IL-8、MCP-1和TNF-α水平升高,同时,运动后体外培养的全血中IL-1β和TNF-α水平升高,表明单次瑜伽运动诱导炎症反应相关标记物。瑜伽除包含体式练习外,还强调呼吸配合和冥想练习,后者往往被认为有助于减少炎症和压力[7,27]。本研究提示,一次瑜伽运动诱导炎症反应,可能与受试者均为瑜伽新手有关,其未能完全适应本次瑜伽练习的强度并掌握瑜伽的呼吸方法。此外,分别加入TLR4 激动剂LPS(10ng/ml)和TLR2 激动剂Pam3Cys-SK 后培养的全血中,IL-1β和TNF-α的水平明显增加,可能与瑜伽运动后即刻TLR2 和TLR4 的mRNA 和蛋白水平的表达增加具有相关性。TLR 信号通路在介导单核细胞和巨噬细胞参与免疫应答及炎症反应的过程中发挥着关键作用[28]。急性运动对TLR2和TLR4 的影响机制尚不明确。McFarlin 等[29]发现,无论是经过训练的还是未经训练的老年女性在一次急性抗阻运动后,TLR4的表达不会发生显着变化;Lancaster[8]和Simpson[30]等的研究发现,一次有氧运动可下调TLR2 和TLR4 的表达和功能;而Booth[31]和Light[32]等发现一次长时间的有氧运动可以上调TLR2和TLR4的表达。综上提示,不同的运动方式、运动强度、持续时间及受试者是否经过训练,都可能会对TLRs产生不同影响。而一次瑜伽练习后与TLRs 相关的急性炎症反应对机体的免疫功能是否有益仍值得探讨。目前国内外尚无瑜伽练习对炎症反应急性影响的相关报道,而运动后出现的炎症反应状态也受到多种因素共同作用,因此未来还需通过更多的炎症反应标记物来探究瑜伽运动后即刻炎症反应的机制。
ERS 是细胞的一种保护性应激反应,可减少细胞内蛋白的异常聚集,只有大量的或持续时间过长的ERS 诱导细胞凋亡。未折叠蛋白反应(unfolded protein response,UPR)可缓解ERS,下调其相关标记物,当无法缓解ERS时,UPR将趋向介导细胞凋亡,因此UPR与许多炎症反应和应激信号通路密切相关[33]。人群研究发现,长期规律运动可减少ERS标记物水平,改善与内质网应激相关的炎症反应[13],而短期的运动训练[14]和急性运动[15]可诱导ERS 标记物的产生。且运动对ERS的影响具有组织特异性[33],如一次中等强度的有氧运动可以增加肝脏GRP78 的表达,但未增加心肌中的表达[34]。PBMCs是反映机体外周炎症细胞因子及炎症相关疾病的重要生物标志物[35]。在本研究中,一次瑜伽练习显着上调PBMCs 中ERS 标记物CHOP 和GRP78 mRNA和蛋白水平,而XBP1在mRNA和蛋白水平并未发现显着变化。UPR 的三种途径均可诱导CHOP 表达,因此CHOP 表达增强常作为UPR 反应的一个指标[15]。本研究提示一次瑜伽运动可通过UPR 途径诱导ERS 标志物。另外,内质网应激是激活炎症反应通路的方式之一,XBP1 可增加GRP78 的转录,增加蛋白质的折叠能力,本次瑜伽练习引起UPR通路活化的同时,也诱导炎症反应,这些结果相互印证。单次瑜伽练习对ERS的急性影响是否对规律练习瑜伽的长期益处有帮助仍不清楚,一次瑜伽运动后ERS 对炎症状态和免疫功能的影响机制值得进一步研究。
瑜伽包括大量扭转、伸展、肌肉的等长收缩以及呼吸技巧和冥想,长期练习可能对机体的血管功能产生积极的潜在影响,有助于预防代谢疾病及心血管疾病的发生[21,22,36]。NO是血管功能的重要调节因子和维持内皮稳定的关键,内皮型一氧化氮合酶(eNOS)诱导的NO 生物利用率降低是血管内皮功能障碍的特征之一[37]。本研究中瑜伽练习后NO 和eNOS 的水平均上调,表明一次瑜伽运动可有效增加血管剪切应力,对血管功能具有积极作用。内皮细胞受到急、慢性应激刺激或凋亡时释放EMPs,其中CD62E+和CD31+/CD42b-分别是内皮炎症激活和凋亡的标志物,可作为判断血管系统功能状态的指标[17,38]。研究发现,8周哈他瑜伽练习可下调CD31+/CD42b-水平[24]。急性运动也可对血管内皮功能产生影响,但研究结果具有很大差异。Serwiente 等[39]发现一次30 分钟的跑台运动可显着提高绝经后妇女内皮微粒CD31+/CD42b-和CD62E+的水平;久坐的成年人和冠心病患者在进行急性高强度间歇运动后,其CD31+/CD42b-水平并未发生改变[12]。研究结果的不一致可能与受试者的生理和代谢状况以及急性运动方式、强度等因素有关,肥胖等代谢综合症及心血管疾病人群的EMPs 基础值高于健康人群[40]。运动对血管功能的影响受到多种因素的共同作用,Durrer等[19]认为,EMPs 对急性运动的反应具有显着的性别差异,其发现急性高强度运动后肥胖女性CD31+/CD42b-水平未发生改变,CD62E+水平显着升高,而肥胖成年男性CD31+/CD42b-和CD62E+水平均显着下降。因此为排除雌激素的干预,本研究在招募受试者时增加了月经周期作为入选条件(详见方法部分)。本研究中一次瑜伽运动后即刻健康女性CD31+/CD42b-水平显着升高,CD62E+显着下降,凋亡水平升高,炎症激活程度下调。结合NO具有抑制内皮细胞炎症反应的作用[41],提示内皮细胞对本次瑜伽运动产生的应答反应可能是长期瑜伽练习对血管功能积极作用的组成部分。
4 总结
本研究发现:1)一次瑜伽运动后健康女性青年血液中炎症细胞因子和EMPs水平上调;2)瑜伽运动后分别加入TLR4 激动剂LPS(10 ng/ml)和TLR2 激动剂Pam3Cys-SK后培养的全血中,促炎症细胞因子的水平上调;3)一次瑜伽运动影响健康女性青年的内质网应激功能。一次瑜伽运动可诱导ERS相关的炎症反应及内皮功能变化,对健康女性青年的免疫功能及血管功能可产生急性影响。



