何 文,刘 贝,郭咸希
(1.武汉大学人民医院药学部;2.武汉大学药学院,湖北 武汉 430060)
不同取代度的寡聚精氨酸壳聚糖的合成与鉴定
何 文1,刘 贝2,郭咸希1
(1.武汉大学人民医院药学部;2.武汉大学药学院,湖北 武汉 430060)
目的 合成不同分子量、不同取代度的寡聚精氨酸壳聚糖(CS-PR),并对其化学结构及取代度进行鉴定。方法 用高分子量壳聚糖(HCS)、低分子量壳聚糖(LCS)和寡聚精氨酸(R9)为主要原料,通过改变反应物的摩尔比,合成不同取代度 CSPR,应用FTIR及1H-NMR对其结构及取代度进行分析。结果 通过改变反应物的摩尔比,获得了取代度为 0.96和 1.87的HCS-R9,以及取代度为2.61和10.10的 LCS-R9。结论 不同分子量不同取代度的 CS-PR合成成功,为进一步实验奠定了基础。
壳聚糖;寡聚精氨酸;合成;分子量;取代度
壳聚糖(chitosan,CS)是一种天然聚阳离子多糖,具有良好的生物降解性和生物相容性,是自然界唯一的碱性多糖,且来源广泛,为地球上仅次于纤维素的第二大再生资源。CS分子不溶于一般的有机溶剂和水,在一定程度上限制了它的广泛应用。利用 CS重复单元上的氨基,可对其进行化学改性,制备出具有不同理化特性的 CS衍生物,一方面可改善它们的溶解性能,更重要的是不同取代基的引入可赋予 CS更多的功能,从而延伸了 CS的应用领域和范围。研究[1-3]表明:CS及其衍生物可促进药物的透皮吸收,其效果甚至优于同浓度的氮酮。
细胞穿透肽(cell penetration peptides,CPP)是由10~30个氨基酸组成的短肽,可携带多种物质进行细胞间或细胞内传输,是一种新型的不引起细胞膜永久性损伤的载体,目前在细胞生物、基因治疗学及制药工程领域均显示巨大的研究价 值[4-5]。CPP是以氨基酸为单位,多含有带正电荷的精氨酸和赖氨酸,带有大量的正电荷。本实验所选用的具有细胞穿透肽的一般性质。近年来,有研究尝试将CPP作为透皮吸收促进剂用于透皮给药系统中。CPP通过干扰紧密的角质层结构,促进药物的透皮吸 收[6-9]。
本实验室前期将高分子量的壳聚糖(high molecular weight chitosan,HCS)与精氨酸九聚体(nonaarginine,R9)进行化学结合,即以HCS为载体,氨基侧链采用亲水性基团 R9进行修饰,已成功合成HCS-R9,并初步验证了其透皮吸收促进作用。本实验拟选用 HCS及低分子量的壳聚糖(low molecular weight chitosan,LCS),并通过调节 CS与 R9的摩尔比合成不同取代度的 CS-R9,为后期考察 CS分子量、取代度等因素对 CS-R9透皮吸收促进作用的影响奠定基础。
1 仪器与材料
1.1 仪器 TG328A电子分析天平(上海天平仪器厂);RE-52C旋转蒸发仪(上海亚荣生化仪器厂);Alpha-4冷冻干燥机(德国Martin Christ);HJ-3恒温磁力搅拌器(江苏金坛医疗仪器厂);HH.S精密恒温水浴锅(江苏金坛医疗仪器厂);A-VATAR360傅立叶红外光谱仪(美国Thermo Nicolet公司);Varian unity-600核磁共 振 谱仪 (美国 Varian公 司);ZKF030电热真空干燥箱(上海实验仪器厂);透析袋(MW8000-14000,USA)。
1.2 试药 HCS(MW 5.9×105,DD≥95%,国药集团化学试剂有限公司,批号:20121112);LCS(MW 5.0×104,DD≥85%,浙江金壳药业有限公司,批号:D130531089);R9(95%,委托南京金斯瑞公司合成);N-羟基硫代琥珀酰亚胺(NHS,分析纯,国药集团化学试剂有限公司,批号:20120830);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl,99%,上 海 共 价 化 学 科 技 有 限 公 司,批号:20121009);二碳酸二叔丁酯(Boc,国药集团化学试剂有限公司,批号:20121210);氧化氘(国药集团化学试剂有限公司,批号:20120220);氘代乙酸(北京百灵威科技有限公司,批号:LS30N38)。
2 方法
2.1 CS-R9的合成[10-11]本实验的合成思路如图1。基本思路是 R9的羧基经 EDC和 Sulfo-NHS的活化与 CS的氨基发生反应,反应在室温下进行。
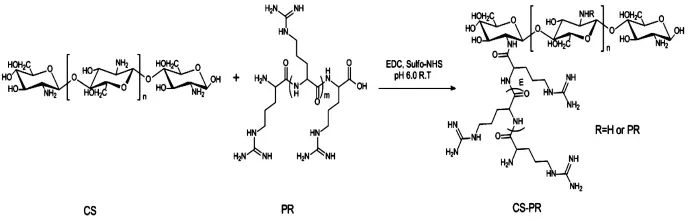
图1 CS-PR的合成路线
2.1.1 低取代 HCS-R9的制备 取 20 mg R9溶于10 mL去离子水中,另取16 mg Boc溶于10 mL四氢呋喃中,将溶有 Boc酸酐的四氢呋喃溶液加入到R9的水溶液中,搅拌均匀,用1 mol·L-1的NaOH溶液调节混合溶液的pH值至9~10,恒温搅拌反应24 h后,停止反应。将反应液置于旋转蒸发仪上除去部分四氢呋喃—水混合液,取适量去离子水将其溶解,得反应液1。
称取281 mg HCS加入到30 mL的1%的冰醋酸水溶液中,室温搅拌12 h,使 HCS完全溶解,用电子分析天平称取5.6 mg NHS和24 mg EDC,加入到HCS溶液中,再将反应液1加入到此溶液中,调 pH 为6.0,开启磁力搅拌,在室温下搅拌反应 48 h后,停止搅拌。加入1%的 CF3COOH消除 Boc保护。加入50%羟胺使其终浓度为 10 mM,调节pH至8.0,使反应停止。流反应 R9与 HCS摩尔比为10∶1。
将反应液装入透析袋(MW=8 000~14 000)中,浸没在去离子水中透析 48 h,然后冷冻干燥,得到产物HCS-R9-1。
2.1.2 高取代 HCS-R9的制备 采用 2.1.1中的方法使 R9与 HCS以40∶1的摩尔比发生反应,经过透析、冷冻干燥,得到产物HCS-R9-2。
2.1.3 低取代 LCS-R9的制备 采用2.1.1中的方法使R9与 LCS以 5∶1的摩尔比发生反应,经过透析、冷冻干燥,得到产物 LCS-R9-1。
2.1.4 高取代 LCS-R9的制备 采用 2.1.1中的方法使R9与LCS以35∶1的摩尔比发生反应,经过透析、冷冻干燥,得到产物LCS-R9-2。
2.2 CS-PR的结构鉴定[12]
2.2.1 傅里叶红外光谱分析(FTIR) 分别取适量的CS、R9、HCS-R9-1、HCS-R9-2、LCS-R9-1、LCS-R9-2冻干粉末,与干燥的 KBr粉末以 1∶100的质量比混匀并溶于适量去离子水,烘干,用玛瑙研钵研成细粉末,将此混合物压片,置于傅氏转换红外线光谱分析仪(FTIR)内扫描,扫描范围:4 000~400 cm-1,记录其红外光谱。
2.2.21H-核磁共振谱(1H-NMR) 取适量的 CS、R9、HCS-R9-1、HCS-R9-2、LCS-R9-1、LCS-R9-2,分别溶于体积比为 5∶95的 CD3COOD∶D2O中,在 150 MHz频率照射,20℃下核磁共振仪记录图谱。
3 结果
3.1 产物的红外谱图 见图 2。由图 2可知,R9 在1 652和1 153 cm-1处分别有R9的胍基 C=N特征峰和C-C-N键的非对称伸缩吸收峰,1 271 cm-1处有 C(O)-O的伸缩振动吸收峰,1 139 cm-1处有C-N伸缩振动吸收峰;HCS及LCS在1 637 cm-1处有 NH2键的弯曲振动吸收峰,1 563 cm-1处有C=O键的非对称伸缩振动吸收特征峰,1 077 cm-1处有吡喃环上的 C-O伸缩振动吸收峰,1 153 cm-1处有C-C-N键的非对称弯曲振动吸收峰;HCS-R9-1和HCS-R9-2以及 LCS-R9-1和 LCS-R9-2在 1 580 cm-1处有酰胺键的吸收峰,这表明 HCS和 LCS与R9形成酰胺键[13]。通过红外光谱的测试分析,能够初步判断HCS-R9及 LCS-R9的成功连接。
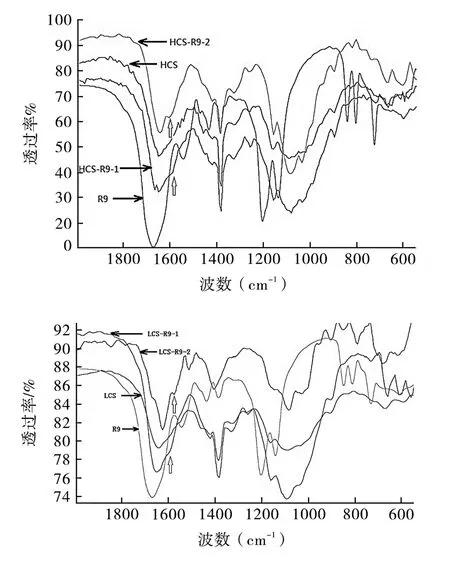
图2 化合物的 FTIR谱图
3.2 产物的核磁谱图 为进一步确证HCS、LCS与R9的连接成功,进行了核磁共振氢谱的测定。由图3中未修饰的壳聚糖的谱图,在以下位置可观测到化学位移:δ=5.23(H 1),δ=3.0(H 2),δ=3.50~3.80(H 3,H 4,H 5,H 6),δ=1.90 ppm(NHCOCH3)。经修饰后,化学位移在 δ=1.5(CONHCHCH2CH2-)、δ=1.7(CONH-CHCH2-)处出现的质子峰,在 δ=4.2(CONH-CH-)处出现的骨架质子峰,都可以表明 R9连接到了 CS上[14]。

图3 A:CS-PR结构式;B:R9、CS、CS-R9的1H-NMR谱图 (其中圆圈代表δ=3.0,CS上2号碳上的质子,-CH-;星号代表δ=4.2,R9上2号碳上的质子,-CH-)
3.3 产物取代度的确定 CS-PR的取代度,定义为R9与 CS的 100个葡聚糖单体的摩尔比[15]。由图4可知,HCS-R9-1、HCS-R9-2、LCS-R9-1、LCS-R9-2的 R9上2号碳上质子与 CS上 2号碳上质子的积分面积比分别为1∶11.58、1∶5.95、1∶4.25、1∶1.1。由此根据以下公式:
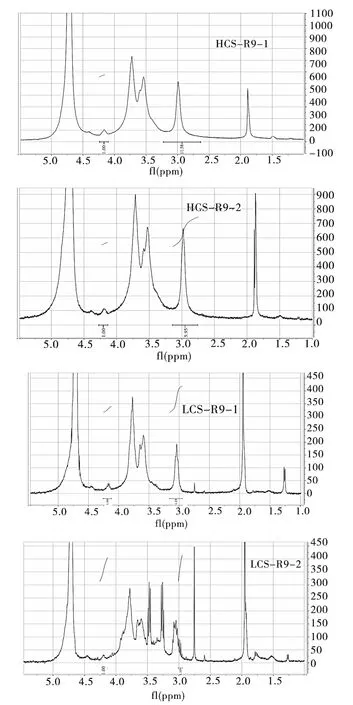
图4 各化合物的质子积分面积
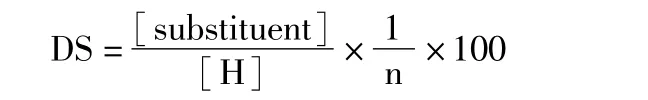
其中:[substituent]:取代基团R9上2号碳的质子数;[H]:CS上2号碳的质子数;n:取代基团上2号碳的总数。由此可以计算出本实验所合成的CS-PR的取代度如下:HCS-R9-1:0.96;HCS-R9-2:1.87;LCS-R9-1:2.61;LCS-R9-2:10.10。
4 讨论
本实验所选用的起始原料壳聚糖和寡聚精氨酸均具有促进透皮吸收的作用,故猜想壳聚糖的寡聚精氨酸修饰物具有更强的促进作用。而前期所做的实验,也验证了HCS-R9具有一定的促进透皮吸收的作用。分子量对于高分子化合物的性质会有很大的影响。因此本实验选用了不同分子量的 CS与 R9结合,并通过改变其摩尔比成功合成了不同取代度的CS-R9。先前查阅了一些文献,有研究[11]表明通过改变反应物的摩尔比可以改变取代度,但尚未见有摩尔比与取代度具体对应关系的报道。本实验室之前尝试过 R9与 HCS摩尔比为5∶1的反应,但因其取代度较低,1H-NMR的谱图与未取代的 HCS几乎无差异,且考虑到HCS分子远远大于R9分子,如若取代度过低,不能使产物发挥预期的优于反应物的透皮吸收促进作用,于是提高了摩尔比,以获得取代度更高的HCS-PR。因之前未进行过 LCS与 R9的反应,不知其摩尔比与取代度关系如何,因此本实验进行了摩尔比差异较大的两组实验。本实验为后期研究反应物的摩尔比与取代度的关系以及考察壳聚糖分子量、取代度对透皮吸收促进作用的影响奠定了基础。
[1] 何 文,张 冕,代文兵,等.N-三甲基壳聚糖透皮吸收促进作用的初步研究[J].中国药学杂志,2006,41(7):519-522.
[2] 肖礼海,何 文,孙安琪,等.应用 ATR-FTIR考察壳聚糖及其衍生物对角质层含水量的影响[J].中国药师,2008,11(4):371-373.
[3] 何 文,肖礼海,孙安琪,等.壳聚糖及其衍生物对HaCat细胞膜电位的影响[J].中国药学杂志,2009,44(14):1063-1066.
[4] 陈 茜,刘亚伟,黄 邵,等.细胞穿透肽穿膜机制的研究进展[J].中国病理科学与临床杂志,2009,29(2):115-120.
[5] 任 锦,钦传光,徐春兰,等.细胞穿透肽作为药物载体的研究进展[J].药学学报,2010,45(1):17-25.
[6] Lopes LB,Brophy CM,Furnish E,et al.Comparative Study of the skin penetration of protein transduction domains and a conjugated peptide[J].Pharmaceutical Research,2005,22(5):750-757.
[7] Uchida T,Kanazawa T,Takashima Y,et al.Development of an efficient transdermal delivery system of small interfering RNA using functional peptides,Tat and AT-1002[J].Chemical and Pharmaceutical Bulletin(Tokyo),2011,59:196-201.
[8] Zaro JL,Shen WC.Quantitative comparison of membrane transduction and endocytosis of oligopeptides[J].Biochemical and Biophysical Research Communications,2003,307(2):241-247.
[9] Gopalakrishnan S,Pandey N,Tamiz AP,et al.Mechanism of action of ZOT-derived peptide AT-1002,a tight junction regulator and absorption enhancer[J].International Journal of Pharmaceutics,2009,365(1/2):121-130.
[10]Liu WG,Zhang JR,Cao ZQ,et al.A chitosan-arginine conjugate as a novel anticoagulation biomaterial[J].Journal of Materials Science:Materials in Medicine,2004,15(11):1199-1203.
[11]Park S,Jeong EJ,Lee J,et al.Preparation and characterization of nonaarginine-modified chitosan nanoparticles for siRNA delivery [J].Carbohydrate polymers,2013,92(1):57-62.
[12]Xiao B,Wan Y,Zhao MQ,et al.Preparation and characterization of antimicrobial chitosan-N-arginine with different degrees of substitution[J].Carbohydrate Polymers,2011,83(1):144-150.
[13]Barreira SVP,Silva F.Surface modification chemistry based on the electrostatec adsorption of poly-L-arginine onto alkanethiol modified gold surfaces[J].Langmuir,2003,19(24):10324-10331.
[14]Zhao XL,Li ZY,Liu WG,et al.Octaarginine-modified chitosan as a nonviral gene delivery vector:properties and in vitro transfection efficiency[J].J Nanopart Res,2011,13(2):693-702.
[15]Park S,Jeong EJ,Lee J,et al.Preparation and characterization of nonaarginine-modified chitosan nanoparticles for siRNA delivery [J].Carbohydrate polymers,2013,92(1):57-62.
Synthesis and characterization of chitosan modified nonaarginine with different degrees of substitution
HE Wen1,LIU Bei2,GUO Xian-xi1
(1.Department of Pharmacy,Renmin Hospital of Wuhan University;2.School of Pharmaceutical Sciences,Wuhan University,Wuhan,Hubei 430060,China)
Objective To synthesize chitosan modified nonaarginine(CS-R9)with different degrees of substitution(DS)and to characterize the structure and DS by FTIR and 1H-NMR.Methods R9 and CS with high molecular weight(HCS)or low molecular weight (LCS)as the raw materials,a series of CS-R9 with different DS were synthesized by changing the mole ratio between them.The structure and DS of CS-R9 was characterized by FTIR and1HNMR.Results A series of CS-R9 was synthesized including HCS-R9 with the DS of 0.96 and 1.87,LCS-R9 with the DS of 2.61 and 10.10,respectively.Conclusions CS-R9 with different DS was synthesized successfully,which provides the basis for the further studies.
chitosan;nonaarginine;synthesis;molecular weight;substitution
10.3969/j.issn.1009-6469.2014.05.010
2013-10-29)



