唐曼,王晴,张和平,赵彩霞,陈勇,娄蓉
作者单位:安徽省妇幼保健院(安徽医科大学附属妇幼保健院)病理科,安徽 合肥 230001
近年来,随着宫颈癌脱落细胞学筛查的普及,宫颈鳞状细胞癌的发病率逐年降低,与此同时,宫颈腺癌的发病率有所上升,并呈年轻化的趋势。第四版WHO 女性生殖器官肿瘤与分类[1]中将宫颈原位腺癌(AIS)作为宫颈腺上皮肿瘤唯一明确的癌前病变。由于宫颈AIS发病隐匿,临床特征不特异,在日常工作中容易造成漏诊或治疗不充分。本研究汇总28 例宫颈AIS 的病例,分析其临床病理学特征并检测细胞周期蛋白依赖性激酶抑制剂(p16)、癌胚抗原(CEA)、肿瘤增殖抗原(Ki-67)在其组织中的表达,探讨宫颈AIS的诊断及治疗。
1 资料与方法
1.1 一般资料收集2009年1月至2016年5月安徽省妇幼保健院诊断为AIS 的病人28 例,年龄范围为26~54 岁,中位年龄39.5 岁;其中21 例(75.0%)表现为阴道不规则流血(不规则出血13例,接触性出血8例),1 例表现为阴道排液(3.5%),其余6 例(75.0%)无明显临床症状。所有病例均先行宫颈活检或宫颈锥切术,且均经两名高年资病理医师阅片。
1.2 试剂免疫组织化学抗体CEA(批号ZM-0062),p16(批 号ZM-0205)及Ki-67(批 号ZM-0166),均由北京中杉金桥生物技术有限公司提供。
1.3 方法所有标本均经10%中性甲醛溶液固定,常规石蜡包埋,制成3 µm 切片,行苏木素-伊红(HE)染色,并行免疫组织化学染色。免疫组织化学染色采用Envision 两步法,严格按试剂说明书操作,以PBS 代替一抗作为阴性对照,每批染色均设置已知阳性对照。
1.4 结果判读p16以细胞核和细胞质共同着色为阳性表达CEA以细胞质着色为阳性表达,Ki-67以细胞核着色为阳性表达。Ki-67采用定量计数法,计数10个400倍高倍视野,得到平均阳性着色的百分比。
2 结果
2.1 临床特征28 例中,13 例临床表现为阴道不规则流血,8 例病人有接触性出血,1 例表现为阴道排液,其余6例无明显临床症状。
2.2 镜检宫颈AIS 形态学特征为正常宫颈小叶结构保存,基底膜完整,腺体可出现折叠、外凸、乳头状结构,但无实性区或复杂乳头结构,主要累及全部或部分表面或腺腔上皮;细胞异型性表现为细胞核增大,染色质粗糙,有小的单个或多个核仁,不同程度的细胞核复层,胞质黏液量减少,核分裂象常见并主要位于腺腔面。28 例中,24 例AIS 为宫颈内膜型(图1A);3 例AIS 为肠型(图1B);余1 例为复层产生黏液的上皮内病变(SMILE),这也是新版WHO 分类中新加入的AIS 亚型,主要表现为复层上皮的所有细胞都含有黏液空泡,细胞核有异型性,染色质浓染,核分裂象可见。
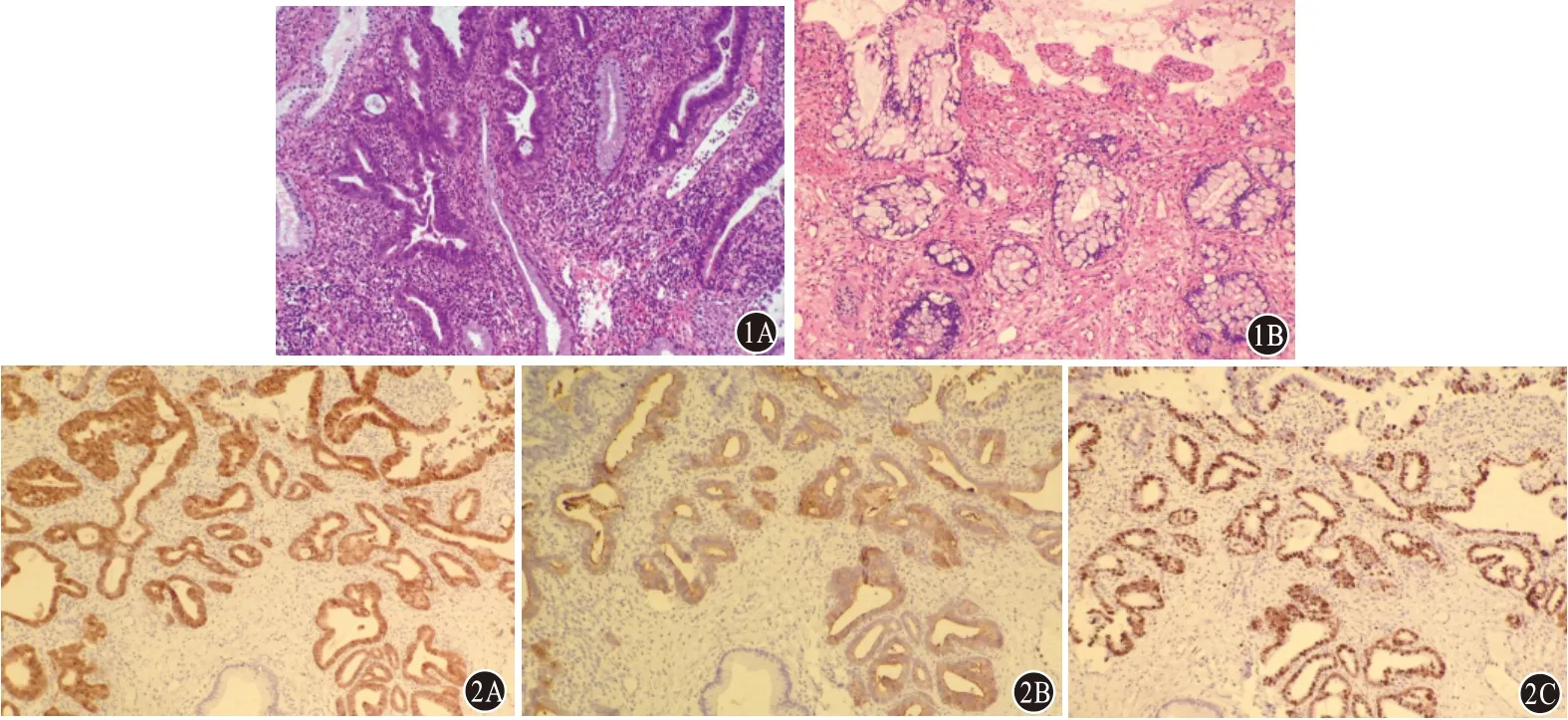
图1 宫颈原位腺癌(AIS)染色图(HE染色×100):1A为AIS宫颈内膜型;1B为AIS肠型 图2 宫颈原位腺癌(AIS)免疫组化(Envision法×100):2A为p16呈现细胞核/质弥漫强阳性表达;2B为CEA呈现细胞质弥漫强阳性表达;2C为Ki-67增殖指数(+,80%)
2.3 免疫组织化学28 例AIS 病变中,p16(弥漫+)阳性27 例(96.4%)(图2A),CEA(弥漫+)24 例(85.7%)(图2B),Ki-67 增 殖 指 数 为40%~80%(图2C)。
3 讨论
宫颈AIS 是由Friedell、McKay[2]于1953 年首次描述并提出这个概念,第四版女性生殖器官WHO分类[1]将宫颈AIS 定义一种上皮内病变,这种病变含有恶性特征的腺上皮,如果不治疗,具有发展为浸润性癌的高度危险性,为唯一明确的宫颈腺上皮肿瘤的前驱病变。宫颈AIS 发病年龄较轻,通常在40岁左右,比浸润性腺癌早10~15年,病人常常无症状或有轻微症状,如白带增多、接触性出血或阴道排液等[3],本研究中病人的中位年龄在39.5岁,病人近一半表现为阴道不规则出血(46.4%),部分表现为接触性出血(28.6%),还有1 例表现为阴道排液,与文献报道相符。
宫颈AIS 的主要组织学特征为肿瘤性上皮取代正常的宫颈内膜上皮或腺体,病变局限于先前存在正常宫颈内膜上皮或腺体,因此正常的小叶结构存在。肿瘤性上皮呈假复层柱状排列,胞质内失黏液,尽管部分病例存在胞质内黏液。宫颈AIS[4]根据形态学特征又分为:⑴宫颈内膜型(普通型);⑵肠型;⑶子宫内膜样型;⑷输卵管型;⑸复层产生黏液的上皮内病变(SMILE)[5];⑹腺鳞型[6]。本研究中的28 例病例中,大多为宫颈内膜型,也是最常见的一种亚型,镜下细胞核增大、不规则,染色质粗糙,偶尔伴有显着的核仁,腔缘可见核分裂象和凋亡小体,胞质内黏液比正常子宫颈管少;3例为肠型AIS,病变上皮细胞胞质有大量黏液,位于细胞一侧,类似肠上皮的杯状细胞,细胞核很少复层排列,有研究表面,宫颈中查见杯状细胞常常提示有腺上皮的前驱病变或腺癌的存在,良性病变中杯状细胞较为罕见;还有1例为SMILE[5],这种亚型目前认为起源于宫颈鳞柱移行区的储备细胞,病变常表现为圆形或小叶状,无腺腔形成,细胞复层排列,中表层细胞内可见黏液,细胞常高度异型,核分裂及凋亡多见。SMILE 常常与高级别鳞状上皮内病变及AIS伴随出现,因此应仔细检查标本中查见的SMILE,以免漏诊。
众所周知,HPV 感染尤其是高危型HPV 与宫颈鳞状上皮病变的关系已经明确,高危型HPV 与宫颈腺癌也密切相关[7],其主要类型是HPV18型,其次是HPV16型,这与宫颈鳞状上皮病变中所含的HPV 类型相同,因此文献报道56%~71%的宫颈原位腺癌常常合并有CIN 病变[8-10]。本研究显示28例AIS中,17 例(60.7%)伴有宫颈鳞状上皮内病变,其中2 例伴低级别鳞状上皮内病变,15 例伴高级别鳞状上皮内病变,与文献一致。p16 是近年来被广泛应用的抗体,是细胞周期依赖性激酶的抑制剂,通过一致CDK4/6 的活性从而一致Rb 基因的磷酸化,而高危型HPV 的E7 蛋白可以与Rb 结合,使其失活继而对p16 的负反馈作用小,使p16 蛋白过表达,过度表达的p16 也不能正常发挥肿瘤抑制功能,导致病变发生。本研究观察到p16 在原位腺癌中的阳性率为96.4%(27/28),且高表达模式为弥漫细胞核和细胞质均匀一致的强阳性,而不是胞质散在斑片状弱阳性的表达,这提示p16 的高表达及高危型HPV 感染与AIS 的发生密切相关[9,11]。CEA 是一种广谱肿瘤标志物,可对腺上皮肿瘤进行鉴别,但其灵敏度和特异度均不高。在良性病变中常为阴性表达,AIS中多为弥漫阳性表达,实际工作中,常把CEA 与其他标志物联合使用,对鉴别宫颈腺性病变中有一定作用[9,11-12]。Ki-67 是细胞核增殖基因,能反映正常和病理增殖活性,作为鉴别良恶性肿瘤十分重要的辅助指标,普遍应用于肿瘤细胞的增殖表达。良性病变中,Ki-67 常<10%,而当Ki-67>30%时,常提示有AIS 的 存 在[6]。本 研 究 中CEA 阳 性 率 为85.7%(24/28),Ki-67增殖指数为40%~80%。
宫颈AIS 的鉴别诊断主要有:(1)输卵管和子宫内膜样化生,由于细胞核质比较高,且无细胞内黏液分泌现象似AIS,但可见输卵管上皮的纤毛细胞、插入细胞等,细胞无异型性及分裂性;(2)子宫内膜异位症,由于异位的子宫内膜可见一定数量的核分裂象,但细胞无异型性且腺体分布均匀,周围可见子宫内膜间质;(3)宫颈浸润性腺癌,当腺体出现广泛且明显的乳头,筛状或融合、迷宫样生长,周围出现间质促纤维反应,以上均提示浸润性腺癌。此外还应和其他的一些病变相鉴别,如中肾腺体残留,微偏腺癌等。
目前手术治疗仍然是最主要的治疗手段。由于AIS病灶隐匿,缺乏特异的早期临床表现,且病变有跳跃性和多灶累及的特点,阴道镜下多点组织活检均难以明确病变,有研究回顾性分析既往病理报告,发现活检诊断为AIS 的病例锥切术后病理仍有1/3 为浸润性腺癌,故宫颈活检在AIS 的诊断与锥切后病理存在一定的差异[13]。目前对于AIS的诊断及治疗,普遍认为应行诊断性锥切[14-15],有研究指出宫颈环形电切术及宫颈冷刀锥切术两种手术方式术后的病变残留率与复发率比较均差异无统计学意义,对AIS的锥切已不再强调锥切方式,应重点关注锥切组织的完整性、切缘的可读性[12]。如宫颈锥切为浸润癌则按照浸润性宫颈腺癌处理,如果仅为AIS,有学者认为有生育要求且锥切切缘均阴性的女性,可通过阴道镜检查、细胞学检查、HPV 检测等方式,在长期密切随访的情况下可采取保留子宫的保守治疗[16-18],而无生育要求的病人建议行全子宫切除。宫颈锥切术后仍有病变复发、进展为浸润性腺癌的可能,有文献发现切缘阳性与病人病灶残留密切相关[19]。AIS 病人术后需长期密切随访。本研究28 例病人有17 例行单纯子宫切除术,11 例病人行宫颈锥切术,4 例锥切后切缘阳性。23 例获得随访3~80 个月,4 例病人复发,其中2 例为切缘阳性病人,复发后病理仍为宫颈原位腺癌,另2例病人复发为浸润性腺癌,行广泛切除后,1 例术后13 个月死亡,1例术后8个月无瘤生存。
总之,宫颈AIS具有特殊的形态学特征,其发病隐匿、筛查方法局限以及诊断标准不一等情况,容易造成病变漏、误诊,可能致使病人延误诊治从而发展为浸润性癌,p16、CEA、Ki-67联合使用有助于AIS的诊断。对提示任何腺上皮异常者应行诊断性锥切,切缘状态对病人选择是否保留子宫有重要参考意义,切缘阳性者应进一步手术治疗,若无生育要求的女性可行全子宫切除,术后密切随访是必要的。



