李猛猛,尹逊河,邱建华,王宪龙,李 囡
(山东农业大学动物科技学院,泰安 271018)
拉莫三嗪及L-硝基精氨酸对颞叶癫痫一氧化氮合酶活性、一氧化氮含量及nNOS阳性神经元形态结构的影响
李猛猛,尹逊河*,邱建华,王宪龙,李 囡
(山东农业大学动物科技学院,泰安 271018)
通过测得家兔颞叶癫痫模型中一氧化氮合酶(NOS)的活性和一氧化氮(NO)的含量,研究L-NNA和拉莫三嗪对其含量变化的影响,探讨NO在颞叶癫痫中的发作机制及这两种药物对脑部神经元的保护作用。选取2.0~2.5 kg健康哈白兔60只,随机分为正常对照组、癫痫模型组、拉莫三嗪治疗组和L-NNA治疗组,应用硝酸还原法测定癫痫发作后不同时间脑组织中海马及颞叶NO的含量及NOS的活性。结果显示:发现模型组脑海马及颞叶内NOS 的活性从6 h开始迅速升高,1 d达到峰值,随后逐渐降低,7 d后基本恢复正常水平,但仍高于其他各组(P<0.05)。L-NNA治疗组和拉莫三嗪治疗组在各时间点极显着或显着低于模型组(P<0.01或P<0.05),L-NNA在6 h~1 d时对NOS的降低程度显着好于拉莫三嗪组(P<0.05)。NO的变化规律与NOS变化规律基本一致且成正相关;利用SABC免疫组化染色检测脑海马内神经性NOS(nNOS)阳性神经元,发现模型组海马内CA3区nNOS阳性神经元密度增加,胞质着色加深,胞体的截面积和突起变小;拉莫三嗪治疗组和L-NNA治疗组的神经元密度有所降低,胞体的截面积和突起长度显着变大(P<0.05)。结果显示:NO参与了颞叶癫痫发作的始动过程,高浓度的NO对神经元有损伤作用;L-NNA和新型治疗药拉莫三嗪能明显抑制癫痫发作后NO的浓度,对脑部神经元有一定的保护作用,从而对癫痫发作有较好的治疗作用。
L-硝基精氨酸; 癫痫;海马;一氧化氮;拉莫三嗪
颞叶癫痫(tempora lobe epilepsy,TLE)是常见的难治性癫痫,其发病机制及病因复杂,也是近十年有关难治性癫痫研究的热点[1]。氯化锂-匹罗卡品(LiCl—PILO)诱导的癫痫模型,在癫痫持续状态下行为、病理等特性极其相似,成功的复制了人类颞叶癫痫发作。其主要病变表现为海马组织神经元缺失,星型胶质细胞增生以及苔藓纤维发芽,因而广泛应用于国内外的癫痫研究中。
NO是一种生物信使分子,由L-精氨酸在一氧化氮合酶(nitric oxide Synthase,NOS)作用下生成,其含量与NOS的活性呈正相关[2]。一氧化氮合酶在脑部有神经元型(nNOS)、诱导型(iNOS)和内皮型(eNOS)3型。一氧化氮(NO)是兼有细胞内和细胞间信使和神经传递作用的气体物质,它既具有通过多种途径传递神经元信息,调节脑血流量,保护神经元的功能,在过量情况下又有广泛的细胞毒作用。有研究表明,在各种脑病时,由于Ca2+大量内流,通过钙调蛋白(CaM)激活iNOS,引起NO合成增加,大量的NO反过来又加重脑神经元损伤[3]。
拉莫三嗪[4](lamotrigine,LTG)因其控制发作效果较好,对认知损伤较轻,广泛应用于难治性癫痫的治疗。LTG的抗癫痫机制包括抑制电压依赖性钠通道,稳定细胞膜防止异常放电,抑制突触前膜谷氨酸盐释放等[4],但它是否抑制NOS的活性,减少NO的产生,从而对脑神经元发挥保护作用,目前尚未见报道。现在,NOS抑制剂已开始用于医疗事业,应用NOS选择性抑制剂(L-NNA)将成为一种新的神经保护方法,但在抗癫痫药物的研究应用中未见有相关报道。作者采用氯化锂-匹罗卡品诱导的兔颞叶癫痫模型,通过测得颞叶及海马中NOS活性和NO含量的变化,揭示其变化规律,探讨拉莫三嗪和L-NNA对癫痫的神经保护作用及机制,为癫痫药物的研究提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 3月龄健康哈白兔60只,体重2.0~2.5 kg,雌雄各半,购自山东省泰安市北集坡种兔场,兔接种免疫适应1周后开始试验。
1.1.2 主要仪器、试剂与药物 UV-2800A型紫外可见光分光光度计(上海尤尼柯仪器有限公司),一氧化氮测试盒(硝酸还原酶法)、一氧化氮合酶活性测试盒(分型)、考马斯亮蓝测试盒,均购自南京建成生物工程研究所;拉莫三嗪(LTG)购自英国葛兰素史克投资有限公司;L-硝基精氨酸(L-NNA)、匹罗卡品(PILO)、氯化锂(LiCl)购自Sigma公司;nNOS一抗、SABC试剂盒、DAB显色试剂均购自武汉博士德生物工程公司。
1.2 癫痫模型制作及动物分组
1.2.1 匹罗卡品模型的制作 健康哈白兔腹腔注射氯化锂(LiCl)125 mg·kg-1, 18~24 h后注射阿托品1 mg·kg-1,30 min后腹腔注射匹罗卡品(PILO),匹罗卡品的首剂量为20 mg·kg-1,若无癫痫性发作或发作未达到 Racine制定的癫痫性发作标准Ⅲ~Ⅴ级者,每隔30 min可重复腹腔注射匹罗卡品 10 mg·(kg·次)-1,直至出现癫痫性发作。发作程度按R.J.Racine[5]制定的标准进行分级,达到Ⅲ~Ⅴ级的兔进入癫痫持续状态(status epilepticus,SE),归于模型成功组;未达到Ⅲ~Ⅴ级的兔继续注射 PILO 直至次数达到 6 次,其间达Ⅲ级以上的动物也归到模型成功组;6 次后仍未达到标准的淘汰。癫痫模型成功后从第一次大发作开始 SE 50 min以上者,以10%水合氯醛 3 mL·kg-1终止。对试验用兔给予正常饲养,室温控制在25 ℃左右。造模成功后24 h内给药(剂量参照治疗方法)。
R.J.Racine[5]的等级标准:0级:无惊厥;Ⅰ级:面肌抽动、咀嚼;Ⅱ级:面部阵挛伴节律性点头;Ⅲ级:面部阵挛、节律性点头、前肢阵挛;Ⅳ级:前肢阵挛、后肢站立;Ⅴ级:失平衡、跌倒、四肢抽动、全身阵挛。1.2.2 分组及药物治疗方法 将试验用兔分为正常对照组、癫痫模型组、 癫痫拉莫三嗪治疗组、癫痫L-NNA治疗组,每组14只。拉莫三嗪治疗组于造模成功后每天9:00给予拉莫三嗪13 mg·kg-1灌胃;L-NNA治疗组每天早晨9:00按照20 mg·kg-1L-NNA悬浊液进行灌胃治疗,直到宰杀;正常对照组以0.9%的生理盐水代替阿托品、氯化锂和匹罗卡品进行腹腔注射,用 100 mg·kg-1生理盐水代替药物灌胃,其他条件与上述条件一致。
1.3 脑组织取材及处理
各组各时间点行颈总动脉放血处死,一部分迅速取出完整脑,取海马及颞叶立即放入4%的多聚甲醛固定液中,以备SABC免疫组织化学染色及HE染色;另一部分迅速取出完整脑组织,取海马及颞叶低温研磨后加冰生理盐水制备10%的脑组织匀浆,4 ℃下3 500 r·min-1离心10 min,取上清液于-20 ℃保存待测。
1.4 一氧化氮含量和NOS活性的测定
采用南京建成生物工程研究所NO测试盒(硝酸还原酶法)和NOS活性试剂盒(分型),应用UV-2800型分光光度计测定海马及颞叶脑组织中 NO含量及NOS的活性。
1.5 SABC免疫组织化学染色
参照武汉博士德生物工程公司SABC免疫组化试剂盒说明书进行染色。
1.6 切片观察、测量
每个样本取10张切片,在Olympus显微镜下观察nNOS阳性神经元的形态、结构,并用网形和尺形测微尺计数、测量nNOS阳性神经元的密度、胞体截面积、第一级突起数及最长突起长度。
1.7 统计学处理
2 结 果
2.1 各组家兔海马及颞叶NOS活性
从图1可看出,模型组海马及颞叶中NOS的活性比正常对照组在各时间点均极显着或显着升高(P<0.01或P<0.05),NOS的活性从6h开始迅速升高,1d达到峰值,随后逐渐降低,7d后基本恢复正常水平,但仍高于其他各组(P<0.05)。拉莫三嗪治疗组和L-NNA治疗组均显着低于模型组(P<0.05),在6h~7d内显着或极显着高于正常对照组(P<0.01或P<0.05),在其他时间差异不显着(P>0.05)。拉莫三嗪治疗组与L-NNA治疗组相比,在6h~1d前者显着高于后者(P<0.05),从3d开始两组之间的差异不显着(P>0.05)。
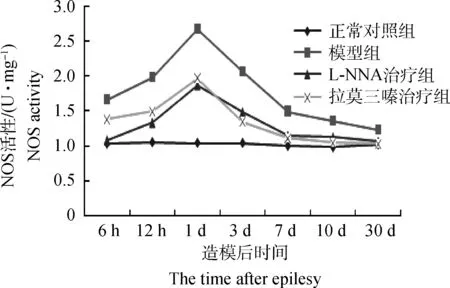
图1 NOS活性在各组兔海马和颞叶中的变化Fig.1 The change of NOS activity in hippocampus and temporal lobe of the four group rabbits
2.2 各组家兔海马及颞叶NO含量
从图2可看出,颞叶癫痫模型组海马及颞叶脑组织NO含量于6 h后迅速升高,在1 d达到峰值,2~3 d含量有所降低,7 d后含量仍高于正常对照组,但差异不显着(P>0.05),与NOS活性的变化规律基本一致。与颞叶癫痫模型组相比,L-NNA治疗组和拉莫三嗪治疗组NO含量在6 h~3 d各时间点均显着或及显着降低(P<0.01或P<0.05),7 d后差异不显着(P>0.05)。L-NNA治疗组在6 h~1 d NO含量显着低于拉莫三嗪组(P<0.05),从3 d开始两者之间的差异不显着(P>0.05)。从图2中还知,前期L-NNA治疗组比拉莫三嗪治疗组对NO的降低程度大。

图2 NO的含量在各组兔海马和颞叶中的变化Fig.2 The changes of NO content of hippocampus and temporal lobe at the four groups of rabbit
2.3 各组家兔海马nNOS阳性神经元的变化
经SABC免疫组织化学检测(图3)可知:正常对照组nNOS阳性神经元主要散布在齿状回和海马的分子层及多形层,锥体细胞层大部分未着色,只有较少部分呈阳性反应。海马的CA3区着色明显。阳性细胞轮廓清晰,细胞体大且染色深,突起多而长。胞体形态主要有锥体形和圆形2种。免疫反应产物呈棕褐色,主要位于细胞质内,染色均匀,细胞核不着色。
模型组与正常对照组相比,海马CA3区nNOS阳性神经元密度增加,胞体的截面积变小,突起的长度和第一级突起数量减小,二者差异显着(P<0.05);拉莫三嗪治疗组和L-NNA治疗组与模型组相比,阳性神经元密度显着降低(P<0.05),胞体截面积增大,突起的长度与第一突起的数量增加。两个治疗组相比阳性神经元密度L-NNA组显着低于拉莫三嗪组(P<0.05),其他指标差异不显着(P>0.05)。

A.癫痫模型组10 d CA3区 nNOS阳性神经元的分布;B.拉莫三嗪治疗组10 d CA3区nNOS阳性神经元的分布;C.L-NNA治疗组10 d CA3区nNOS阳性神经元的分布;黑色箭头表示nNOS阳性神经元A.The distribution of nNOS positive neurons in the epilepsy after 10 days in CA3 region of hippocampus;B.The distribution of nNOS positive neurons in the treatment group of lamotrigine in CA3 region of hippocampus;C.The distribution of nNOS positive neurons in the treatment group of L-NNA in CA3 region of hippocampus图3 兔颞叶癫痫中CA3区nNOS 阳性神经元的分布(比例尺:50 μm)Fig.3 The distribution of Nnos positive neurons in CA3 region of hippocampus in the temporal lobe epilepsy rabbits (Bar=50 μm)
3 讨 论
3.1 颞叶癫痫不同时间NOS活性、nNOS阳性神经元及NO含量的变化
癫痫发作后各组NO的含量变化与NOS的活性变化规律相一致,且成正相关。在癫痫发作后6 h血清中NO的含量迅速升高,2~3 d含量有所降低,但仍明显高于正常对照组,7 d后则基本恢复正常。NO的这种含量变化与张映琦等[6]的研究结果相一致,说明在NOS作用下产生的NO参与了癫痫发作的始动过程。拉莫三嗪治疗组和L-NNA治疗组在各时间点NOS的活性及NO含量与模型组相比显着降低(P<0.05),免疫组织化学也显示,海马CA3区nNOS阳性神经元密度显着降低,胞体截面积增大,突起的长度与第一级突起的数量增加,这些与姚君茹等[7]在大鼠海马的研究和施溯筠等[8]测得小鼠血清的结果相类似。说明这两种药物能降低海马内NOS的活性,减少NO的产生量,从而减轻了癫痫发作后过量的NO导致的神经毒性作用,具有保护脑神经元的作用。
3.2 NO参与颞叶癫痫机制
NO是在NOS的催化下由L-Arg生成,NOS在脑内广泛存在。NO属于一种自由基,分子中有一个未配对电子,容易与氧、超氧化物自由基发生反应,很快被氧化成硝酸和亚硝酸盐而失去生物活性[9]。NO 的产生过程与N-甲基-D-天门冬氨酸受体(NMDAR)有密切的关系。有研究[10]认为NO不仅通过NMDAR介导谷氨酸的神经传递,而且当NO大量产生、细胞内钙超载时,还介导着谷氨酸的神经毒性作用导致细胞死亡。谷氨酸(Glu)与NMDA受体结合可引起Ca2+内流,在癫痫发病机制中起重要作用[11]。在正常生理条件下NO失去其不成对电子时形成氧化型亚硝酸离子(NO+),它能与NMDA受体结合氧化还原调节部位的巯基反应,使其亚硝酸化而形成二硫键,这一作用既调节了NMDA受体调控的离子通道,避免了细胞内Ca2+超载所致的毒性,也防止了NO与超氧阴离子反应所致的神经毒性作用。
而NO的大量产生使得细胞内钙超载,过量的钙离子与钙调蛋白结合,激活iNOS进而使NO合成增加,氧自由基也会随着Ca2+的升高而增多。病理状态下NO易得到一个电子时形成还原型的NO-,能够与超氧阴离子迅速反应,生成过氧化亚硝基阴离子(ONOO-)。ONOO-质子化后进一步生成过氧化亚硝酸,并在酸性环境中进一步分解成具有很强毒性的羟自由基及二氧化氮自由基,进而导致膜功能失调,影响膜离子通道,从而引起膜的电生理紊乱而出现癫痫发作[12]。
3.3 匹罗卡品诱导的颞叶癫痫机制
研究表明,匹罗卡品致癫痫模型中可导致海马区的特异性损伤,表现为海马神经细胞损失、星形胶质细胞增生,海马齿状回和CA3区苔藓纤维发芽,这些神经网络的改变导致神经兴奋异常通路成为癫痫晚期的病变基础。神经元是电兴奋的主体,匹罗卡品致癫痫形成后,海马的门区和CA3区以γ-氨基丁酸(GABA)为主的抑制性中间神经元减少,兴奋性的齿状回颗粒细胞增多,使得兴奋-抑制平衡破坏,进而促成癫痫发作[13]。同时癫痫发病机制也与星形胶质细胞与神经元之间建立的信号网络有关,癫痫使得信息交流抑制影响了突触的调节功能。星形胶质细胞还参与细胞外离子和神经递质的调节以及分泌细胞外基质分子和生长因子,后两者影响神经元的存活以及轴突、树突的出芽,与癫痫时兴奋性回路的形成和反复有关[14]。
苔藓纤维出芽是人类颞叶癫痫的典型病理学特征[15]。海马齿状回颗粒细胞的轴突称为苔藓纤维(MF), 苔藓纤维与齿状回(DG)门区中间神经元及CA3 区锥体细胞的树突可以建立神经联系,进而传导神经冲动。癫痫发作CA3区锥体细胞损伤,导致苔藓纤维与靶细胞断离,阻碍了苔藓纤维正常出芽和与颗粒细胞的树突建立正常的突触联系。 李国良等[16]在匹罗卡品诱导的颞叶癫痫的研究中也发现,在SE后 3~7 d时,海马齿状回内分子层未见明显的苔藓纤维出芽,从第15天开始,海马齿状回内分子层有明显的苔藓纤维出芽,到第30天及第60天时出芽更加明显,而对照组却未见苔藓纤维出芽。
3.4 拉莫三嗪和NOS抑制剂L-NNA在颞叶癫痫中的作用
拉莫三嗪(LTG)是一种新型抗癫药,其作用机制为:抑制电压依赖式Ha型钠通道,稳定细胞膜防止异常放电的产生,抑制前膜谷氨酸盐释放[17]。本次试验还得知,拉莫三嗪治疗组显着降低了癫痫模型脑组织中NOS的活性和NO含量,使海马CA3区nNOS阳性神经元胞体截面积增大,突起的长度与第一级突起的数量增加,对海马神经元有保护作用。
L-NNA是一种NOS抑制剂,它可抑制脑组织内的NOS的活性,使NO的合成量减少,进而减轻了癫痫发作后由于NO的浓度升高而导致的神经毒性作用,具有保护脑神经元的作用。
4 结 论
NO参与了癫痫发作的过程,高浓度的NO对脑部神经元有神经毒性作用。由于NO的含量与NOS活性呈正相关,所以NO和NOS在癫痫发作中发挥了重要作用。拉莫三嗪在中后期能显着降低癫痫发作后脑海马及颞叶的NOS活性及NO含量,减轻高浓度的NO对海马神经元的神经毒性作用,从而发挥保护作用。NOS抑制剂L-NNA能够直接抑制NOS的活性,进而降低脑部NO的含量,从而降低了癫痫发作后NO对脑部的神经毒性作用,具有保护脑神经元的作用。因此,拉莫三嗪和L-NNA均能用作癫痫发作后的治疗药物,然而用药的剂量、剂型和疗程等需作进一步研究。
[1] 吴 逊,沈鼎烈.难治性癫痫[J].中华神经科杂志,1998,31(1):4. WU X,SHEN D L.Intractable status epilepticus[J].ChineseJournalofNeurology,1998,31(1):4.(in Chinese)
[2] 王崇甫,尹逊河,邱建华,等.血塞通及L-硝基精氨酸对脑纹状体出血家兔一氧化氮合酶活性、一氧化氮含量的影响[J].畜牧兽医学报,2012,43(12):1957-1962. WANG C F,YIN X H, QIU J H, et al.The influence of xuesaitong and L-NNA on the activity of nitric oxideynthase and the content of nitric oxide in the striatal hemorrhage rabbits[J].ActaVeterinariaetZootechnicaSinica, 2012,43(12):1957-1962.(in Chinese)
[3] 赵秀鹤,迟兆富,邓小梅,等.癫痫发作后脑内一氧化氮、一氧化氮合酶及相应氨基酸的变化[J].中国神经精神疾病杂志,2000,26(2):101-102. ZHAO X H, CHI Z F, DENG X M, et al. The changes of nitric oxide, nitric oxide synthase and the corresponding amino acid after seizure in brain[J].ChineseJournalofNervousandMentalDiseases, 2000,26(2):101-102.(in Chinese)
[4] 王 琼.拉莫三嗪和乙琥胺对匹罗卡品诱导的颞叶癫痫的神经可塑性影响的研究[D].太原:山西医科大学,2012. WANG Q. Neuroplasticity of lamotrigine and ethosuximide on temporal-lobe epilepsy induced by pilocarpine[D]. Taiyuan: Shanxi Medical University, 2012.(in Chinese)
[5] RACINE R J.Modification of seizure activity by electrical stimulation:ⅡMotor seizure[J].ElectroencephalogrClinNeurophysiol,1972,32(3):281-294.
[6] 张映琦,廖维宏,曾 琳,等.匹罗卡品致痫大鼠海马一氧化氮水平和caspase-3 mRNA表达的动态变化[J].临床神经病学杂志,2005,18(4):282-284. ZHANG Y Q, LIAO W H, ZENG L, et al. Dynamic changes of nitrc oxide content and caspase-3 mRNA expression in hippocampus in epileptic rats induced by pilocarpine[J].JournalofClinicalNeurology,2005,18(4):282-284.(in Chinese)
[7] 姚君茹,潘三强,吕来清,等.癫痫大鼠海马结构谷氨酸和nNOS神经元的动态变化[J].解剖学杂志,2004,27(5):505-508,488. YAO J R, PAN S Q, LÜ L Q, et al. The dynamic changes in hippocampal formation of glutamate and nNOS neurons in epileptic rats[J].ChineseJournalofAnatomy,2004, 27(5):505-508,488.(in Chinese)
[8] 施溯筠,张善玉.不同给药途径及剂量的LNNA对小鼠血清一氧化氮及一氧化氮合酶水平的影响[J].延边大学医学学报,2009,32(2):96-98. SHI S Y, ZHANG S Y. Effects of L-NNA with different ways on NOS activity and NO contents in serum of mice[J].JournalofMedicalScienceYanbianUniversity,2009, 32(2): 96-98.(in Chinese)
[9] MARLETTA M A.Nitric oxide synthase:aspects concerning structure and catalysis[J].Cell,1994,78(6):927-930.
[10] MILATOVIC D,GUPTA R C,DETTBARN W D.Involvement of nitric oxide in kainic acid-induced excitotoxicity in rat brain [J].BrainRes, 2002,957(2):330-337.
[11] 阿依努尔·铁,阿提卡·吾布力哈斯木,刘绍明.一氧化氮与癫痫的研究概况[J].新疆医学,2006,36(6):149-151. TIE A,WUBULIHASIMU A,LIU S M. The isolation of NO and epilepsy[J].XinjiangMedicalJournal,2006, 36(6): 149-151.(in Chinese)
[12] 王淑秋,邸伟华,马小茹,等.戊四氮(PTZ)致痫大鼠脑组织NO和NOS变化及灵芝孢子粉干预[J].黑龙江医药科学,2011,34(4):79-80. WANG S Q, DI W H, MA X R, et al. The change of NO/NOS and intervention of fungus spores in rats induced by PTZ[J].HeilongjiangPharmaceuticalScience,2011, 34(4): 79-80.(in Chinese)
[13] DEGIORGIO C M,TOMIYASU U,GOTT P S,et al.Hippocampal pyramidal cell loss in human status epilepticus[J].Epilepsia,1992,33(1):23-27.
[14] HINTERKEUSER S,SCHRDER W,HAGR G,et al.Astrocytes in the hippocampus of patients with temporal lobe epilepsy display changes in potassium conductances [J].EurJNEurosci,2000,12(6):2087-2096.
[15] 王本国,韦朝霞,易咏红,等. 匹罗卡品癫痫模型中突触素I的表达及苔藓纤维出芽的动态变化 [J].中华神经医学杂志,2006,5(7):672-675. WANG B G, WEI Z X, YI Y H, et al. Expression changes of synapsin I immunoreactivity in hippocampus and dentate gyrus and progression of mossy fiber sprouting in dentate gyrus in pilocarpine—induced epilepsy model[J].ChineseJournalofNeuromedicine,2006,5(7): 672-675.(in Chinese)
[16] 李国良,张 宁,李 静,等.匹罗卡品诱导颞叶癫痫大鼠齿状回苔藓纤维出芽及突触重建[J].中南大学学报(医学版),2004,29(4):424-428. LI G L, ZHANG N, LI J, et al. Mossy fiber sprouting and synapse formation in the dentate gyrus of temporal lobe epilepsy rats induced by pilocarpine[J].JournalofCentralSouthUniversity(MedicalSciences),2004, 29(4): 424-428.(in Chinese)
[17] TOMAS R B,GREGORY L H.临床癫痫手册[M].第3版.刘献增,王晓飞,译.北京:人民卫生出版社,2006:203-251. TOMAS R B,GREGORY L H.Handbook of Epilepsy[M].LIU X Z,WANG X F,Translate.Beijing:People’s Medical Publishing House,2006:203-251.(in Chinese)
(编辑 白永平)
The Influence of Lamotrigine and L-NNA on the Content of Nitric Oxide and the Activity Nitric Oxide Synthase and nNOS Positive Neurons Morphology in the Temporal Lobe Epilepsy Rabbit Induced by Pilocarpine
LI Meng-meng,YIN Xun-he*,QIU Jian-hua,WANG Xian-long,LI Nan
(CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai’an271018,China)
By measuring the content of Nitric Oxide and the Activity of Nitric Oxide synthase, this experiment was conducted to study the influence of lamotrigine and L-NNA on the change and investigate the mechanism of the action of NO on the cerebral hemorrhageand the protective effect of those two pharmaceuticals in the temporal lobe epilepsy rabbit induced by pilocarpine.Sixty healthy Haerbin rabbits,2.0-2.5 kg,were divided into the group of physiological saline,the epilepsy model group,and the treatment group of lamotrigine and L-NNA.Nitric Oxide (NO) content and the activity of NOS in the hippocampus and temporal lobe after epilepsy were determined by using nitrate enzyme reduction method.We found that the activity of NOS increased at 6 hours after epilpsy, and increased to the highest at 1 day, then decreased gradually and basically returned to normal level after 7 days,but it was still higher significantly than that of other groups (P<0.05).The level of NOS in two therapy groups between L-NNA and lamotrigine were lower than that in model group at every time extremely notable difference or notable difference (P<0.01 orP<0.05),and the decreasing level of NOS in L-NNA group was lower than that of group of lamotrigine between 6 h to 1 day (P<0.05).The change of the NO content and the activity of NOS were accordant primitively and directly correlation.SABC immunohistochemical method was used to detect the neuronal NOS positive neurons in hippocampus,the density of neuronal NOS positive neurons in hippocampus’ CA3 region increased,and the cytoplasm stained darker, soma-sectional area and the length of tuber became smaller; After the treatment of lamotrigine and L-NNA,the density of neuron decreased,and the soma-sectional area and the length of tuber became significant longer (P<0.05).The results indicate that NO is involved in the initiating process of the temporal lobe seizures,and the high concentration of NO can damage the neurons;L-NNA and the novel therapeutic drug lamotrigine can inhibit the concentration of NO after epilepsy seizures,which have a better therapeutic effect on the epilepsy seizures.
N-nitro-L-arginine;epilepsy;hippocampus;nitric oxide(NO);lamotrigine
10.11843/j.issn.0366-6964.2015.01.018
2014-05-23
国家自然科学基金项目(30671498);山东省自然科学基金项目(Y2003D04)
李猛猛(1988-),女,山东淄博人,硕士,主要从事神经解剖与神经生物学研究,E-mail:limengmengshannong@126.com
*通信作者:尹逊河(1955-),教授,E-mail:xhyin@sdau.edu.cn,xhyin@163.com
R742.1
A
0366-6964(2015)01-0138-06



