梁恩涛,陈 杰,黄小波,2*,文心田,2,曹三杰,2,吴学婧,朱书权
(1.四川农业大学动物医学院,动物传染病与基因芯片实验室,雅安 625014;2.四川农业大学人兽共患病研究室与猪病防治研究中心,成都 611130)
三株递呈猪流行性腹泻病毒S基因的减毒鼠伤寒沙门菌的生物学特性研究
梁恩涛1,陈 杰1,黄小波1,2*,文心田1,2,曹三杰1,2,吴学婧1,朱书权1
(1.四川农业大学动物医学院,动物传染病与基因芯片实验室,雅安 625014;2.四川农业大学人兽共患病研究室与猪病防治研究中心,成都 611130)
为了探究减毒沙门菌递呈不同长度猪流行性腹泻病毒(PEDV)S基因的可行性,本研究对3株携带不同长度S基因片段的减毒鼠伤寒沙门菌进行了生物学特性评估。主要进行了对所构建的重组减毒沙门菌菌株SL7207(pVAX-S499-650)(长456 bp,编码 S蛋白N末端499—650位氨基酸)、SL7207(pVAX-S499-789)(长873 bp,编码S蛋白N末端499—789位氨基酸)和前期构建的菌株SL7207(pVAXD-S1-789)(长2 367 bp,编码S蛋白N末端1—789位氨基酸)的生物学特性研究,包括生长曲线测定、携带质粒的体内/外稳定性、回肠组织内的转录、在小鼠体内动态增殖规律、小鼠口服的安全性等。结果表明:SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)、SL7207(pVAXD-S1-789)3种口服菌株均具有较高的稳定性;携带的目的基因可在肠道组织内转录;菌株在小鼠肝、脾中增殖约5周后逐渐被机体清除;小鼠口服具有良好的安全性。本研究结果表明减毒鼠伤寒沙门菌SL7207可递呈不同长度的S基因抗原片段,为后续开展3种菌株的实际口服免疫效果比较研究奠定了基础。
猪流行性腹泻病毒;S基因;减毒鼠伤寒沙门菌;口服;生物学特性
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的以持续性腹泻、脱水和对哺乳仔猪高致病率、高死亡率为主要特征的一种高度接触性肠道传染病[1]。PEDV感染仔猪的靶器官是小肠,局部肠道黏膜免疫对阻止病毒的入侵具有重要作用。现有灭活苗不能产生有效的肠道黏膜免疫;弱毒苗虽然能刺激产生一定的黏膜免疫保护力,但存在散毒及毒力返强的潜在风险,因此开发研制能诱导产生高水平肠道黏膜免疫的新型疫苗是PEDV疫苗研究的新方向[2]。
PEDV为有囊膜的RNA病毒,S蛋白是位于病毒囊膜表面的纤突糖蛋白,由1 383个氨基酸残基(amino acids,aa)构成,在决定细胞亲嗜性[3]、致病性[4]、诱导机体产生保护性抗体[5]等方面起着关键作用。S蛋白具有29个潜在N-糖基化位点[6],包含核心抗原区域(499—638 aa)和2个B淋巴细胞位点(744—755 aa、756—771 aa)[7-9],具备良好的免疫原性且是诱导产生保护性中和抗体的结构蛋白,因此S基因是PEDV基因工程疫苗的主要抗原靶基因。
以减毒沙门菌为载体的疫苗具有口服免疫方便,能激发强烈的局部黏膜免疫、体液免疫和细胞免疫,自身具有免疫佐剂效应等许多优点,已广泛应用于病毒[10]、细菌[11]、寄生虫[12]等口服疫苗的研究。减毒沙门菌是构建口服疫苗较好的菌株载体,但良好的口服免疫效果与携带的目的基因表达量有关系,通常目的蛋白质的表达效果与重组菌株在机体内的稳定性、增殖情况、携带基因的长度等有一定关系[13]。
本研究结合PEDV的肠道致病性特点、PEDV S蛋白良好的免疫原性并诱导产生保护性中和抗体及减毒沙门菌可诱导产生局部肠道黏膜免疫反应机制,以减毒鼠伤寒沙门菌SL7207为载体,在保证抗原免疫原性的前提下,对携带3个不同长度的S基因片段(S499-650:长456 bp,编码PEDV S蛋白N末端499—650位氨基酸,为S蛋白核心抗原区域;S499-789:长873 bp,编码PEDV S蛋白N末端499—789位氨基酸,包含S蛋白核心抗原区域及2个B淋巴细胞位点;S1-789:长2 367 bp,编码S蛋白1—789位氨基酸,为S蛋白主要抗原编码区域)和不同质粒DNA长度(分别为3 456、3 873、6 252 bp)的减毒沙门菌SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)、SL7207(pVAXD-S1-789)的生物学特性进行了比较研究,为筛选稳定高效的PEDVS基因口服菌株和开展口服免疫评价奠定基础。
1 材料与方法
1.1 毒株、菌株、细胞和动物
猪流行性腹泻病毒SC-L株,由四川农业大学动物传染病实验室分离保存;减毒沙门菌SL7207(pVAXD-S1-789),由本室前期构建[14];大肠杆菌DH5α、鼠伤寒减毒沙门菌SL7207、COS-7细胞、pVAX1质粒均由本实验室提供; BALB/c小鼠(雌性,6周龄,清洁级)购自成都生物制品研究所。
1.2 主要试剂
兔抗PEDV阳性血清由本室制备保存;FITC标记羊抗兔IgG抗体为北京博奥森公司产品;反转录试剂盒、pMD19-T simple Vector、T4 DNA 连接酶、限制性内切酶购自大连宝生物工程有限公司;总RNA抽提试剂盒、2×TaqPCR Master-Mix 、DNA相对分子质量标准等,购自北京天根生物工程有限公司;去内毒素质粒提取试剂盒Endo-Free Plasmid Mini KitⅠ、质粒提取试剂盒、琼脂糖凝胶回收试剂盒购自美国OMEGA公司;脂质体Lipofectamine 2000购自美国Invitrogen公司。
1.3 引物
参照GenBank公布的SL-C株S基因cDNA序列(Accession number:KC886306),设计3条引物。序列如下,共用上游引物P1:5′-CGAAGCTT-ACCATGGCCACTTTGCCATCATTC-3′(划线处为HindⅢ酶位点);下游引物P2:5′-GGGAATTCTCTGATAGTATACTTGGTACACAC-3′(划线处为EcoRⅠ酶位点);下游引物P3:5′-GGGAATTCTCTAATACTCATACTAAAGT-3′(划线处为EcoRⅠ酶位点)。其中,P1/P2用于扩增S499-650基因;P1/P3用于扩增S499-789基因。引物由大连宝生物工程有限公司合成。
1.4 不同大小的S抗原基因的克隆与鉴定
参照总RNA抽提试剂盒要求,以PEDV细胞培养毒提取RNA,反转录合成cDNA,反转录条件:37 ℃反应15 min,85 ℃反应5 s。取cDNA 1 μL,用引物P1/P2、P1/P3分别进行PCR扩增,反应条件:95 ℃预变性5 min;94 ℃变性30 s,54 ℃复性30 s,72 ℃延伸60 s,30个循环;72 ℃延伸8 min。取10 μL PCR产物于10 g·L-1琼脂糖凝胶电泳检测。将PCR产物胶回收纯化与pMD19-T simple vector连接,并转化DH5α感受态细胞,再涂布于含Amp(100 μg·mL-1)的LB平板,37 ℃培养16 h后,挑取抗Amp阳性菌落扩大培养,抽提质粒进行PCR鉴定及HindⅢ/EcoRⅠ双酶切鉴定,并送至上海英骏生物技术有限公司测序,将获取的重组质粒命名为pMD19-T-S499-650、pMD19-T-S499-789。
1.5S基因真核表达载体的构建
利用HindⅢ/EcoRⅠ对pMD19-T-S499-650、pMD19-T-S499-789、pVAX1分别进行双酶切,分别电泳回收目的基因片段,利用T4 DNA连接酶 16 ℃连接过夜后,转化DH5α感受态细胞。涂布于含Kan(100 μg·mL-1)的LB平板,37 ℃培养16 h,挑取抗Kan阳性菌落扩大培养,抽提质粒进行PCR及HindⅢ/EcoRⅠ酶切鉴定。获取的重组质粒命名为pVAX-S499-650、pVAX-S499-789。
1.6S基因真核表达质粒的体外表达与鉴定
当接种于6孔板的COS-7细胞生长至70%~80%汇集时,按LipofectamineTM2000使用说明书将去内毒素抽提的质粒pVAX1、pVAX-S499-650、pVAX-S499-789分别进行细胞转染。转染36 h后,对COS7细胞固定,封闭,于培养孔中分别加入1∶50稀释的兔抗PEDV阳性血清作一抗,37 ℃孵育2 h;以PBS洗涤3次,加入1 ∶50倍稀释的FITC标记羊抗兔IgG作二抗;于湿盒中37 ℃孵育2 h,PBS洗涤3次,滴加90%甘油水溶液,于倒置显微镜下观察拍照。
1.7 携带S基因的重组沙门菌株的构建
将质粒pVAX-S499-650、pVAX-S499-789以电转化的方法转入减毒鼠伤寒沙门菌SL7207感受态细胞中,电转参数设置:电压2.5 kV、电阻200 Ω、电容25 μF、电击时间3 s。将电转产物涂布于含Kan抗性的平板,37 ℃培养16 h,挑取抗Kan阳性菌落扩大培养,抽提质粒进行PCR及HindⅢ/EcoRⅠ酶切鉴定。将鉴定正确的菌株命名为SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)。
1.8 三株重组沙门菌株的生长曲线测定
将挑单活化的SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)与前期构建的SL7207(pVAXD-S1-789)以1∶100的比例接种于含Kan (100 μg·mL-1)的LB 液体培养基中,37 ℃ 100 r·min-1振荡培养24 h,每间隔2 h 取菌液倍比稀释后涂布于3个含Kan (100 μg·mL-1)的LB 平板,37 ℃培养16 h后菌落计数,以3个平板上菌落平均数的对数绘制生长曲线。
1.9 三株重组沙门菌株的体外稳定性试验
将挑单活化的SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)、SL7207(pVAXD-S1-789)以1∶100的比例接种于普通LB 液体培养基中,37 ℃100 r·min-1振荡培养。培养24 h,分别取100 μL菌液利用灭菌PBS溶液进行适当稀释,取稀释菌液100 μL分别涂布3个含Kan和3个不含Kan的LB平板,37 ℃培养16 h后进行菌落计数。另取50 μL菌液继续传代培养24 h后,重复此操作,连续重复7次。计算非抗性条件下重组沙门菌携带质粒的稳定性。
1.10 三株重组沙门菌株在小鼠体内的稳定性及目的基因的转录检测
分别以1×108CFU·只-1剂量对小鼠灌胃免疫SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)、SL7207(pVAXD-S1-789),设立PBS空白对照组。分别于免疫后第1、3、5、7天,扑杀小鼠,取小鼠肝、脾、回肠,于含0.1%Triton的PBS溶液中研磨静置10 min后,分别涂布于含Kan和不含Kan的SS平板中,37 ℃培养16 h后,进行菌落计数,分析重组菌株在小鼠体内的稳定性。另抽提小鼠的派伊结(Peyer’s patches,PPS)较为集中的回肠组织的总RNA,进行RT-PCR检测,观察目的基因S499-650、S499-789、S1-789在小鼠肠道组织内的转录情况。
1.11 三株重组沙门菌株口服接种小鼠的安全性试验及体内增殖试验
BALB/c小鼠随机分成3组,每组各15只,分别以1×109CFU·只-1剂量灌胃免疫SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)、SL7207(pVAXD-S1-789),设立PBS空白对照组。首免后2周以相同剂量加强免疫。从首免后开始,连续观察免疫小鼠有无异常症状(食欲、饮欲和精神状况等),连续观察5周,同时每周各组随机处死3只小鼠,剖检观察肝、脾、小肠等器官有无病变,并取首免后第三周时的小鼠回肠进行组织病理学观察。另取肝、脾各1 g左右,于2 mL含0.1%Triton的PBS溶液中研磨静置10 min后,取100 μL组织悬液涂抹于含Kan的SS平板中,37 ℃培养16 h后,进行菌落计数,分析重组菌株在小鼠体内的增殖消减情况。
2 结 果
2.1S基因抗原基因的克隆与鉴定
采用RT-PCR扩增的2个S基因大小分别为500、900 bp左右(图1)。质粒pMD19-T-S499-650、pMD19-T-S499-789的PCR产物与HindⅢ/EcoRⅠ双酶切产物片段大小与预期相符(图2)。S499-650、S499-789的基因测序显示,目的基因长度分别为456和873 bp,序列分析显示与PEDV SC-L株S基因完全相同。
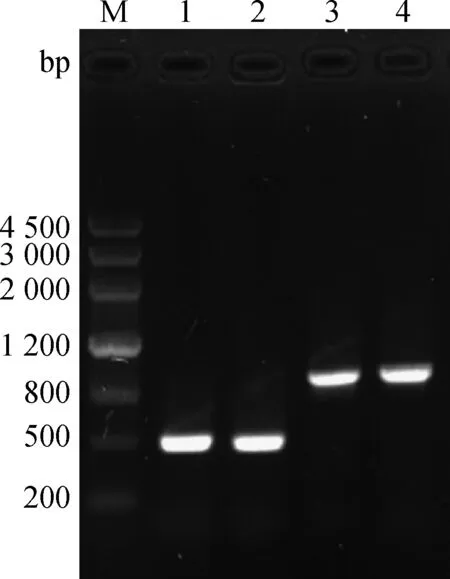
M.DNA Marker III相对分子质量标准;1、2.S499-650基因扩增;3、4.S499-789基因扩增M.DNA Marker III;1,2.Amplification of S499-650 gene;3,4.Amplification of S499-789 gene图1 S499-650 、S499-789基因扩增Fig.1 The amplification of PEDV S499- 650,S499-789
M.DNA Marker III相对分子质量标准;1.S499-650基因扩增;2.pMD19-T-S499-650 HindⅢ、EcoRⅠ双酶切鉴定;3.S499-789基因扩增;4.pMD19-T- S499-789 HindⅢ、EcoRⅠ双酶切鉴定M.DNA Marker III;1.Amplification of S499-650 gene;2.pMD19-T-S499-650 digested by HindⅢ,EcoRⅠ;3.Amplification of S499-789 gene;4.pMD19-T-S499-789 digested by HindⅢ,EcoRⅠ图2 pMD19-T-S499-650、pMD19-T-S499-789的鉴定Fig.2 The identification of pMD19-T-S499-650,pMD19-T-S499-789
2.2S基因真核表达载体的鉴定
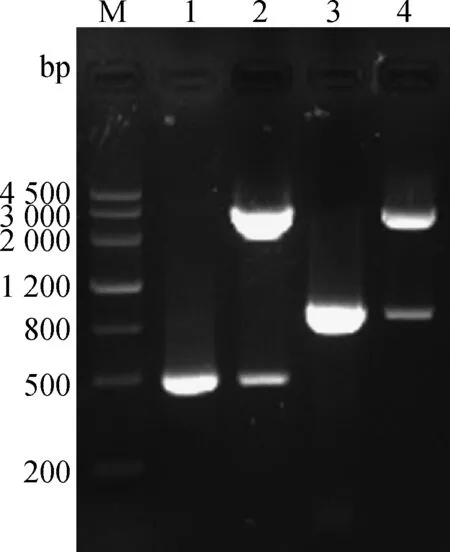
质粒pVAX-S499-650、pVAX-S499-789的PCR产物与HindⅢ/EcoRⅠ双酶切产物片段大小与预期相符(图3)。证明真核表达载体pVAX-S499-650、pVAX- S499-789构建成功。
M.DNA Marker III相对分子质量标准;1.S499-650基因扩增;2.pVAX-S499-650 HindⅢ、EcoRⅠ双酶切鉴定;3.S499-789基因扩增;4.pVAX-S499-789 HindⅢ、EcoRⅠ双酶切鉴定M.DNA Marker III;1.Amplification of S499-650 gene;2.pVAX-S499-650 digested by HindⅢ,EcoRⅠ;3.Amplification of S499-789 gene;4.pVAX-S499-789 digested by HindⅢ,EcoRⅠ图3 pVAX-S499-650、pVAX-S499-789的鉴定Fig.3 The identification of pVAX -S499-650,pVAX -S499-789
2.3 真核表达载体的体外表达与鉴定
转染真核表达质粒36 h后的COS-7细胞IFA
鉴定结果显示:质粒pVAX-S499-650、pVAX-S499-789转染组有特异性绿色荧光,而pVAX1转染组无特异性荧光(图4),表明pVAX-S499-650、pVAX-S499-789在COS-7细胞中,可正常表达S499-650、S499-789蛋白,且能与PEDV特异性抗体发生反应。

A.转染pVAX-S499-650的COS-7细胞;B.转染pVAX-S499-789的COS-7细胞;C.转染pVAX1的COS-7细胞A.pVAX-S499-650 transfected COS-7 cell;B.pVAX-S499-789 transfected COS-7 cell;C.pVAX1 transfected COS-7 cell图4 pVAX-S499-650、pVAX-S499-789表达产物的间接免疫荧光鉴定Fig.4 Indirect immunofluorescence detection of the expression of pVAX-S499-650,pVAX-S499-789
2.4 携带S基因的重组沙门菌株的鉴定
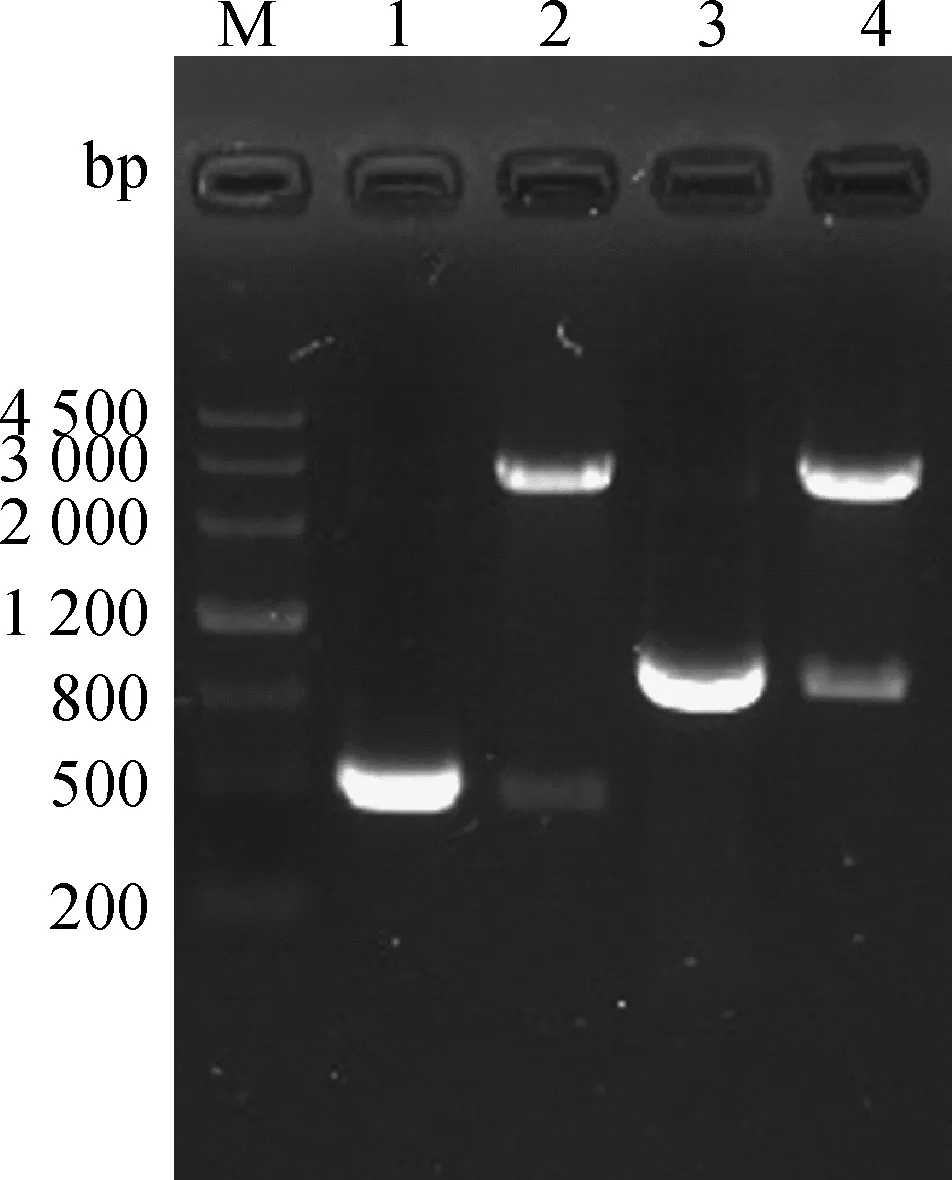
将构建的重组沙门菌扩大培养后,抽提质粒,进行PCR及HindⅢ/EcoRⅠ双酶切产物条带与预期相符(图5)。证明真核表达载体pVAX-S499-650、pVAX-S499-789成功电转入鼠伤寒减毒沙门菌SL7207,SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)构建成功。
2.5 三株重组减毒沙门菌株的生长曲线
重组沙门菌在接种4 h后迅速进入对数生长期;在培养第6-16小时时,为细菌生长稳定期;于接种16 h后,细菌开始进入衰亡期。携带质粒DNA片段越长的重组沙门菌株,其生长越缓慢(图6)。2.6 三株重组沙门菌株的体外稳定性试验
体外培养稳定性试验表明,在不含Kan抗性的培养环境下,重组沙门菌中的质粒随着细菌的增殖而逐渐丢失,在连续培养4 d后(传代约80代),质粒携带率降至50%以下;连续培养7 d时(传代约140代),SL7207(pVAXD-S1-789)携带率降至1.2%,SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)仍均保持在6%以上;携带质粒DNA片段越长,重组菌株的稳定性越差(图7)。
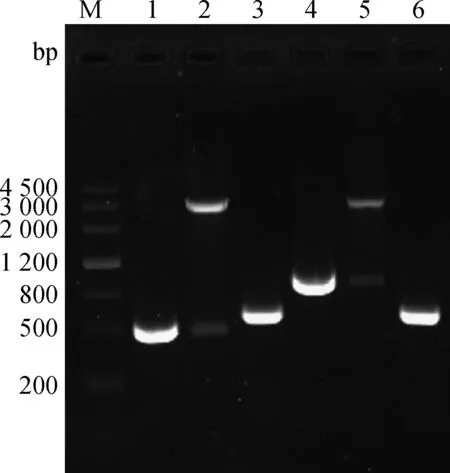
M.DNA Marker III相对分子质量标准;1.S499-650基因扩增;2.pVAX-S499-650 HindⅢ、EcoRⅠ双酶切鉴定;3.SL7207(pVAX-S499-650)沙门菌鉴定;4.S499-789基因扩增;5.pVAX-S499-789 HindⅢ、EcoRⅠ双酶切鉴定;6.SL7207(pVAX-S499-789)沙门菌鉴定M.DNA Marker III;1.Amplification of S499-650 gene;2.pVAX-S499-650 digested by HindⅢ,EcoRⅠ;3.Identification of Salmonella SL7207(pVAX-S499-650);4.Amplification of S499-789 gene;5.pVAX-S499-789 digested by HindⅢ,EcoRⅠ;6.Identification of Salmonella SL7207(pVAX-S499-789)图5 SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)的鉴定Fig.5 The identification of SL7207(pVAX-S499-650),SL7207(pVAX-S499-789)
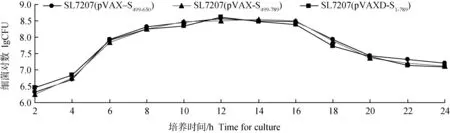
图6 重组减毒沙门菌株的生长曲线Fig.6 Growth curve of the recombinant Salmonella typhimurium strains
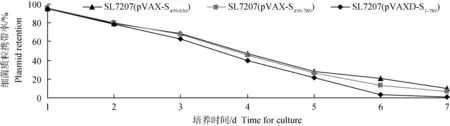
图7 重组沙门菌的体外稳定性分析Fig.7 The stability of recombinant Salmonella typhimurium strains harbouring plasmids in vitro
2.7 三株重组沙门菌株在小鼠体内的稳定性
体内稳定性显示:随着重组沙门菌株在小鼠体内增殖,菌体携带的质粒也逐渐稳定丢失。在免疫后第7天,重组菌株质粒携带率为50%,但SL7207(pVAXD-S1-789)携带率与SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)相差在5%左右;携带质粒DNA片段越长,重组菌株在小鼠体内稳定性越差(图8)。
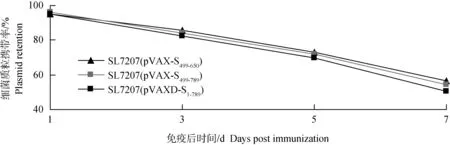
图8 重组沙门菌株的体内稳定性分析Fig.8 The stability of recombinant Salmonella typhimurium strains harbouring plasmids in vivo
2.8 三株重组沙门菌株在小鼠体内的稳定性及目的基因的转录检测
小鼠灌胃接种不同重组菌株后第1、3、5、7天采集回肠末端,提取细胞总RNA,通过RT-PCR检测抗原基因在组织内的转录情况,结果显示在免疫后第3、5、7天可扩增出预期片段;对照组PBS免疫小鼠肠道总RNA的RT-PCR 结果为阴性(图9)。
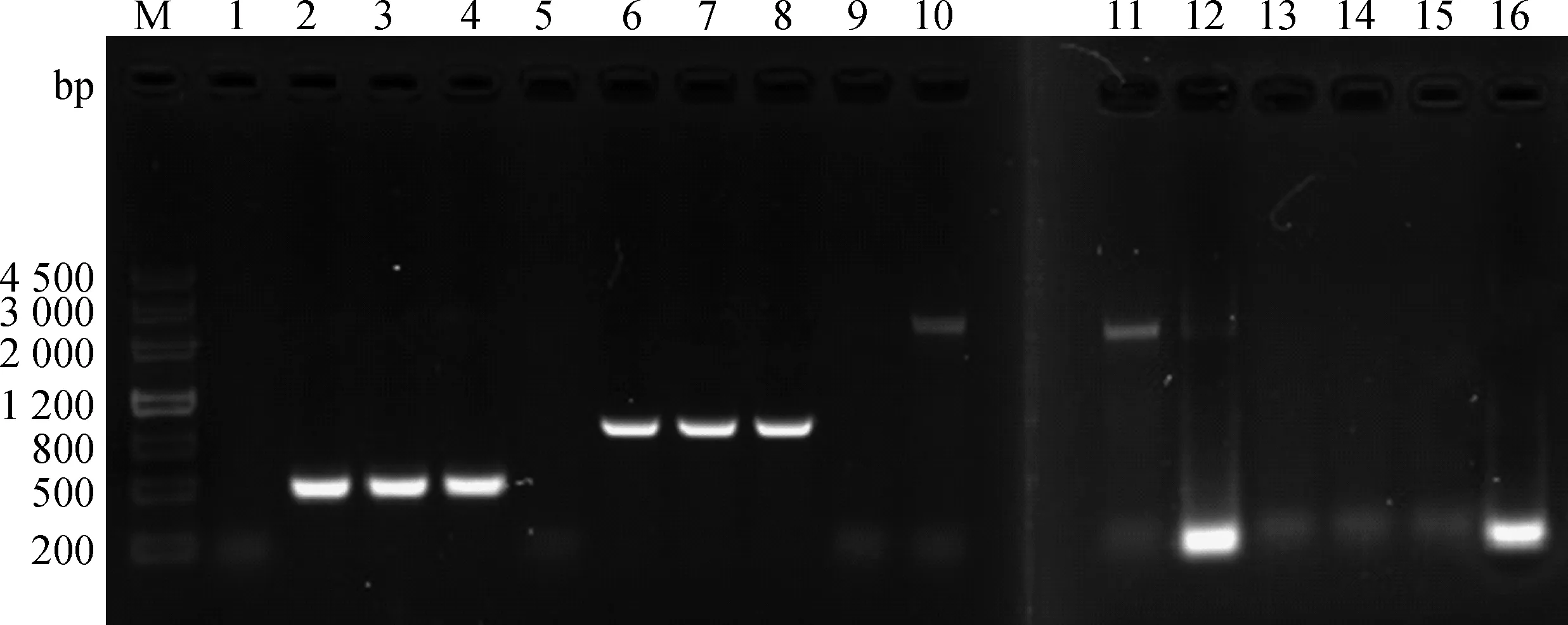
M.DNA Marker III相对分子质量标准;1~4.接种SL7207(pVAX-S499-650)后第1、3、5、7天;5~8.接种SL7207(pVAX-S499-789)第1、3、5、7天;9~12.接种SL7207(pVAXD-S1-789)后第1、3、5、7天;13~16.接种PBS后第1、3、5、7天M.DNA Marker III;1-4.Day 1,3,5,7 post-immunization with SL7207(pVAX-S499-650);5-8.Day 1,3,5,7 post-immunization with SL7207(pVAX-S499-789);9-12.Day 1,3,5,7 post-immunization with SL7207(pVAXD-S1-789);13-16.Day 1,3,5,7 post-immunization with PBS图9 RT-PCR检测S基因在回肠内的转录Fig.9 RT-PCR to detect the transcription of S gene in ileum
2.9 三株重组沙门菌株在小鼠体内的增殖试验
脏器悬液菌落计数显示,在首次免疫后第1周,不同菌株免疫组小鼠肝、脾内均可分离到重组细菌;首免后第2周,菌落数有所下降;二次免疫后第1周,菌落数略微上升后急剧下降,于二免后第3周脾中的菌落数几乎都为零,而肝中的菌落数以SL7207(pVAXD-S1-789)几乎为零,而SL7207(pVAX-S499-789)、SL7207(pVAX-S499-650)仍然可明显分离到。这表明重组沙门氏菌完成质粒传递后,逐渐被机体清除,但携带不同长度质粒DNA的重组菌株在体内稳定性存在一定的差异,携带质粒DNA长度越长的减毒沙门菌株,菌落数越低,也越早被机体清除(图10)。
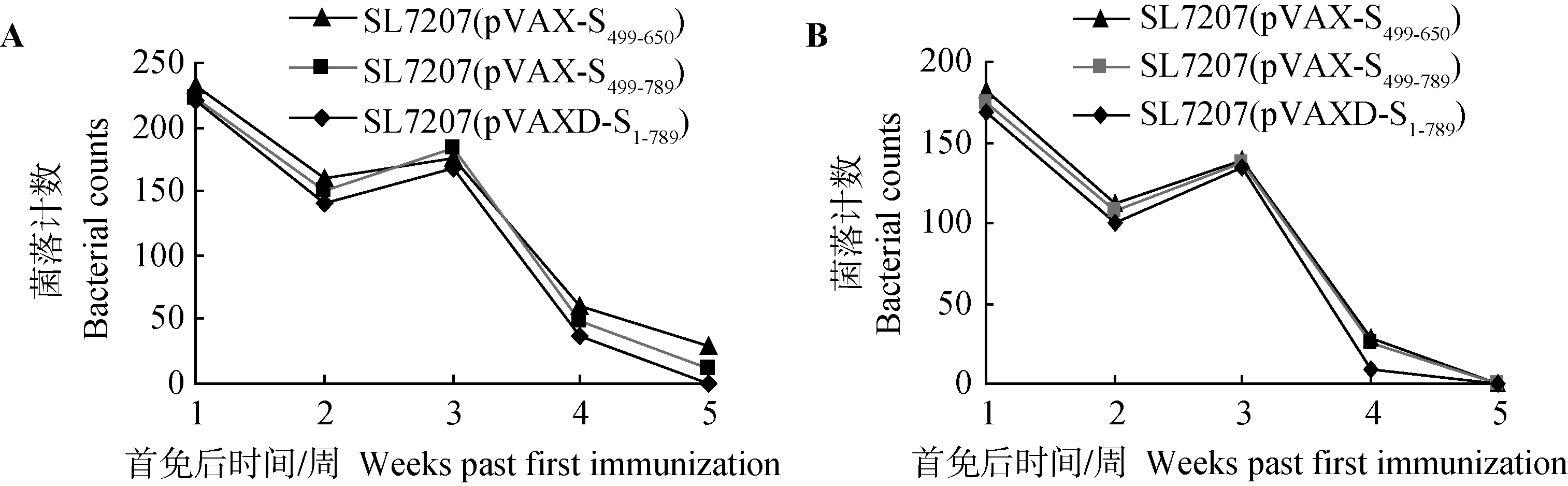
图10 重组菌株在肝(A)和脾(B)中的增殖Fig.10 Colonization of recombinant Salmonella typhimurium in liver (A) and spleen (B)
2.10 三株重组沙门菌株口服接种小鼠的安全性
连续5周对各组试验小鼠进行观察,灌胃后的1~2 d,由于应激反应,部分小鼠出现扎堆、精神不振和食欲降低的现象;继续观察,小鼠的食欲、饮欲和精神状况恢复正常。解剖小鼠,重组沙门菌菌株免疫组小鼠与PBS对照组小鼠的肝、脾及小肠等器官均未见明显病理变化。回肠组织病理切片显示:回肠组织出现肠壁固有层与肌层分离;小肠绒毛脱落变短;小肠绒毛上皮细胞减少,杯状细胞增多等病理变化(图11)。
A.肠壁固有层与肌层分离(100×);B.小肠绒毛脱落(100×);C.小肠绒毛上皮细胞减少,杯状细胞增多(400×)A.Lamina propria is separated with muscle layer in intestinal wall (100×);B.Shedding of intestinal villi (100×);C.Epithelium cells decreased and goblet cells increased in intestinal villi (400×)图11 重组沙门菌免疫小鼠回肠组织的病理变化Fig.11 Pathological change of ileum tissue of mouse immunized with recombinant Salmonella
3 讨 论
目的基因的选择对所构建的重组疫苗的免疫原性有决定性作用。本研究所选择3个不同长度的S基因片段:S499-650编码S蛋白核心抗原区域[7];S499-789编码S蛋白核心抗原区域及2个B淋巴细胞位点[8];S1-789编码S蛋白主要抗原区域[9],均具有良好的免疫原性。抗原基因的长度也对所构建的重组疫苗的免疫原性有重要影响,通常抗原基因越长,反转录的mRNA就越长,越易形成发卡结构,阻止mRNA与核糖体的结合,导致抗原蛋白质表达量不足[15];此外,质粒DNA的长度越长,重组菌株在体内外稳定性越差,质粒DNA的传递效率越低,进而影响抗原蛋白质的表达量。结合本研究,携带质粒DNA长度为6 252 bp的SL7207(pVAXD-S1-789)在体内/外稳定性均低于携带质粒DNA长度分别为3 456、3 873 bp的 SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789);由于在体内稳定性的差异,SL7207(pVAXD-S1-789)在小鼠肝、脾的增殖量也均低于SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)。这些都将会对SL7207(pVAXD-S1-789)在机体内的免疫效果产生影响。
沙门菌通过消化道感染机体后,可在侵袭基因沙门菌致病岛(Salmonellapathogenicity island Ⅰ,SPI1)的作用下入侵主要位于回肠末端的微皱褶细胞(microfold cell,M细胞);也可被树突状细胞(dendritic cell,DCs)直接捕获。进入机体后,被CD18+分泌的吞噬细胞吞噬并输送到达肝、脾等处[16],因此沙门菌具备良好的侵袭力。减毒鼠伤寒沙门菌SL7207由于缺失了aroA基因,在保持良好的侵袭力的同时毒力大大降低[17],已被广泛应用于重组口服疫苗的制备。携带外源DNA的重组沙门菌侵入机体后,由于菌体发生溶解而释放外源DNA,使抗原基因在体内发生转录和翻译,从而诱导相应的细胞免疫和体液免疫反应[13]。选择派伊结等免疫组织集中的回肠末端进行目的基因的转录试验表明,抗原基因可在肠道内进行转录,进而表达抗原蛋白质,从而诱导强烈的肠道黏膜免疫反应;小鼠肝、脾内的增殖试验则显示了以减毒鼠伤寒沙门菌SL7207为载体的重组减毒沙门菌株具有良好的侵袭力,可在机体内增殖,并在机体免疫系统的作用下逐渐被清除;小鼠的安全性试验及回肠末端的病理变化显示,口服重组沙门菌后,会对小肠造成一定的组织损伤,但损伤不足以引起腹泻等临床症状及肉眼可见的病理变化,因此表明三株重组菌株是安全的,同时,杯状细胞数量增多,显示肠道分泌黏液能力和对抗原呈递作用的加强[18],这表明在减毒沙门菌的刺激下,肠道局部黏膜反应增强。这些研究结果均显示了重组菌株作为PEDV口服疫苗的可行性。
本研究对不同长度的S基因的体外表达和体内稳定性也进行了研究和比较,构建真核表达质粒pVAX-S499-650、pVAX-S499-789转染COS-7细胞后,从体外证实均可表达出S蛋白而显示出特异性的荧光,随后将构建的重组减毒沙门菌SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)与SL7207(pVAXD-S1-789)的生物学特性进行比较,结果表明携带3种不同大小的PEDVS抗原基因能够在小鼠肠道组织中进行一定时间的转录,且3株减毒沙门菌菌株均具有较高的质粒稳定性及良好的口服安全性,可在小鼠体内进行增殖,但会逐渐被机体所清除,避免了免疫耐受情况的产生。以上结果表明:SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)、SL7207(pVAXD-S1-789)可以稳定携带不同大小的S基因片段,初步具备作为疫苗菌株的条件,但实际的口服免疫效果需要动物免疫评价,本研究后续拟在猪体开展这三株疫苗的免疫效果评价,并与当前的商品化疫苗进行比较,为科学评估新型PEDV口服疫苗的可行性提供科学依据。
4 结 论
构建携带不同长度猪流行性腹泻病毒S基因片段重组减毒沙门菌菌株SL7207(pVAX-S499-650)(携带片段长456 bp,编码S蛋白N末端499—650位氨基酸)、SL7207(pVAX-S499-789)(携带片段长873 bp,编码S蛋白N末端499—789位氨基酸),随后比较SL7207(pVAX-S499-650)、SL7207(pVAX-S499-789)与前期构建的菌株SL7207(pVAXD-S1-789)(携带片段长2 367 bp,编码S蛋白N末端1—789位氨基酸)的生物学特性,3种口服菌株均具有较高的稳定性;携带的目的基因可在肠道组织内转录;菌株在小鼠肝、脾中增殖约5周后逐渐被机体清除;具有良好的口服安全性。可见减毒鼠伤寒沙门菌SL7207可递呈不同长度的S基因抗原片段。
[1] SERGEEV O V.Porcine epidemic diarrhea[J].VoprVirusol,2009,54(2):4-8.
[2] SONG D,PARK B.Porcine epidemic diarrhoea virus:a comprehensive review of molecular epidemiology,diagnosis,and vaccines[J].VirusGenes,2012,44(2):167-175.
[3] LI B X,GE J W,LI Y J.Porcine aminopeptidase N is a functional receptor for the PEDV coronavirus[J].Virology,2007,365(1):166-172.
[4] SATO T,TAKEYAMA N,KATSUMATA A,et al.Mutations in the spike gene of porcine epidemic diarrhea virus associated with growth adaptation in vitro and attenuation of virulenceinvivo[J].VirusGenes,2011,43(1):72-78.
[5] SUO S,REN Y,LI G,et al.Immune responses induced by DNA vaccines bearing Spike gene of PEDV combined with porcine IL-18[J].VirusRes,2012,167(2):259-266.
[6] DUARTE M ,LAUDE H.Sequence of the spike protein of the porcine epidemic diarrhoea virus[J].JGenVirol,1994,75(Pt 5):1195-1200.
[7] SUN D B,FENG L,SHI H Y,et al.Spike protein region (aa 636-789) of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J].ActaVirol,2007,51(3):149-156.
[8] SUN D,FENG L,SHI H,et al.Identification of two novel B cell epitopes on porcine epidemic diarrhea virus spike protein[J].VetMicrobiol,2008,131(1-2):73-81.
[9] CAO L,QIN Z,GE X,et al.Generation of a monoclonal antibody to S1 protein of porcine epidemic diarrhea virus[J].MonoclonAntibImmunodiagnImmunother,2013,32(5):371-374.
[10] QIU L,WANG X,HAO H,et al.Oral administration of attenuatedSalmonellatyphimuriumcontaining a DNA vaccine against rabbit haemorrhagic disease[J].JVirolMethods,2013,188(1-2):108-113.
[11] NANDRE R M,LEE J H.Construction of a recombinant-attenuatedSalmonellaEnteritidisstrain secreting Escherichia coli heat-labile enterotoxin B subunit protein and its immunogenicity and protection efficacy against salmonellosis in chickens[J].Vaccine,2014,32(3):425-431.
[12] CASTILLO A M,VAQUERO V A,FONSECA L R,et al.A prime-boost vaccination of mice with attenuatedSalmonellaexpressing a 30-mer peptide from theTrichinellaspiralisgp43 antigen[J].VetParasitol,2013,194(2-4):202-206.
[13] WEISS S.Transfer of eukaryotic expression plasmids to mammalian hosts by attenuatedSalmonellaspp[J].IntJMedMicrobiol,2003,293(1):95-106.
[14] 梁恩涛,廖晓丹,黄小波,等.携带猪流行性腹泻病毒S基因的减毒沙门菌的构建与鉴定[C]//金宁一,钱 军,陈溥言.中国畜牧兽医学会动物传染病学分会第十五次学术研讨会论文集.中国徐州:中国畜牧兽医学会动物传染病学分会,2013:531-536. LIANG E T,LIAO X D,HUANG X B,et al.Construction and identification of attenuatedSalmonellatyphimuriumharboring porcine epidemic diarrhea virusSgene[C]//JIN N Y,QIAN J,CHEN P Y.The fifteenth symposium of BDAID.Xuzhou,China:BDAID,2013:531-536.(in Chinese)
[15] 黄小波,张鑫淼,曹三杰,等.减毒沙门氏菌递呈的TGEV S/N融合基因疫苗的口服免疫原性[J].中国人兽共患病学报,2013,29(6):594-600. HUANG X B,ZHANG X M,CAO S J,et al.Immunogenicity of attenuatedSalmonellatyphimuriumharbouring S/N fusion gene of porcine transmissible gastroenteritis virus[J].ChineseJournalofZoonoses,2013,29(6):594-600.(in Chinese)
[16] MASTROENI P,CHABALGITY J A,DUNSTAN S J,et al.Salmonella:immune responses and vaccines [J].VetJ,2001,161(2):132-164.
[17] HOISETH S K,STOCKER B A.Aromatic-dependentSalmonellatyphimuriumare non-virulent and effective as live vaccines [J].Nature,1981,291(5812):238-239.
[18] MCDOLE J R,WHEELER L W,MCDONALD K G,et al.Goblet cells deliver luminal antigen to CD103+ dendritic cells in the small intestine[J].Nature,2012,483(7389):345-349.
(编辑 白永平)
Study on the Biological Characteristics of Three AttenuatedSalmonellatyphimuriumStrains Harboring Porcine Epidemic Diarrhea VirusSGene
LIANG En-tao1,CHEN Jie1,HUANG Xiao-bo1,2*,WEN Xin-tian1,2, CAO San-jie1,2,WU Xue-jing1,ZHU Shu-quan1
(1.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Ya’an625014,China;2.LaboratoryofZoonosisandPigDiseasePreventionResearchCenter,SichuanAgriculturalUniversity,Chengdu611130,China)
To explore the feasibility of attenuatedSalmonellatyphimuriumas the carrier of porcine epidemic diarrhea virus (PEDV)Sgene,the biological characteristics of three recombinant attenuatedSalmonellastrains harboring varying length of PEDVSgene were researched.The biological characteristics research of SL7207(pVAX-S499-650) (456 bp,encoding 499-650 amino acid of N-termanal S protein,SL7207(pVAX- S499-789) (873 bp,encoding 499-789 amino acid of N-termanal S protein),SL7207(pVAXD-S1-789) (2 367 bp,encoding 1-789 amino acid of N-termanal S protein) which harboring PEDVSgenes in varying length plasmid DNA showed:SL7207(pVAX-S499-650),SL7207(pVAX-S499-789) and SL7207(pVAXD-S1-789) were steadyinvivo/vitro;the target genes could be transcribed in the ileum tissue of mouse;recombinant strains could colonize in liver and spleen of mice and gradually eliminated by host;safety to BALB/c mouse at the dosage of 1×109CFU by oral administration.All of this,demonstrating the attenuatedS.typhimuriumcould be the carrier of PEDVSgene and laying the foundation for evaluating the immunogenicity of recombinant attenuatedSalmonellastrains in piglet.
porcine epidemic diarrhea virus;Sgene;attenuatedSalmonellatyphimurium;oral administration;biological characteristics
10.11843/j.issn.0366-6964.2015.02.015
2014-06-07
国家自然科学基金(31072144;30901084);国家公益性行业(农业)科研专项(20123056)
梁恩涛(1989-),男,河南平顶山人,硕士生,主要从事猪流行性腹泻新型口服疫苗的研究,E-mail:pdsliangentao@sina.com;陈 杰(1992-),男,四川绵竹人,硕士生,主要从事猪流行性腹泻疫苗的研究,E-mail:chenjie1992@sina.com。二人并列第一作者
*通信作者:黄小波,教授,E-mail:rsghb110@126.com
S858.285.3
A
0366-6964(2015)02-0279-09



