刘腾飞,田 静,耿智霞,李会敏,余祖功
(南京农业大学动物医学院,南京 210095)
抗菌药物对LPS诱导鸡肝细胞损伤的影响及复方甘草酸单胺的修复效应
刘腾飞,田 静,耿智霞,李会敏,余祖功*
(南京农业大学动物医学院,南京 210095)
旨在探索LPS诱导鸡肝细胞损伤过程中抗菌药物的影响及复方甘草酸单胺(CAG)的修复作用。选用半原位灌流法分离鸡肝细胞,原代培养48 h,筛选LPS最佳致肝细胞损伤剂量;固定其最佳致损半量,并添加不同质量浓度的恩诺沙星、氟苯尼考、阿莫西林,观察致损效果;LPS(30 μg·mL-1)+恩诺沙星(80 μg·mL-1)致损24 h,给予不同浓度CAG,检测细胞存活率及ALT、AST、SOD、GSH、MDA活性,流式细胞术检测细胞凋亡率。结果表明,LPS ≤ 50 μg·mL-1,肝细胞损伤不明显,LPS ≥ 60 μg·mL-1,肝细胞存活率极显着降低(P<0.01),ALT、AST活性极显着升高(P<0.01)。LPS(30 μg·mL-1)各组随恩诺沙星、氟苯尼考、阿莫西林添加量增加,肝细胞损伤程度相应加大,LPS(30 μg·mL-1)+恩诺沙星(80 μg·mL-1)、LPS(30 μg·mL-1)+氟苯尼考(40 μg·mL-1)、LPS(30 μg·mL-1)+阿莫西林(60 μg·mL-1)可达肝细胞损伤标准。CAG剂量依赖性(25、50、100、200、400 μg·mL-1)抑制LPS(30 μg·mL-1)+恩诺沙星(80 μg·mL-1)引起的ALT、AST、MDA活性和肝细胞早期凋亡比率的升高,提高SOD、GSH及肝细胞存活率。结果提示,LPS可致肝细胞损伤;抗菌药物使LPS更易诱发肝损伤;CAG通过抗氧化,并抑制细胞凋亡对鸡肝细胞发挥保护作用。
LPS;恩诺沙星;氟苯尼考;阿莫西林;复合式肝细胞损伤;复方甘草酸单胺
家禽集约化趋势明显,受困于养殖密度与环境,大肠杆菌、沙门菌等感染多发,抗菌药物广为使用。诸多类抗菌药物在杀菌的同时,会促进内毒素释放,以阿莫西林、头孢类、氟喹诺酮类、氟苯尼考等报道促释明显[1-2]。内毒素即革兰阴性菌细胞壁上的脂多糖(lipopolysaccharide,LPS),细菌裂解或黏附其他细胞时释放,过量LPS进入血液,导致肝损伤[3]。
兽医临床病鸡肝损伤症状多见,LPS作用明确[3]。抗菌药物使用与存在是否影响LPS致肝损伤的发生、病理及转归等未见报道。作者采用体外鸡原代肝细胞培养的方法,探索恩诺沙星、氟苯尼考、阿莫西林等对LPS致肝细胞损伤的影响,并研究复方甘草酸单胺(CAG)对该复合损伤的保护效应及机制。
1 材料与方法
1.1 试验动物
40~50日龄健康海蓝公鸡,购自南京汤泉鸡场,体重(1.5±0.2) kg。
1.2 主要药品、试剂和仪器
恩诺沙星、氟苯尼考、阿莫西林(≥99.0%),浙江国邦药业有限公司。CAG,实验室自制,每100 g含甘草酸单胺2.8 g(西安富捷药业有限公司),甘氨酸和蛋氨酸各2 g(南宁赢创药业有限公司)。胶原酶(Ⅳ型)、牛胰岛素、MTT、内毒素(LPS)、Williams′ medium E培养液(Sigma公司),胎牛血清、青链霉素(双抗)(Gibco公司),Annexin V-FITC/PI(Ebioscience公司)。超氧化物歧化酶(SOD)、丙二醛(MDA)、微量还原性谷胱甘肽(GSH)、丙氨酸氨基转移酶(ALT)及门冬氨酸氨基转移酶(AST)测试试剂盒(南京建成生物工程研究所)。流式细胞仪(Facscalibur,BD Bioscience),全自动酶标仪和分光光度计(iMark和SmartSpec3000,Bio-Rad)。
1.3 试验方法
1.3.1 鸡肝细胞分离 在P.O.Seglen[4]两步法的基础上改进,翅静脉注射肝素钠(1 750 IU·kg-1)抗凝,腹腔注射戊巴比妥钠(50 mg·kg-1)麻醉供试鸡。无菌打开腹腔,结扎肠系膜总静脉、胰十二指肠静脉和腺胃脾静脉,肝门静脉插管,打开前腔静脉,37 ℃冲洗液A(33 mmol·L-1HEPES,127.8 mmol·L-1NaCl,3.15 mmol·L-1KCl,0.7 mmol·L-1Na2HPO4·12H2O,0.6 mmol·L-1EGTA,pH 7.6)冲洗。然后,37 ℃冲洗液B(33 mmol·L-1HEPES,127.8 mmol·L-1NaCl,3.15 mmol·L-1KCl,0.7 mmol·L-1Na2HPO4·12H2O,3 mmol·L-1CaCl2)冲洗。将肝转移到无菌烧杯中,37 ℃ 100 mL 0.5% Ⅳ型胶原酶循环灌注20~25 min,流速约为20 mL·min-1。撕开肝包膜,D-Hanks洗脱肝细胞,100、200目滤网过滤,500 r·min-1离心3 min,弃上清,重复2次。生长培养基(含10%胎牛血清,2%双抗,0.5 mg·L-1牛胰岛素的Williams' medium E培养液)重悬细胞。
1.3.2 肝细胞培养 台盼蓝活细胞计数>95%,调整细胞浓度以5×105·mL-1接种于细胞培养板,37 ℃、5% CO2、饱和湿度静置培养。细胞48~144 h处于生长稳定期,可用于试验。
1.3.3 LPS致肝细胞损伤试验分组 取正常培养48 h的肝细胞分2组(n=6),对照组:用生长培养液换液;LPS组:分别用含10、20、30、40、50、60、80、100 μg·mL-1LPS的生长培养液换液,继续培养24 h。
1.3.4 LPS联合恩诺沙星、氟苯尼考、阿莫西林致肝细胞损伤试验分组 取正常培养48 h的肝细胞分4组(n=6),对照组:用生长培养液换液;LPS+恩诺沙星组:分别用含30+20、30+40、30+60、30+80、30+100 μg·mL-1LPS+恩诺沙星的生长培养液换液;LPS+氟苯尼考组:分别用含30+20、30+40、30+60、30+80、30+100 μg·mL-1LPS+氟苯尼考的生长培养液换液;LPS+阿莫西林组:分别用含30+20、30+40、30+60、30+80、30+100 μg·mL-1LPS+阿莫西林的生长培养液换液,继续培养24 h。
1.3.5 CAG对肝细胞保护作用试验分组 取正常培养48 h肝细胞分3组(n=6),对照组:生长培养液换液,继续培养24 h;模型组:含 LPS(30 μg·mL-1)+恩诺沙星(80 μg·mL-1)的生长培养液换液,继续培养24 h;CAG组:含 LPS(30 μg·mL-1)+恩诺沙星(80 μg·mL-1)的生长培养液培养24 h后,用含CAG质量浓度为25、50、100、200、400 μg·mL-1的生长培养液换液,继续培养24 h。1.3.6 MTT法测定细胞活率 各组终止培养前加入20 μL MTT(5 g·L-1),37 ℃,5% CO2孵育4 h。弃去上清液,每孔内加入 DMSO 150 μL,静置10 min。在酶标仪 570 nm 下测定各孔吸光度值,细胞相对存活率=(OD试验孔-OD空白孔)/(OD对照孔-OD空白孔)×100%,OD=(optical density)。1.3.7 细胞酶学指标检测 细胞上清液丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST);细胞匀浆液超氧化物歧化酶(SOD)、微量还原性谷胱甘肽(GSH)、丙二醛(MDA)活力或含量均由酶标仪检测,按试剂盒说明操作。
1.3.8 肝细胞凋亡检测 按Annexin V-FITC/PI细胞凋亡试剂盒说明操作,在南京农业大学细胞形态仪器室由流式细胞仪检测。
1.4 数据处理
所得数据使用统计学软件SPSS 19.0 进行分析。
2 结 果
2.1 LPS对肝细胞上清液中ALT、AST活性及存活率影响
由表1所示,随LPS浓度增加,ALT、AST释放度与肝细胞存活率呈剂量依赖性上升和降低。与对照组相比,LPS质量浓度≥50 μg·mL-1时ALT、AST升高极显着(P<0.01);LPS质量浓度为60 μg·mL-1,细胞存活率为48.19%±2.56%,该质量浓度处理下细胞存活率与ALT、AST释放度均较为适宜,适合作为LPS诱导肝细胞损伤最佳剂量。
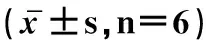
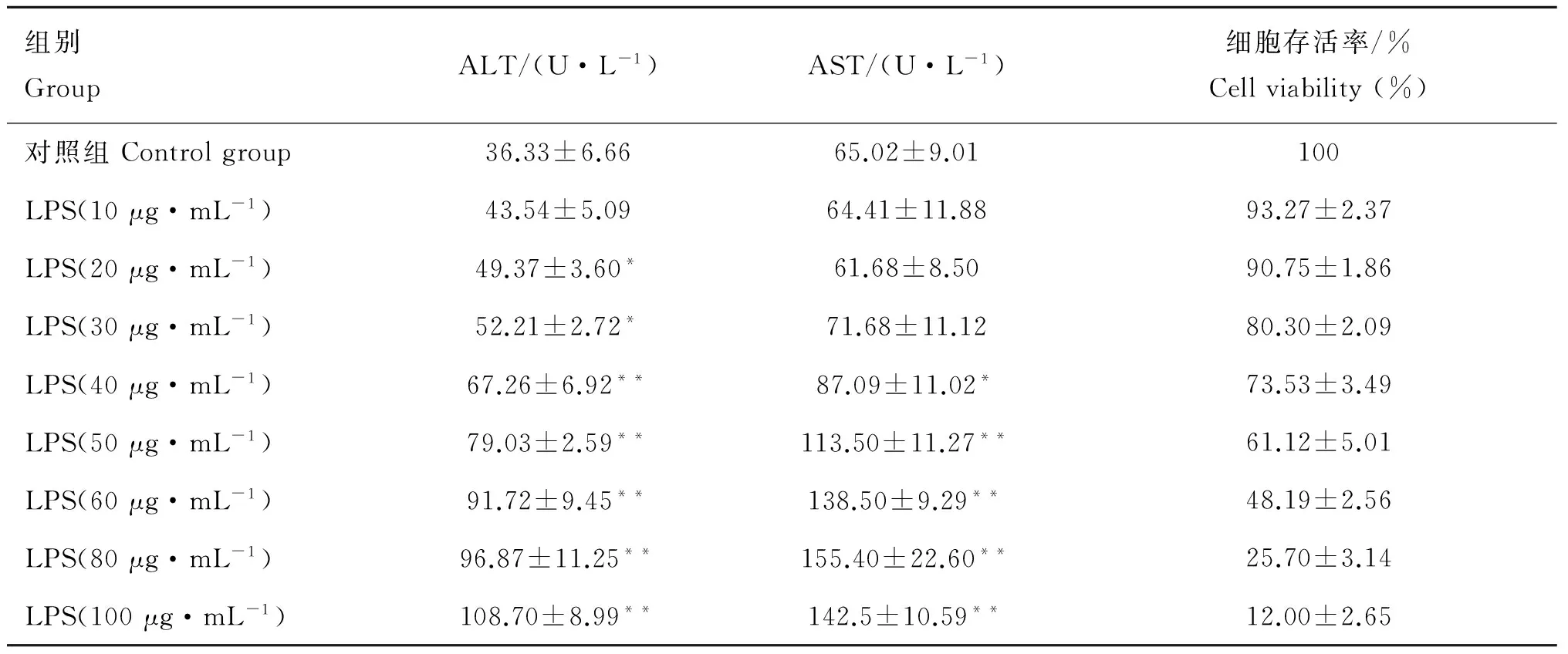
组别GroupALT/(U·L-1)AST/(U·L-1)细胞存活率/%Cellviability(%)对照组Controlgroup36.33±6.6665.02±9.01100LPS(10μg·mL-1)43.54±5.0964.41±11.8893.27±2.37LPS(20μg·mL-1)49.37±3.60*61.68±8.5090.75±1.86LPS(30μg·mL-1)52.21±2.72*71.68±11.1280.30±2.09LPS(40μg·mL-1)67.26±6.92**87.09±11.02*73.53±3.49LPS(50μg·mL-1)79.03±2.59**113.50±11.27**61.12±5.01LPS(60μg·mL-1)91.72±9.45**138.50±9.29**48.19±2.56LPS(80μg·mL-1)96.87±11.25**155.40±22.60**25.70±3.14LPS(100μg·mL-1)108.70±8.99**142.5±10.59**12.00±2.65
与对照组比较*.P<0.05,**.P<0.01;与模型组比较#.P<0.05,##.P<0.01,下表同*.P<0.05,**.P<0.01,compared to control group;#.P<0.05,##.P<0.01,compared to model group,the same as below
2.2 LPS联合恩诺沙星、氟苯尼考、阿莫西林对肝细胞培养上清液中ALT、AST活性及存活率影响
由表2所示,随LPS中添加的恩诺沙星、氟苯尼考、阿莫西林质量浓度的增加,肝细胞损伤程度相应加大。其中LPS(30 μg·mL-1)+恩诺沙星(80 μg·mL-1)、LPS(30 μg·mL-1)+氟苯尼考(40 μg·mL-1)、LPS(30 μg·mL-1)+阿莫西林(60 μg·mL-1)使肝细胞存活率下降50%,ALT、AST活性极显着升高(P<0.01),故确定以上组合质量浓度作为新型复合式肝细胞损伤最佳造模剂量。
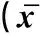
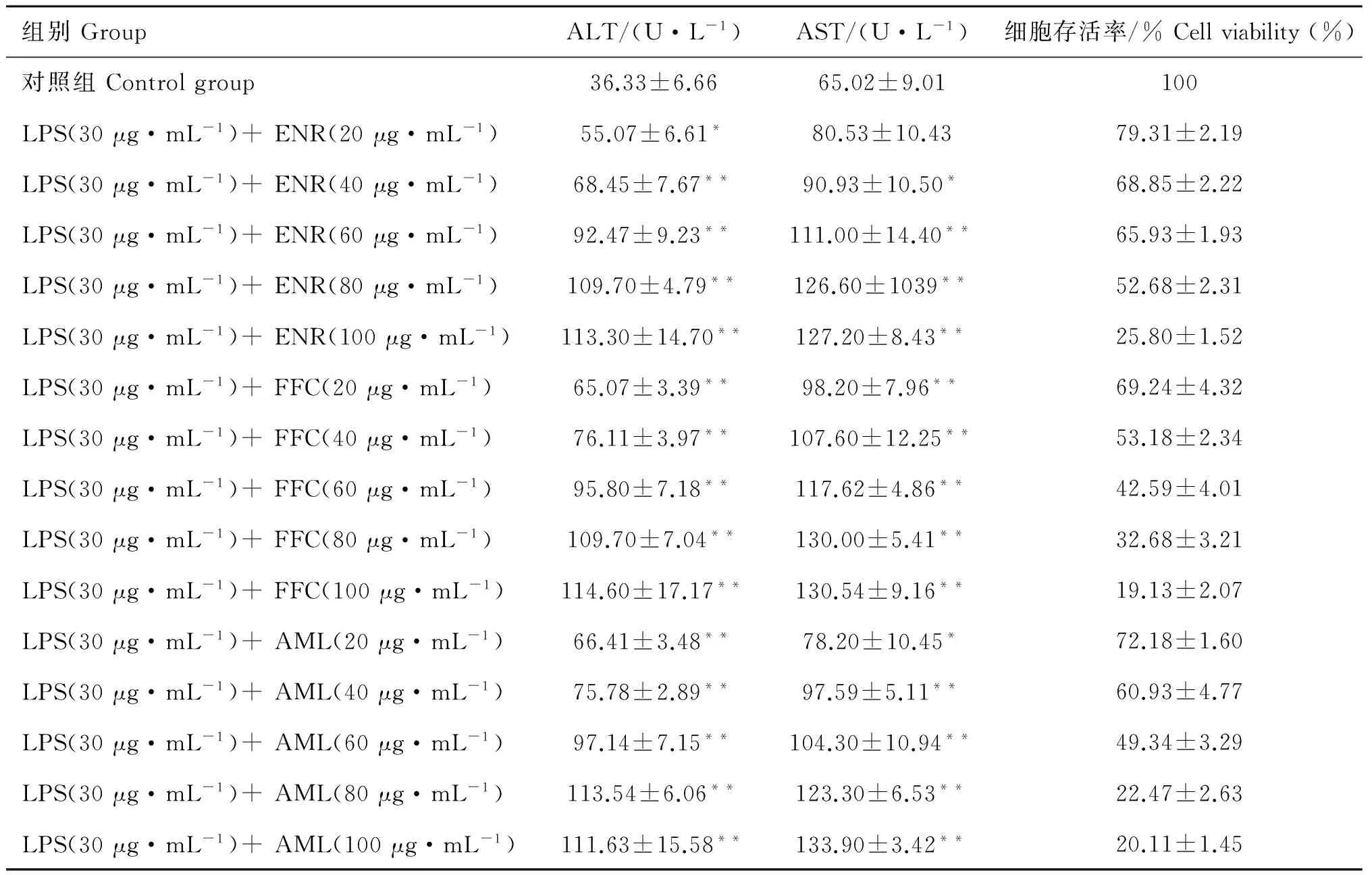
组别GroupALT/(U·L-1)AST/(U·L-1)细胞存活率/%Cellviability(%)对照组Controlgroup36.33±6.6665.02±9.01100LPS(30μg·mL-1)+ENR(20μg·mL-1)55.07±6.61*80.53±10.4379.31±2.19LPS(30μg·mL-1)+ENR(40μg·mL-1)68.45±7.67**90.93±10.50*68.85±2.22LPS(30μg·mL-1)+ENR(60μg·mL-1)92.47±9.23**111.00±14.40**65.93±1.93LPS(30μg·mL-1)+ENR(80μg·mL-1)109.70±4.79**126.60±1039**52.68±2.31LPS(30μg·mL-1)+ENR(100μg·mL-1)113.30±14.70**127.20±8.43**25.80±1.52LPS(30μg·mL-1)+FFC(20μg·mL-1)65.07±3.39**98.20±7.96**69.24±4.32LPS(30μg·mL-1)+FFC(40μg·mL-1)76.11±3.97**107.60±12.25**53.18±2.34LPS(30μg·mL-1)+FFC(60μg·mL-1)95.80±7.18**117.62±4.86**42.59±4.01LPS(30μg·mL-1)+FFC(80μg·mL-1)109.70±7.04**130.00±5.41**32.68±3.21LPS(30μg·mL-1)+FFC(100μg·mL-1)114.60±17.17**130.54±9.16**19.13±2.07LPS(30μg·mL-1)+AML(20μg·mL-1)66.41±3.48**78.20±10.45*72.18±1.60LPS(30μg·mL-1)+AML(40μg·mL-1)75.78±2.89**97.59±5.11**60.93±4.77LPS(30μg·mL-1)+AML(60μg·mL-1)97.14±7.15**104.30±10.94**49.34±3.29LPS(30μg·mL-1)+AML(80μg·mL-1)113.54±6.06**123.30±6.53**22.47±2.63LPS(30μg·mL-1)+AML(100μg·mL-1)111.63±15.58**133.90±3.42**20.11±1.45
2.3 CAG对肝细胞培养上清液中ALT、AST活性及存活率影响
由表3所示,与对照组比较,模型组细胞培养上清液中ALT、AST活性极显着上升(P<0.01),显示肝细胞受损明显;与模型组相比,CAG各质量浓度处理均对肝细胞有保护作用,其中100、200、400 μg·mL-1CAG处理组极显着抑制2种酶的溢出量(P<0.01)。细胞存活率测定结果表明,与对照组比较,模型组细胞存活率极显着下降(P<0.01),为49.33%±3.09%;与模型组相比,CAG组细胞存活率均极显着升高(P<0.01),其中200、400 μg·mL-1CAG处理组细胞存活率较高,分别为87.68%±2.85%、90.45%±2.51%。
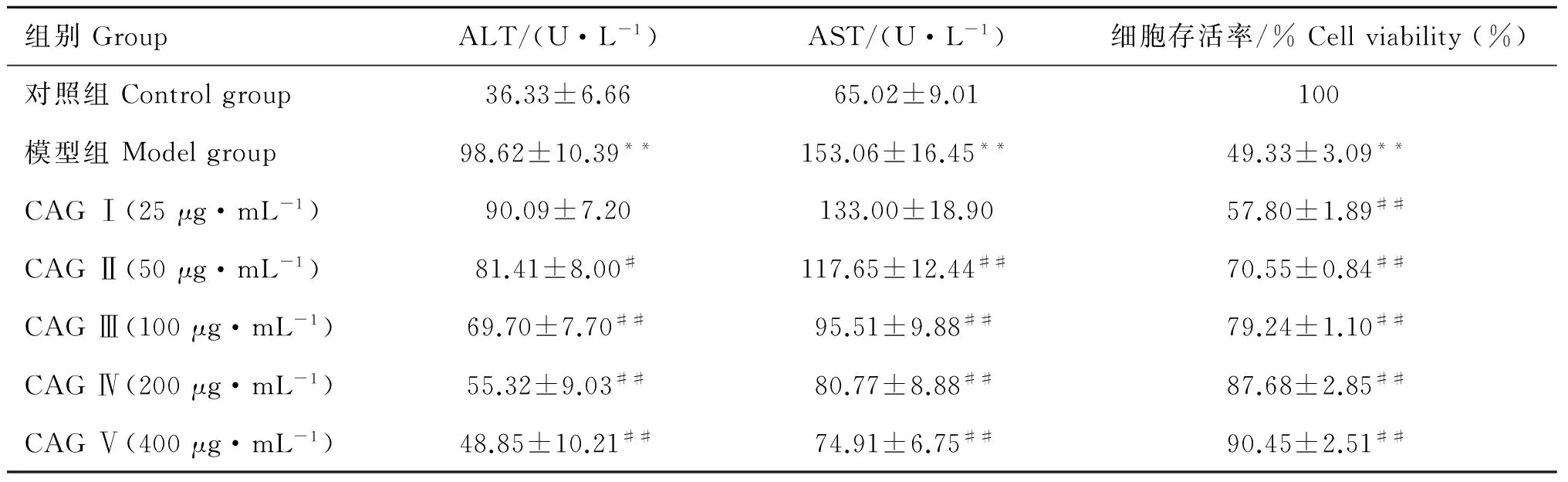
组别GroupALT/(U·L-1)AST/(U·L-1)细胞存活率/%Cellviability(%)对照组Controlgroup36.33±6.6665.02±9.01100模型组Modelgroup98.62±10.39**153.06±16.45**49.33±3.09**CAGⅠ(25μg·mL-1)90.09±7.20133.00±18.9057.80±1.89##CAGⅡ(50μg·mL-1)81.41±8.00#117.65±12.44##70.55±0.84##CAGⅢ(100μg·mL-1)69.70±7.70##95.51±9.88##79.24±1.10##CAGⅣ(200μg·mL-1)55.32±9.03##80.77±8.88##87.68±2.85##CAGⅤ(400μg·mL-1)48.85±10.21##74.91±6.75##90.45±2.51##
2.4 CAG对肝细胞中SOD、GSH、MDA活性或含量影响
表4结果显示,与对照组比较,模型组SOD、GSH、MDA活性下降极显着(P<0.01);与模型组相比,CAG组各个剂量均能提高SOD、GSH、MDA活性,其中200、400 μg·mL-1CAG处理组极显着升高SOD活性(P<0.01);100 μg·mL-1CAG处理组可极显着升高GSH含量(P<0.01);100、200、400 μg·mL-1CAG处理组可有效抑制肝细胞MDA生成(P<0.01)。
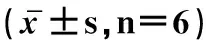
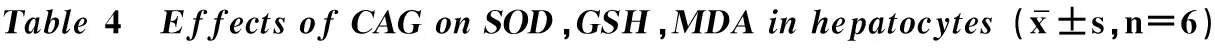
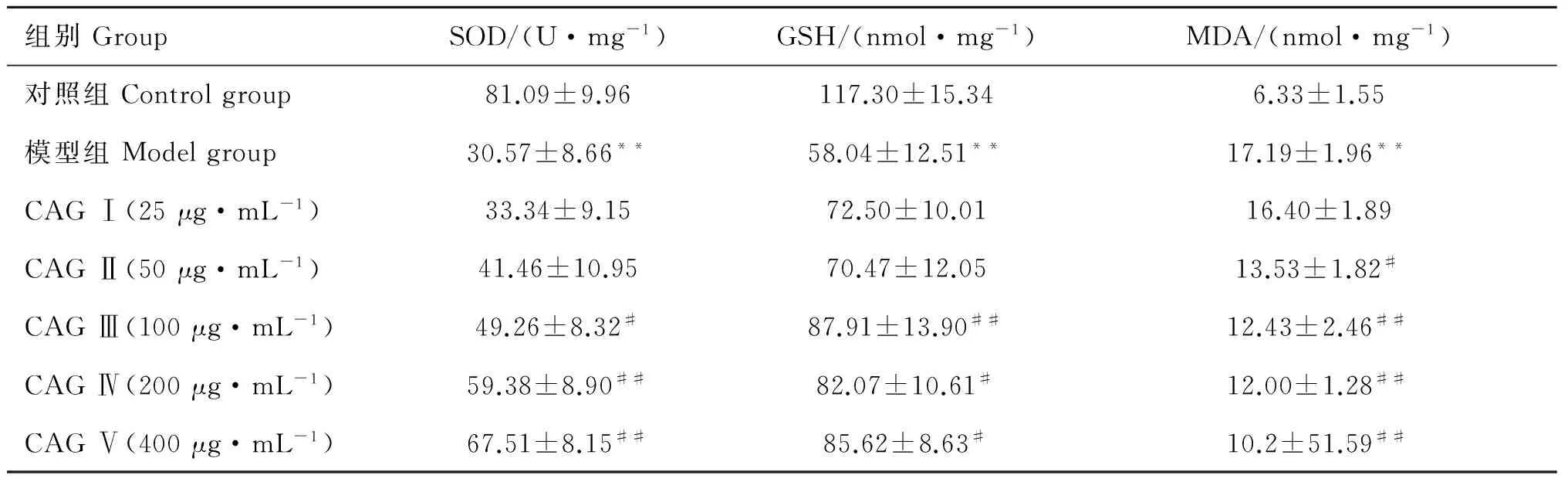
组别GroupSOD/(U·mg-1)GSH/(nmol·mg-1)MDA/(nmol·mg-1)对照组Controlgroup81.09±9.96117.30±15.346.33±1.55模型组Modelgroup30.57±8.66**58.04±12.51**17.19±1.96**CAGⅠ(25μg·mL-1)33.34±9.1572.50±10.0116.40±1.89CAGⅡ(50μg·mL-1)41.46±10.9570.47±12.0513.53±1.82#CAGⅢ(100μg·mL-1)49.26±8.32#87.91±13.90##12.43±2.46##CAGⅣ(200μg·mL-1)59.38±8.90##82.07±10.61#12.00±1.28##CAGⅤ(400μg·mL-1)67.51±8.15##85.62±8.63#10.2±51.59##
2.5 CAG对肝细胞凋亡率影响
Annexin V-FITC/PI双染法检测细胞凋亡率结果表明,模型组早期凋亡细胞比例为71.32%±7.59%,与对照组3.57%±1.23%相比极显着增加(P<0.01);CAG 50,100,200,400 μg·mL-1处理后,早期凋亡比例分别降至41.43%±2.98%,29.38%±5.24%,13.97%±2.33%和12.35%±1.98%,与模型组相比有极显着差异(P<0.01)。具体数值见图1与表5。
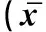
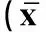
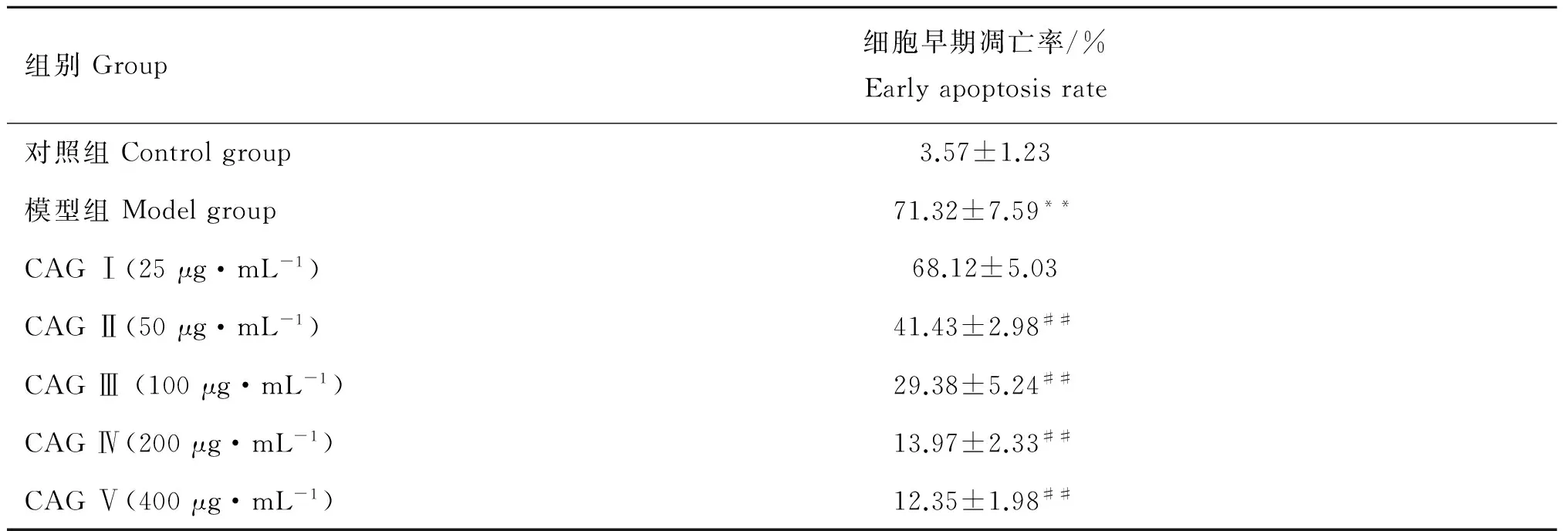
组别Group细胞早期凋亡率/%Earlyapoptosisrate对照组Controlgroup3.57±1.23模型组Modelgroup71.32±7.59**CAGⅠ(25μg·mL-1)68.12±5.03CAGⅡ(50μg·mL-1)41.43±2.98##CAGⅢ(100μg·mL-1)29.38±5.24##CAGⅣ(200μg·mL-1)13.97±2.33##CAGⅤ(400μg·mL-1)12.35±1.98##
3 讨 论
3.1 鸡肝细胞分离及LPS诱发肝细胞损伤
肝细胞分离与原代培养是研究肝细胞功能的有效方法。本试验在P.O.Seglen[4]两步法的基础上改进,即在体内进行第一步灌流,保留门静脉完整分离肝后,在体外完成胶原酶循环灌流。本法节约了胶原酶使用量,细胞分离彻底且损伤较小,且不需要特殊设备,既能满足试验要求,又经济简便,适合普通实验室使用。
在鸡原代肝细胞培养中,随加入LPS质量浓度增大,发现ALT、AST的释放度与肝细胞死亡率不断增加。ALT主要存在肝细胞质内,AST主要存在肝细胞的线粒体内,肝细胞受损时,二者释放增加,故检测细胞培养上清液中其活性升高[5]。结果证实不同剂量的LPS均可不同程度的诱发肝细胞损伤,当用60 μg·mL-1LPS处理时,细胞存活率下降50%左右,ALT、AST的释放度极显着升高,故将此质量浓度作为LPS诱导肝细胞损伤的最佳剂量。
3.2 LPS致鸡肝细胞损伤中恩诺沙星、氟苯尼考、阿莫西林的协同效应
选用LPS最佳致肝细胞损伤半量(30 μg·mL-1),分别添加恩诺沙星、氟苯尼考、阿莫西林,发现不同剂量的恩诺沙星、氟苯尼考、阿莫西林均可使LPS在该剂量下的致肝细胞损伤程度加重,以LPS(30 μg·mL-1)联合恩诺沙星(80 μg·mL-1)、氟苯尼考(40 μg·mL-1)、阿莫西林(60 μg·mL-1)处理肝细胞,细胞存活率下降达50%左右,ALT、AST释放极显着增加。提示添加杀菌性抗菌药物,促使LPS致肝细胞损伤剂量下降,杀菌性抗菌药物使LPS更易诱发肝损伤。在本研究已证实,阿莫西林、氟苯尼考、氟喹诺酮类药物在杀菌的同时可促进大肠杆菌LPS的释放[6-8]。杀菌性药物在促进LPS释放同时又能协同LPS致肝损伤,可能进一步增加了家禽肝炎症状的发生率及危害程度。医学临床也已报道,杀菌性药物(如阿莫西林、头孢类、氟喹诺酮类、酰胺醇类药物)也可诱发药物性肝损伤[9-11]。LPS与抗菌药物致肝损伤间相互影响与作用值得进一步探究。
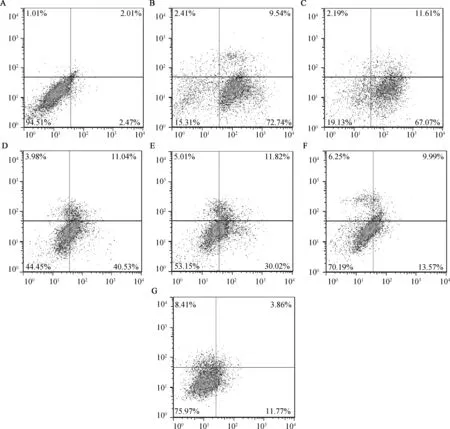
A. 对照组;B. 模型组; C. CAG(25 μg·mL-1); D. CAG(50 μg·mL-1);E. CAG(100 μg·mL-1); F. CAG(200 μg·mL-1);G. CAG(400 μg·mL-1)A. Control group; B. Model group; C. CAG (25 μg·mL-1); D. CAG (50 μg·mL-1); E. CAG (100 μg·mL-1); F. CAG (200 μg·mL-1); G. CAG (400 μg·mL-1)图1 CAG对肝细胞凋亡率影响 Fig.1 Effects of CAG on apoptosis rate of hepatocytes
已报道,添加卡介苗或与D-半乳糖胺可致LPS致肝损伤的剂量降低[12-14],也即“复合式肝细胞损伤模型”。本文结果显示,不同剂量的抗菌药物,同样使LPS致肝细胞损伤剂量降低。该新型复合式肝细胞损伤模型,为进一步研究家禽肝损伤病理机制及兽医临床护肝药物的研发奠定基础。
3.3 CAG对LPS联合恩诺沙星诱发肝细胞损伤的修复作用
在LPS联合恩诺沙星致肝细胞损伤中,添加不同质量浓度的CAG,可显着抑制细胞死亡率与细胞培养上清液ALT、AST活性上升,表明CAG对肝细胞有一定的保护作用,其作用强度与用量有关。
CAG主要由甘草酸单胺、甘氨酸和蛋氨酸组成[15],为医学临床应用广泛的护肝药物。N.P.Visavadiya 等[16]证实CAG通过抑制脂质过氧化反应,增强机体自由基清除能力,对抗自由基对肝的损伤。本试验中,模型组肝细胞中MDA含量显着增加,SOD活性和GSH含量显着下降,表明LPS联合恩诺沙星可促使肝细胞的脂质过氧化反应,损害机体氧化自由基清除系统,加重肝细胞损伤;CAG可不同程度抑制MDA的生成,提高SOD活性和GSH含量,显示CAG可抑制肝细胞脂质过氧化反应,保持SOD活性,抑制GSH的耗竭,增强机体的抗氧化能力。
肝细胞凋亡是肝细胞损伤机制的一个重要方面。动物试验研究表明,LPS致肝损伤过程中可导致肝细胞凋亡显着增加[17],CAG可抑制CCl4引起的大鼠肝细胞凋亡的增加[18]。本试验中,模型组肝细胞中早期凋亡率极显着升高,表明LPS联合恩诺沙星可通过增加细胞早期凋亡率加重肝细胞损伤;CAG可剂量依赖性抑制LPS联合恩诺沙星引起的早期凋亡率增加,由此可知CAG对鸡肝细胞保护作用与其抗凋亡能力相关。
4 结 论
LPS可致肝细胞损伤,恩诺沙星、氟苯尼考及阿莫西林等抗菌药物的存在,均使LPS致肝细胞损伤剂量下降,显示药物与LPS间致肝损伤有协同效应。CAG具有提高细胞存活率,影响细胞SOD、GSH、MDA活性或含量,抑制凋亡等修复效应。本研究结果启示,家禽养殖实践中,应合理使用杀菌性药物,规范其使用方案,以免其和内毒素相互协同诱发和加重肝损伤,影响疾病愈合及家禽生长。
[1] 徐能武,袁建成,肖光夏,等.抗生素诱导革兰阴性杆菌释放内毒素的实验研究(一) [J].中华烧伤杂志,2001,17(2):75-79. XU N W,YUAN J C,XIAO G X,et al.An experimental study on the release of endotoxin from gram negative bacteria induced by antibiotics [J].ChineseJournalofBurns,2001,17(2):75-79.(in Chinese)
[2] 高亚乾.不同类型抗菌药物在革兰氏阴性菌感染中诱导内毒素释放的实验性研究 [D].石家庄:河北医科大学,2011. GAO Y Q.An experimental study on the release of endotoxin from gram negative bacteria induced by different antibiotics [D].Shijiazhuang:Hebei Medical University,2011.(in Chinese)
[3] OU T T,KUO C Y,CHYAU C C,et al.Improvement of lipopolysaccharide-induced hepatic injuries and inflammation with mulberry extracts [J].JSciFoodAgric,2013,93(8):1880-1886.
[4] SEGLEN P O.Preparation of isolated rat liver cells [J].MethodsCellBiol,1976,13:29-83.
[5] 王庸晋.现代临床与检验学 [M].北京,人民军医出版社,2002. WANG Y J.The modern clinical laboratory [M].Beijing:People′s Military Medical Press,2002.(in Chinese)
[6] ROTIMI V O,VERGHESE T L,AL-SWEIH N,et al.Influence of five antianaerobic antibiotics on endotoxin liberation by gram-negative anaerobes [J].JChemother,2000,12(1):40-47.
[7] MORITA H,HASUNUMA R,KAWAGUCHI K,et al.Limitation of polymyxin B on suppression of endotoxin shock induced bySalmonellainfection in mice [J].BiolPharmBull,2004,27(11):1840-1843.
[8] 张 强,吴硕东,金俊哲.抗生素诱导内毒素释放意义的实验性研究 [J].辽宁医学杂志,2004,18(2):68-70. ZHANG Q,WU S D,JIN J Z.The experimental study of releasing significance on antibiotic inducing endotoxin [J].MedicalJournalofLiaoning,2004,18(2):68-70.(in Chinese)
[9] GHABRIL M,CHALASANI N,BJÖRNSSON E.Drug-induced liver injury:a clinical update [J].CurrOpinGastroenterol,2010,26(3):222-226.
[10] YILMAZ B,EKIZ F,COBAN S,et al.Cefixime-induced hepatotoxicity [J].TurkJGastroenterol,2011,22(4):445.
[11] LEITNER J M,GRANINGER W,THALHAMMER F.Hepatotoxicity of antibacterials:pathomechanisms and clinical data[J].Infection,2010,38(1):3-11.
[12] 刘亮明,邓 欢,张吉翔,等.内毒素性急性肝损伤实验动物模型的建立 [J].世界华人消化杂志,2006,14(1):12-18. LIU L M,DENG H,ZHANG J X,et al.Establishment of lipopolysaccharide-induced acute liver injury in rats [J].WorldChineseJournalofDigestology,2006,14(1):12-18.(in Chinese)
[13] 杨舒淳,杨昌华,马小凡,等.小鼠腹腔注射卡介苗加脂多糖建立急性免疫性肝损伤的实验研究 [J].实验动物科学,2008,25(4):1-4. YANG S C,YANG C H,MA X F,et al.An experimental study of acute immune liver injury model established by intraperitoneal injection of BCG and LPS on mouse [J].LaboratoryAnimalScience,2008,25(4):1-4.(in Chinese)
[14] LIU D,LI C,CHEN Y,et al.Nuclear import of proinflammatory transcription factors is required for massive liver apoptosis induced by bacterial lipopolysaccharide [J].JBiolChem,2004,279(46):48434-48442.
[15] ASL M N,HOSSEINZADEH H.Review of pharmacological effects ofGlycyrrhizasp.and its bioactive compounds [J].PhytotherRes,2008,22(6):709-724.
[16] VISAVADIYA N P,NARASIMHACHARYA A V.Hypocholesterolaemic and antioxidant effects ofGlycyrrhizaglabra(Linn) in rats [J].MolNutrFoodRes,2006,50(11):1080-1086.
[17] LIU L M,ZHANG J X,LUO J,et al.A role of cell apoptosis in lipopolysaccharide(LPS)-induced nonlethal liver injury in D-galactosamine(D-GalN)-sensitized rats [J].DigDisSci,2008,53(5):1316-1324.
[18] GUO X L,LIANG B,WANG X W,et al.Glycyrrhizic acid attenuates CCl4-induced hepatocyte apoptosis in ratsviaa p53-mediated pathway [J].WorldJGastroenterol,2013,19(24):3781-3791.
(编辑 白永平)
Effects of Antibiotics on LPS Induced Liver Cell Injury and Hepatoprotective Activity of Compound Ammonium Glycyrrhizin
LIU Teng-fei,TIAN Jing,GENG Zhi-xia,LI Hui-min,YU Zu-gong*
(CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
The present study was aimed at the effects of antibiotics on LPS induced liver cell injury and hepatoprotective activity of compound ammonium glycyrrhizin (CAG).Chicken hepatocytes were isolated by semi-situperfusion method.After the cells were cultured for 48 h,LPS was added with different concentrations to screen the optimal dose of liver cell injury.At the half of the optimal dose of LPS,enrofloxacin,florfenicol and amoxicillin were added with different concentration to detect the indexes of liver cell injury.Hepatocytes were treated with different concentrations of CAG for 24 h after the addition of LPS (30 μg·mL-1) + enrofloxacin (80 μg·mL-1).Cell viability and activities of ALT,AST,SOD,GSH,MDA were measured,flow cytometric analysis was conducted to detect the early apoptosis ratio of hepatocytes.The result showed that when LPS less than 50 μg·mL-1,the liver injury was not obvious.While LPS at more than 60 μg·mL-1,the cell viability were significantly lower and the activities of ALT,AST in the culture media were significantly higher than those of controls(P<0.01).LPS (30 μg·mL-1) combined with enrofloxacin (80 μg·mL-1),florfenicol (40 μg·mL-1),amoxicillin (60 μg·mL-1) could induce liver cell injury significantly.CAG (25,50,100,200,400 μg·mL-1) could markedly reduce the numbers of early apoptotic cells,inhibit the elevation of ALT,AST,MDA,and significantly increase the reduced level of SOD,GSH and cell viability.These results indicated that LPS could induce liver cell injury.Antibiotics might contribute to the liver cell injury induced by LPS.CAG counteracts liver cell injury at various levels by preventing apoptosis and oxidative stress damage.
LPS;enrofloxacin;florfenicol;amoxicillin;complex chicken liver cells injury;compound ammonium glycyrrhizin
10.11843/j.issn.0366-6964.2015.02.019
2014-08-27
刘腾飞(1988-),男,河南博爱人,硕士,主要从事新兽药研发工作,E-mail:2011107030@njau.edu.cn
*通信作者:余祖功,E-mail:yuzugong@njau.edu.cn
S859.7
A
0366-6964(2015)02-0309-08



