王 超,史西保,王 丽,陈 静,司朝朝,王爱萍,邓瑞广,张改平1,,3*
(1.西北农林科技大学动物医学院,杨凌 712100;2.河南省农业科学院 农业部动物免疫学重点实验室,河南省动物免疫学重点实验室,郑州 450002;3.河南农业大学牧医工程学院,郑州 450002;4.河南师范大学生命科学学院,新乡453007;5.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;6.郑州大学生物工程系,郑州 450000)
猪繁殖与呼吸综合征病毒非结构蛋白1α(nsp1α)的N端锌指结构是其抑制NLRP3炎症小体活性所必需
王 超1,2,5,史西保2,4,王 丽2,陈 静2,司朝朝2,王爱萍6,邓瑞广2,张改平1,2,3*
(1.西北农林科技大学动物医学院,杨凌 712100;2.河南省农业科学院 农业部动物免疫学重点实验室,河南省动物免疫学重点实验室,郑州 450002;3.河南农业大学牧医工程学院,郑州 450002;4.河南师范大学生命科学学院,新乡453007;5.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;6.郑州大学生物工程系,郑州 450000)
猪繁殖与呼吸综合征(PRRS)是严重危害养猪业的病毒性传染病之一,其致病原猪繁殖与呼吸综合征病毒(PRRSV)抑制宿主的天然免疫和特异性免疫反应,引起机体免疫抑制,造成持续性感染,从而给该病的防控带来困难。NLRP3炎症小体作为先天性免疫的重要组分在机体抗病毒中发挥重要作用。前期研究发现PRRSV能够激活NLRP3炎症小体,但PRRSV是否存在拮抗NLRP3炎症小体的组分还未见报道。本研究首先在缺失内源性炎症小体的HEK293T细胞中,共转染NLRP3、ASC、procaspase-1和pro-IL-1β四个真核表达质粒,建立NLRP3炎症小体的体外研究模型。然后,在该炎症小体模型细胞和猪肺泡巨噬细胞中,转染PRRSV nsp1α的真核表达质粒,结果表明nsp1α能够明显拮抗炎症小体的活化,而进一步的突变试验表明缺失N端锌指(ZF)结构或者突变ZF结构的nsp1α均不能抑制NLRP3炎症小体活化。本研究不仅首次发现了拮抗NLRP3炎症小体活化的PRRSV蛋白——nsp1α,而且发现nsp1α 的N端锌指结构是其抑制NLRP3炎症小体活性所必需。本研究进一步发现了PRRSV拮抗天然免疫的新机制,并为PRRSV的防控提供了潜在的分子靶点和理论指导。
猪繁殖与呼吸综合征病毒;nsp1α;ZF结构域;NLRP3炎症小体;IL-1β
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)为有嚢膜的单股正链RNA病毒,与马动脉炎病毒(equine arteritis virus,EAV)、小鼠乳酸脱氢酶病毒(lactate dehydrogenase-elevating virus,LDV)和猴出血热病毒(simian hemorrhagic fever virus,SHFV)同属尼多病毒目动脉炎病毒科[1]。1991年欧洲首先分离到PRRSV,随后美国、加拿大及中国等国家和地区也相继分离到该病毒,PRRSV抑制宿主的天然免疫和特异性免疫反应,引起机体免疫抑制,从而给控制该病带来了困难,给全世界的养猪业造成严重的经济损失[2]。
越来越多的研究表明NLRP3炎症小体作为先天性免疫的重要组分在机体免疫反应和疾病发生过程中具有重要作用。NLRP3炎症小体是最近研究较广泛的炎症小体,是由支架蛋白NLRP3、接头蛋白ASC和效应分子procaspase-1相互结合而形成,主要介导procaspase-1的活化和促炎性细胞因子IL-1β和IL-18的分泌。在巨噬细胞和树突状细胞中,由NLRP3炎症小体介导的IL-1β的表达和分泌至少需要两个信号刺激,一是如内毒素(LPS)等病原相关分子模式被细胞模式识别受体识别,从而使机体上调表达IL-1β的前体mRNA,另一信号是如ATP和Nigericin等引起NLRP3招募和激活促炎症蛋白酶Caspase-1,活化的Caspase-1切割IL-1β和IL-18前体,产生成熟的IL-1β和IL-18[3-4]。
前期报道流感病毒(influenza A virus,IAV)、腺病毒(adenovirus)、仙台病毒(Sendai virus,Sev)以及PRRSV等都可以激活NLRP3炎症小体[5-8],而IAV的缺陷小鼠试验表明,NLRP3、ASC和Caspase-1缺陷的小鼠在IAV感染中其呼吸道炎症明显削弱且死亡率显着提高[5,7,9-10],提示NLRP3炎症小体可能在抗病毒感染中起重要作用,而相应的,病毒也表达抑制NLRP3炎症小体的组分从而拮抗NLRP3先天性免疫[11-12],因此筛选抑制NLRP3炎症小体的病毒组分将会为进一步的抗病毒治疗提供潜在分子靶点和理论基础。因此,作者拟以PRRSV为研究对象,筛选可能抑制NLRP3炎症小体活化的病毒组分,为进一步探讨NLRP3炎症小体在PRRSV免疫学中的作用打下基础。
1 材料与方法
1.1 细胞、毒株和菌株
PRRSV美洲型经典毒株BJ-4株(GenBank:AF331831)由中国农业大学杨汉春教授惠赠,本实验室保存;MARC-145细胞和HEK293T细胞由本实验室保存;E.coliDH5α感受态细胞购自TaKaRa公司。
1.2 主要试剂
DMEM、PRMI-1640细胞培养基和胎牛血清(FBS)购自Gibco公司;限制性核酸内切酶、T4 DNA连接酶、ExTaqDNA聚合酶、LATaqDNA聚合酶和反转录试剂盒均购自TaKaRa公司;TRIzol试剂购自Life Technologies公司;DNA回收试剂盒以及质粒抽提和纯化试剂盒购自AxyGen公司;转染试剂Lipofectamine 2000 购自Invitrogen公司;LPS(O55:B5)购自Sigma公司;Nigericin购自InvivoGen公司;猪IL-1β ELISA检测试剂盒购自R&D Systems公司。
1.3 质粒
pcDNA3.1-FLAG、pcDNA3.1-FLAG-nsp1α及其突变体pcDNA3.1-FLAG-nsp1α DZF、pcDNA3.1-FLAG-nsp1α ZF、pcDNA3.1-FLAG-nsp1α C8A、pcDNA3.1-FLAG-nsp1α C10A、pcDNA3.1-FLAG-nsp1α C25A和pcDNA3.1-FLAG-nsp1α C28A均由本实验室前期构建[13]。用LPS刺激PAMs,提取细胞总RNA,反转录获得cDNA,分别用NLRP3、ASC、procaspase-1和pro-IL-1β的特异性引物进行PCR,并将PCR产物克隆到真核表达载体pcDNA3.1-FLAG中,得到pcDNA3.1-FLAG-NLRP3、pcDNA3.1-FLAG-ASC、pcDNA3.1-FLAG-procaspase-1和pcDNA3.1-FLAG-pro-IL-1β。并由生工生物工程公司测序确证。PCR引物如下(表1)。
表 1 构建重组质粒所使用的引物及其序列
Table 1 Primers used in plasmid construction

引物Primers引物序列(5′⁃3′)SequencesNLRP3ForGATATCCATGAGCATGGCAAGCGTCCGCTNLRP3RevCTCGAGCTACTGGGAAGGCTCAAAGACAATprocaspase⁃1ForGGTACCCATGGCCGATAAGGTGCTGAAGGAprocaspase⁃1RevCTCGAGTTAATGTCCTGGGAAGAGATAApro⁃IL⁃1βForAAGCTTCATGGCCATAGTACCTGAACCCGCpro⁃IL⁃1βRevCTCGAGTTAGGGAGAGAGGACTTCCATGGTASCForAAGCTTCATGGGGTGCACGCGTGACGCCATASCRevCTCGAGTCAGCTCTGCTCCAGGTCGGCCACpro⁃IL⁃1βRTForCTTGAAGAGAGAAGTGGTGTTCTGpro⁃IL⁃1βRTRevATCACACAAGACAGGTACAGATTCT
1.4 猪肺泡巨噬细胞(PAMs)的制备
挑选6周龄左右,健康且PRRSV抗原抗体双阴性猪。臂动脉丛放血致死,剖开胸腔,将气管上下两端结扎后,取出肺,用无菌PBS充分漂洗肺表面,然后,沿气管内壁注入约100 mL含双抗的无菌PBS缓冲液,轻轻拍打肺表面1~2 min,回收灌洗液,重复该步骤2~3次,直至灌洗液变清亮为止;将灌洗液用移液管轻轻吹打并用单层无菌滤网过滤,将收集到的灌洗液按照1 000 r·min-1离心8 min,用20 mL PBS重悬沉淀,重复2次,弃上清;用含双抗的10%胎牛血清的RPMI-1640培养基重悬细胞,调节细胞浓度至1×106·mL-1,接种到24孔培养板中,37 ℃,5% CO2培养箱中培养6 h后,弃上清,更换培养基继续培养。
1.5 炎症小体模型重构
将HEK293T细胞用含10% FBS的DMEM培养基调至细胞浓度3.5×105·mL-1,按每孔500 μL铺于24孔板中,待细胞密度达80%~90%时,用Lipofectamine 2000转染pcDNA3.1-FLAG-NLRP3(150 ng)、pcDNA3.1-FLAG-ASC(50 ng)、pcDNA3.1-FLAG-procaspase-1(50 ng)、pcDNA3.1-FLAG-pro-IL-1β(300 ng)和对照质粒pcDNA3.1-FLAG(600 ng)或pcDNA3.1-FLAG-nsp1α(600 ng)及其突变体至HEK293T细胞,具体操作严格按Lipofectamine 2000说明书进行。24 h后收集细胞上清液并用ELISA试剂盒检测IL-1β的表达量。
1.6 PAMs的质粒转染
参照Lipofectamine 2000说明书,将pcDNA3.1-FLAG和pcDNA3.1-FLAG-nsp1α按照800 ng·孔-1,每组三个重复,对24孔板中新鲜制备的PAMs进行瞬时转染,6 h后换液并用LPS(1 μg·mL-1)进行刺激,48 h后TRIzol裂解细胞,并用qRT-PCR检测细胞中IL-1β mRNA的转录水平。
参照Lipofectamine 2000说明书,将pcDNA3.1-FLAG和pcDNA3.1-FLAG-nsp1α按照800 ng·孔-1,每组三个重复,对24孔板中新鲜制备的PAMs进行瞬时转染,6 h后换液并用LPS(1 μg·mL-1)进行刺激,24 h后再加入Nigericin(10 μmol·L-1)共同刺激,48 h后收集细胞上清液并用ELISA试剂盒检测IL-1β蛋白的表达水平。
1.7 RNA提取及Real-Time PCR
TRIzol试剂裂解PAMs,根据说明书提取总RNA,取1 μg RNA,按照PrimeScriptTMRT regent Kit with gDNA Eraser反转录试剂盒说明书进行反转录;然后以此cDNA为模板根据SYBR Green real-time PCR Master Mix说明书进行Real-Time PCR反应检测IL-1β mRNA的转录水平。采用2-ΔΔCT方法进行基因相对表达分析,GAPDH为内参。所用跨内含子引物见表1。
1.8 IL-1β蛋白水平检测
细胞上清液中IL-1β分泌水平的检测采用商业化的猪IL-1β ELISA检测试剂盒,严格按照说明书进行操作。
1.9 数据处理及分析
数据统计分析采用T检验法或单因素方差分析,当P<0.05时,数据之间具有显着性差异,用“*”表示。本文所有图表均使用GraphPad Prism 6.0软件完成。
2 结 果
2.1 真核表达质粒构建
通过RT-PCR的方法从LPS刺激过的PAMs中克隆出NLRP3、ASC、procaspase-1和pro-IL-1β基因的编码区序列,酶切后将其连接至pcDNA3.1-FLAG载体中,测序确证得到NLRP3、ASC、procaspase-1和pro-IL-1β基因的真核表达质粒pcDNA3.1-FLAG-NLRP3、pcDNA3.1-FLAG-ASC、pcDNA3.1-FLAG-procaspase-1和pcDNA3.1-FLAG-pro-IL-1β。
2.2 NLRP3炎症小体模型重构
将pcDNA3.1-FLAG-NLRP3(150 ng)、pcDNA3.1-FLAG-ASC(50 ng)、pcDNA3.1-FLAG-procaspase-1(50 ng)、pcDNA3.1-FLAG-pro-IL-1β(300 ng)和对照质粒pcDNA3.1-FLAG(600 ng)共转染HEK293T细胞,24 h后收集细胞上清液,用ELISA试剂盒检测IL-1β的表达量。结果显示(图1),在共转染这四个炎症小体相关质粒时,可以引起IL-1β的表达且表达量最高,而阴性对照组(只转染对照质粒和只转染pcDNA3.1-FLAG-pro-IL-1β)的IL-1β的表达量则较低。结果表明在HEK293T细胞上成功重构了NLRP3炎症小体模型。
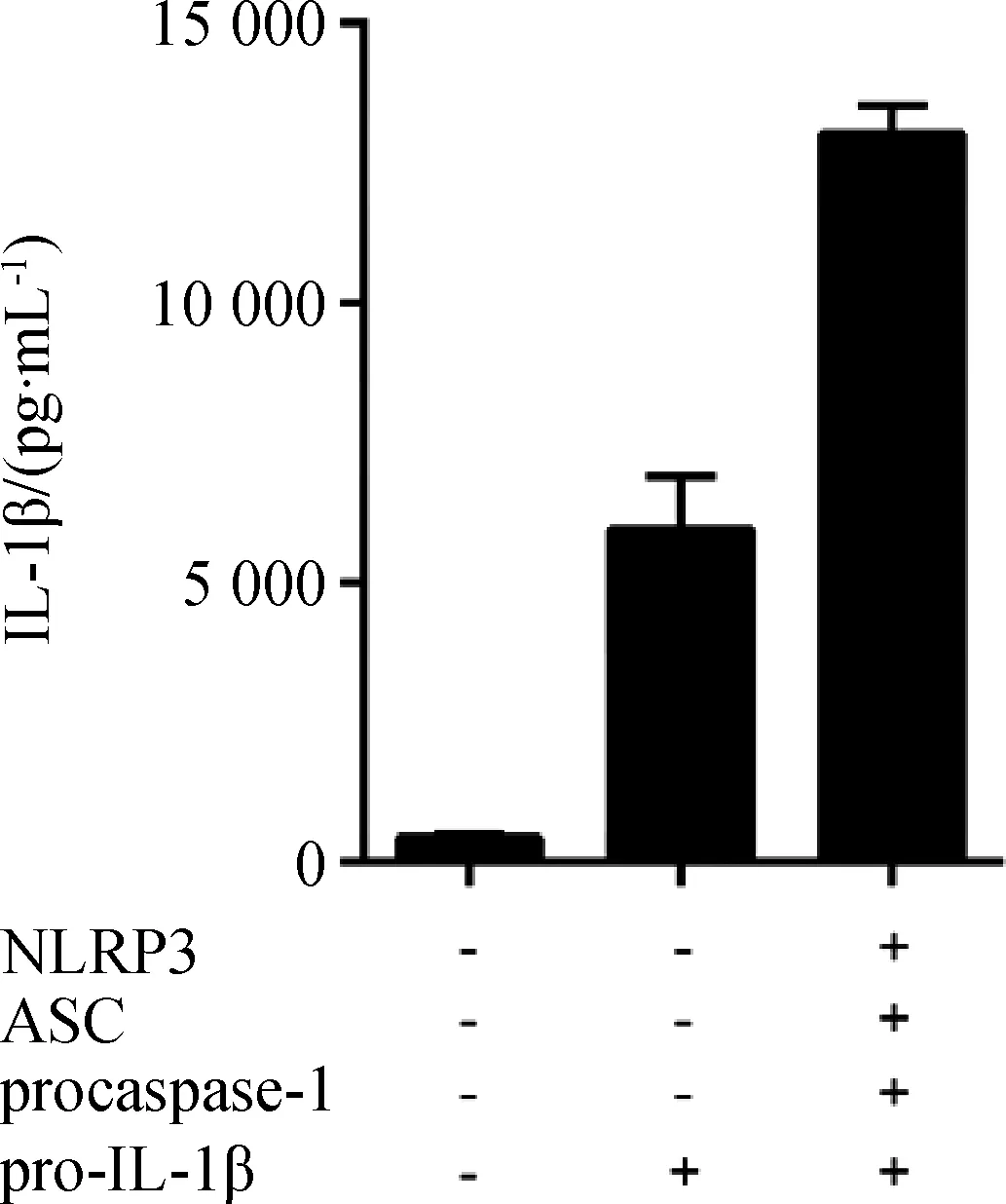
HEK293T细胞转染NLRP3、ASC、procaspase-1和pro-IL-1β表达质粒或对照质粒pcDNA3.1-FLAG(-),ELISA检测IL-1β蛋白表达HEK293T cells were transfected with expression plasmids encoding NLRP3,ASC,procaspase-1,and pro-IL-1β or control plasmid pcDNA3.1-FLAG(-),IL-1β expression was analysed by ELISA图1 HEK293T细胞上重构NLRP3炎症小体Fig.1 Reconstruct NLRP3 inflammasome in HEK293T cells
2.3 PRRSV nsp1α抑制由NLRP3介导的炎症小体活化
PRRSV至少编码16个非结构蛋白(nonstructural proteins,nsps),这些nsps主要参与病毒基因组的复制和转录[14]。而研究表明PRRSV nsp1α是PRRSV的重要免疫抑制蛋白,具有抑制IFN-β转录和TNF-α的产生等作用[13,15-16]。因此,本试验将探究nsp1α是否抑制NLRP3炎症小体活化。将NLRP3、ASC、procaspase-1和pro-IL-1β四个炎症小体相关质粒和pcDNA3.1-FLAG-nsp1α(600 ng)或者对照质粒pcDNA3.1-FLAG(600 ng)共转染HEK293T细胞,24 h后收集细胞上清液,用ELISA试剂盒检测IL-1β的表达量。结果显示(图2A),共转染nsp1α后,IL-1β的表达与共转染对照质粒组相比,下降约50%,具有显着性差异(P<0.05)。
另外,将nsp1α或对照质粒转染PAMs并用LPS或LPS和Nigericin刺激后,qRT-PCR结果显示(图2B),IL-1β的mRNA水平与对照质粒组相比,下降约60%,具有显着性差异(P<0.05);ELISA结果显示(图2C),IL-1β蛋白水平的表达与对照质粒组相比,下降约24%,具有显着性差异(P<0.05)。以上结果表明,PRRSV nsp1α可以抑制由NLRP3炎症小体介导的IL-1β的表达。
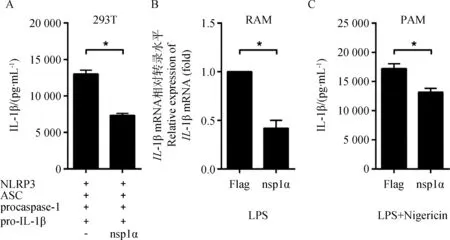
A.HEK293T细胞转染NLRP3炎症小体相关质粒和nsp1α或对照质粒pcDNA3.1-FLAG(-),ELISA检测IL-1β表达;B.PAMs转染nsp1α或对照质粒pcDNA3.1-FLAG,LPS刺激后,qRT-PCR 检测IL-1β mRNA表达;C.PAMs转染nsp1α或对照质粒pcDNA3.1-FLAG,LPS和Nigericin共同刺激后,ELISA检测IL-1β蛋白表达。*.P<0.05A.HEK293T cells were transfected with NLRP3 inflammasome and nsp1α or control plasmid pcDNA3.1-FLAG(-),IL-1β secretion was analyzed by ELISA;B.PAMs were transfected with nsp1α or control plasmid pcDNA3.1-FLAG(-) and then were stimulated with LPS,IL-1β mRNA was quantified by qRT-PCR;C.PAMs were transfected with nsp1α or control plasmid pcDNA3.1-FLAG(-) and then were stimulated with LPS plus Nigericin,IL-1β secretion was analyzed by ELISA.*.P<0.05图2 PRRSV nsp1α可以抑制NLRP3炎症小体活化介导的IL-1β产生Fig.2 PRRSV nsp1α can inhibit NLRP3 inflammasome-mediated IL-1β production
2.4 nsp1α的N端ZF结构是其抑制NLRP3炎症小体活化所必需的
nsp1α包含三个结构域:分别是N端的锌指结构功能域(zinc-finger domain,ZF,Met1-Glu65)、中间的木瓜蛋白酶样半胱氨酸蛋白酶区域(papain-like cysteine protease,PCPα,Pro66-Gln166)和C端的延长区域(C terminal extension,CTE,Arg167-Met180)[17]。为研究nsp1α的ZF结构域是否在nsp1α抑制IL-1β的表达中发挥重要作用,将缺失ZF结构域的突变体pcDNA3.1-FLAG-nsp1α DZF或者只含有ZF结构域的突变体pcDNA3.1-FLAG-nsp1α ZF与炎症小体相关质粒共转染HEK293T细胞,24 h后收集细胞上清液,用ELISA试剂盒检测IL-1β的表达量。结果显示(图3A),转染缺失ZF结构域的突变体pcDNA3.1-FLAG-nsp1α DZF后,IL-1β的表达量与对照质粒组相比无显着性差异,表明缺失ZF结构域后nsp1α不能够抑制IL-1β的表达。另外,转染只含有ZF结构域的突变体pcDNA3.1-FLAG-nsp1α ZF后,IL-1β的表达量与对照质粒组相比无显着性差异。以上结果表明ZF结构域在nsp1α抑制IL-1β表达中起着不可或缺的作用。
在ZF结构域中,围绕着Zn离子周围与Zn离子结合的有四个半胱氨酸残基(Cys8、Cys10、Cys25和Cys28),而突变任何一个半胱氨酸残基都会破坏ZF结构[15]。因此,将这四个单氨基酸突变体nsp1α C8A、nsp1α C10A、 nsp1α C25A、nsp1α C28A分别与炎症小体相关质粒共转染HEK293T细胞,24 h后收集细胞上清液,用ELISA试剂盒检测IL-1β的表达量。结果显示(图3B),转染四个突变体后,IL-1β的表达与对照质粒组无显着性差异,表明突变任何一个半胱氨酸残基后,nsp1α都不能够抑制IL-1β的表达。
2.5 PRRSV nsp1α ZF结构域突变体转染PAMs
按照Lipofectamine 2000说明书,将pcDNA3.1-FLAG、pcDNA3.1-FLAG-nsp1α及其ZF结构域突变体转染PAMs,在LPS和Nigericin的共同刺激下,转染48 h后收集细胞上清液,ELISA试剂盒检测IL-1β的表达量。结果显示(图4),转染nsp1α后,IL-1β的表达与对照组相比,下降约30%,具有显着性差异(P<0.05),表明转染nsp1α能够抑制IL-1β的表达。而转染PRRSV nsp1α ZF结构域的突变体后,与对照组相比,IL-1β的表达并无显着性差异,均不能够抑制IL-1β的表达。上述结果表明,在PAMs上,PRRSV nsp1α可以抑制由LPS和Nigericin引起的IL-1β的表达,并且ZF结构域在nsp1α抑制IL-1β表达的过程中是必需的。
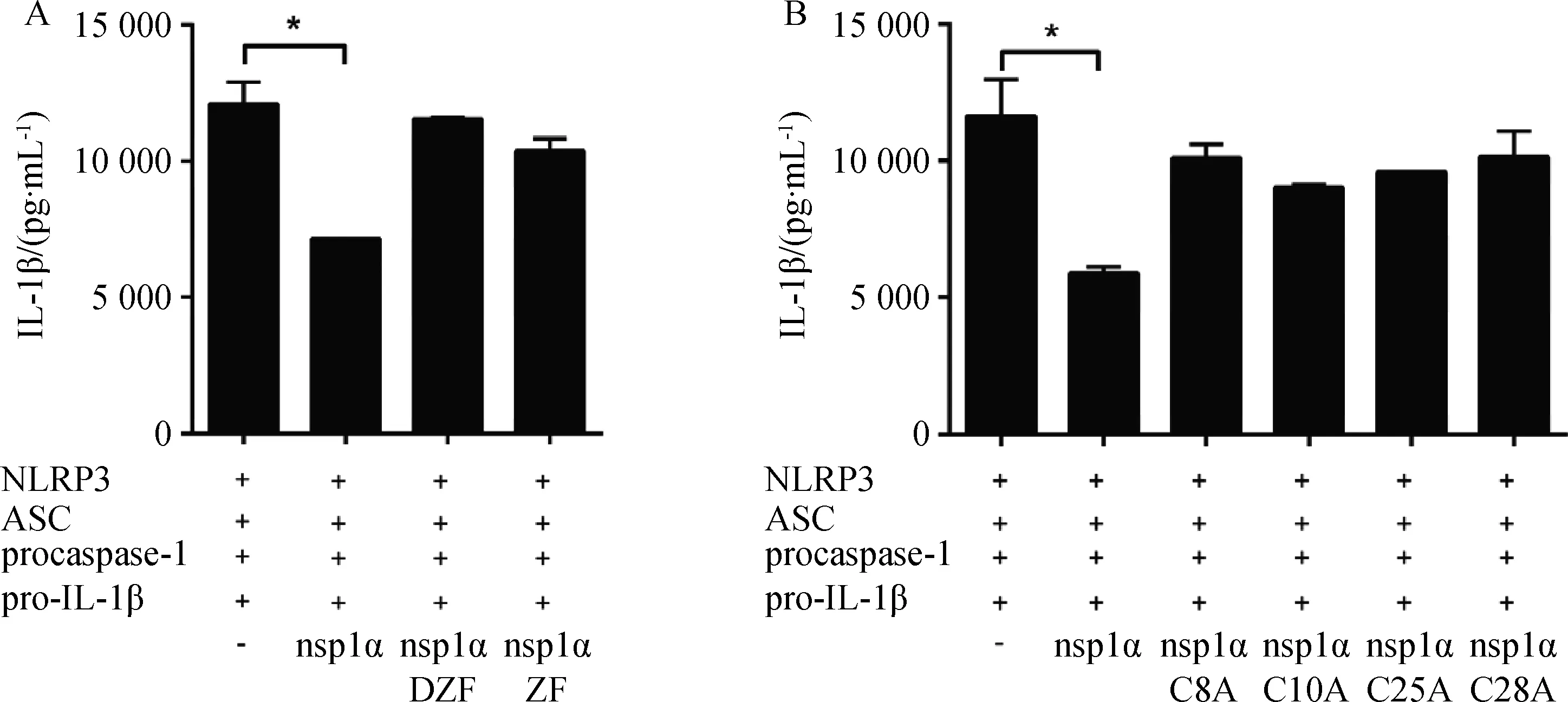
A.HEK293T细胞转染NLRP3炎症小体相关质粒和nsp1α或缺失ZF结构域突变体nsp1α DZF或只含有ZF结构域突变体nsp1α ZF或对照质粒pcDNA3.1-FLAG(-),ELISA检测IL-1β表达;B.HEK293T细胞转染NLRP3炎症小体相关质粒和nsp1α或四个单氨基酸突变体nsp1α C8A、nsp1α C10A、nsp1α C25A、nsp1α C28A或对照质粒pcDNA3.1-FLAG(-),ELISA检测IL-1β表达。*.P<0.05A.HEK293T cells were transfected with NLRP3 inflammasome and nsp1α or nsp1α DZF or nsp1α ZF or control plasmid pcDNA3.1-FLAG(-),IL-1β secretion was analyzed by ELISA;B.HEK293T cells were transfected with NLRP3 inflammasome and nsp1α or nsp1α C8A,nsp1α C10A,nsp1α C25A,nsp1α C28A or control plasmid pcDNA3.1-FLAG(-),IL-1β secretion was analyzed by ELISA.*.P<0.05图3 HEK293T细胞上ELISA检测结果Fig.3 The ELISA result in HEK293T cells
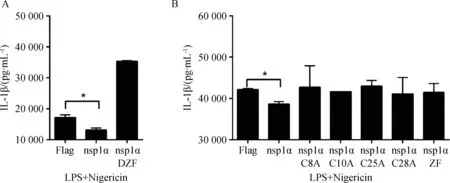
A.PAMs转染nsp1α或缺失ZF结构域突变体nsp1α DZF或对照质粒pcDNA3.1-FLAG,LPS和Nigericin共同刺激后,ELISA检测IL-1β表达;B.PAMs转染nsp1α或四个单氨基酸突变体nsp1α C8A、nsp1α C10A、 nsp1α C25A、nsp1α C28A或只含有ZF结构域突变体nsp1α ZF或对照质粒pcDNA3.1-FLAG,LPS和Nigericin共同刺激后,ELISA检测IL-1β表达。*.P<0.05A.PAMs were transfected with nsp1α or nsp1α DZF or control plasmid pcDNA3.1-FLAG(-) and then were stimulated with LPS plus Nigericin,IL-1β secretion was analyzed by ELISA;B.PAMs were transfected with nsp1α or nsp1α C8A,nsp1α C10A,nsp1α C25A,nsp1α C28A or control plasmid pcDNA3.1-FLAG(-) and then were stimulated with LPS plus Nigericin,IL-1β secretion was analyzed by ELISA.*.P<0.05图4 PAMs上ELISA检测结果Fig.4 The ELISA result in PAMs
3 讨 论
PRRS是影响世界养猪产业最为严重的疾病之一,每年给全世界养猪产业带来巨大的经济损失。PRRSV在感染猪体内主要侵害猪的巨噬细胞系统,特别是肺泡巨噬细胞,使受感染猪的免疫力降低,引发免疫抑制,造成持续性感染,从而给该病的预防和控制带来了困难。越来越多的研究证明了NLRP3炎症小体在宿主抗病毒感染中的重要作用。本研究首先利用HEK293T细胞缺失内源性炎症小体的特点,通过共转染NLRP3、ASC、procaspase-1和pro-IL-1β四个真核表达质粒,在HEK293T细胞上建立了NLRP3炎症小体的体外研究模型[12,18-19](图1)。然后,利用该炎症小体活化模型首次发现了拮抗炎症小体活化的PRRSV蛋白-nsp1α(图2A)。
IL-1β是一种重要的促炎性细胞因子,主要由单核细胞和巨噬细胞分泌,在宿主的先天性免疫系统和适应性免疫系统中发挥着重要作用。IL-1β的活性在其表达、成熟和分泌的过程中被严格调控,并且需要至少两个信号的共同作用:第一信号是由促炎性刺激物如LPS引起的IL-1β前体(pro-IL-1β)的生成;第二信号是由如ATP和Nigericin等刺激引起的procaspase-1的活化,活化的caspase-1剪切pro-IL-1β,使其成熟并且释放到细胞外。而图2B和图2C的结果不仅确证了图2A 的结果,而且也暗示nsp1α不仅抑制炎症小体活化的第一信号途径,而且也抑制炎症小体的第二信号途径。
前期研究表明N端锌指结构(C8-C10-C25-C28)在nsp1α抑制IFN-β中发挥着重要作用[13],而本试验的结果进一步证实ZF结构域在nsp1α抑制NLRP3炎症小体介导的IL-1β的表达和分泌中发挥着不可或缺的作用(图3和图4),这些试验结果表明nsp1α的N端锌指结构是其发挥免疫抑制功能的重要结构域。
综上所述,PRRSV感染激活NLRP3炎症小体并产生IL-1β等促炎性细胞因子来抵御病毒入侵和保护机体的同时,病毒自身又编码能拮抗NLRP3炎性小体活化的蛋白——nsp1α,使自身能够在宿主体内增殖。因此,本研究不仅进一步发现了PRRSV拮抗天然免疫的新机制——拮抗NLRP3炎性小体活化,而且也为PRRSV的防控提供了潜在的分子靶点和理论基础。
4 结 论
在HEK293T细胞上成功重构NLRP3炎症小体,利用这一模型以及LPS和Nigericin共刺激PAMs的模型,经过突变体转染试验共同证实了ZF结构在PRRSV nsp1α抑制由NLRP3炎症小体信号通路介导的IL-1β表达的过程中是必需的。
[1] MEULENBERG J J,HULST M M,DE MEIJER E J,et al.Lelystad virus,the causative agent of porcine epidemic abortion and respiratory syndrome(PEARS),is related to LDV and EAV[J].Virology,1993,192(1):62-72.
[2] NEUMANN E J,KLIEBENSTEIN J B,JOHNSON C D,et al.Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States[J].JAmVetMedAssoc,2005,227(3):385-392.
[3] ATIANAND M K,RATHINAM V A,FITZGERALD K A.SnapShot:inflammasomes[J].Cell,2013,153(1):272-272.e1.
[4] SCHRODER K,TSCHOPP J.The inflammasomes[J].Cell,2010,140(6):821-832.
[5] THOMAS P G,DASH P,ALDRIDGE J R Jr,et al.The intracellular sensor NLRP3 mediates key innate and healing responses to influenza A virus via the regulation of caspase-1[J].Immunity,2009,30(4):566-575.
[6] MURUVE D A,PÉTRILLI V,ZAISS A K,et al.The inflammasome recognizes cytosolic microbial and host DNA and triggers an innate immune response[J].Nature,2008,452(7183):103-107.
[7] KANNEGANTI T D,BODY-MALAPEL M,AMER A,et al.Critical role for Cryopyrin/Nalp3 in activation of caspase-1 in response to viral infection and double-stranded RNA[J].JBiolChem,2006,281(48):36560-36568.
[8] BI J,SONG S,FANG L,et al.Porcine reproductive and respiratory syndrome virus induces IL-1β production depending on TLR4/MyD88 pathway and NLRP3 inflammasome in primary porcine alveolar macrophages[J].MediatorsInflamm,2014,2014:403515.
[9] ALLEN I C,SCULL M A,MOORE C B,et al.The NLRP3 inflammasome mediatesinvivoinnate immunity to influenza A virus through recognition of viral RNA[J].Immunity,2009,30(4):556-565.
[10] ICHINOHE T,LEE H K,OGURA Y,et al.Inflammasome recognition of influenza virus is essential for adaptive immune responses[J].JExpMed,2009,206(1):79-87.
[11] STASAKOVA J,FERKO B,KITTEL C,et al.Influenza A mutant viruses with altered NS1 protein function provoke caspase-1 activation in primary human macrophages,resulting in fast apoptosis and release of high levels of interleukins 1beta and 18[J].JGenVirol,2005,86(Pt 1):185-195.
[12] KOMUNE N,ICHINOHE T,ITO M,et al.Measles virus V protein inhibits NLRP3 inflammasome-mediated interleukin-1β secretion[J].JVirol,2011,85(24):13019-13026.
[13] SHI X,ZHANG X,WANG F,et al.The zinc-finger domain was essential for porcine reproductive and respiratory syndrome virus nonstructural protein-1α to inhibit the production of interferon-β[J].JInterferonCytokineRes,2013,33(6):328-334.
[14] SNIJDER E J,KIKKERT M,FANG Y.Arterivirus molecular biology and pathogenesis[J].JGenVirol,2013,94(Pt 10):2141-2163.
[15] SONG C,KRELL P,YOO D.Nonstructural protein 1α subunit-based inhibition of NF-κB activation and suppression of interferon-β production by porcine reproductive and respiratory syndrome virus[J].Virology,2010,407(2):268-280.
[16] SUBRAMANIAM S,BEURA L K,KWON B,et al.Amino acid residues in the non-structural protein 1 of porcine reproductive and respiratory syndrome virus involved in down-regulation of TNF-α expressioninvitroand attenuationinvivo[J].Virology,2012,432(2):241-249.
[17] SUN Y,XUE F,GUO Y,et al.Crystal structure of porcine reproductive and respiratory syndrome virus leader protease Nsp1alpha[J].JVirol,2009,83(21):10931-10940.
[18] BRYAN N B,DORFLEUTNER A,ROJANASAKUL Y,et al.Activation of inflammasomes requires intracellular redistribution of the apoptotic speck-like protein containing a caspase recruitment domain[J].JImmunol,2009,182(5):3173-3182.
[19] CHUANG Y T,LIN Y C,LIN K H,et al.Tumor suppressor death-associated protein kinase is required for full IL-1β production[J].Blood,2011,117(3):960-970.
(编辑 白永平)
The Zinc-Finger Domain is Essential for Porcine Reproductive and Respiratory Syndrome Virus Nonstructural Protein 1α(nsp1α) to Inhibit the NLRP3 Inflammasome
WANG Chao1,2,5,SHI Xi-bao2,4,WANG Li2,CHEN Jing2,SI Chao-chao2,WANG Ai-ping6,DENG Rui-guang2,ZHANG Gai-ping1,2,3*
(1.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling712100,China;2.KeyLaboratoryofAnimalImmunologyoftheMinistryofAgriculture,HenanProvincialKeyLaboratoryofAnimalImmunology,HenanAcademyofAgriculturalSciences,Zhengzhou450002,China;3.CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China;4.CollegeofLifeSciences,HenanNormalUniversity,Xinxiang453007,China;5.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,Yangzhou225009,China;6.DepartmentofBioengineering,ZhengzhouUniversity,Zhengzhou450000,China)
Porcine reproductive and respiratory syndrome(PRRS) is an important viral infectious disease in swine industry worldwide.The causative agent is porcine reproductive and respiratory syndrome virus(PRRSV),which can inhibit host innate and adaptive immune response,cause immunosuppression,and lead to persistent infection.So it is difficult to control and eradicate PRRS.As a critical part of innate immune,NLRP3 inflammasome plays an extremely important role in host anti-viral immunity.Previous studies have shown that PRRSV activated the NLRP3 inflammasome.However,whether there are components of PRRSV which suppress NLRP3 inflammasome remains unknown.Therefore,in the present study,we first reconstructed NLRP3 inflammasome through co-transfecting expression plasmids encoding NLRP3,ASC,procaspase-1,and pro-IL-1β in HEK293T cells which are deficient in endogenous inflammasomes.Then,HEK293T cells and porcine alveolar macrophages(PAMs) were transfected with expression plasmid encoding nsp1α of PRRSV.The results indicated that nsp1α can apparently block NLRP3 inflammasome activation.The further mutation experiments demonstrated that deletion or mutation of Zinc-Finger(ZF) domain in N-terminal of nsp1α fails to activate the NLRP3 inflammasome.Our study first demonstrated that nsp1α had the ability to suppress the NLRP3 inflammasome-mediated IL-1β secretion and ZF domain was essential for nsp1α to inhibit the IL-1β induction.Our study reveals a new mechanism that PRRSV antagonize host innate immune responses and may provide some insights into the research on molecular targets of anti-PRRSV drugs and prevention of PRRS.
porcine reproductive and respiratory syndrome virus;nsp1α;ZF domain;NLRP3 inflammasome;IL-1β
10.11843/j.issn.0366-6964.2015.11.016
2015-05-11
国家自然科学基金青年基金(31302073);国家自然基金重大基础研究计划 (31490600);国家重点基础研究发展计划(973计划)(2014CB542700);国家自然基金面上项目(31472177)
王 超(1985-),男,河南鹤壁人,博士生,主要从事分子病原学和免疫学研究,E-mail:y-y-c@163.com
*通信作者:张改平(1960-),男,河南内黄人,中国工程院院士,教授,博士,主要从事动物免疫学及疫病快速检测技术研究,E-mail: zhanggaiping2003@163.com
S852.659.6
A
0366-6964(2015)11-2032-08



