马俊兴,何俊峰,崔 燕,张 倩,刘鹏刚
(甘肃农业大学动物医学院,兰州 730070)
随着海拔的升高,空气中的氧气含量会逐渐减少,造成长期暴露于高海拔环境中的哺乳动物会发生高山病。而生活在海拔3 000~6 000 m 高寒地区的牦牛(Bosgrunniens)已具有适应这种高原低氧环境的稳定遗传学特性[1-3]。低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein, LRP)为低密度脂蛋白受体家族中的一员,起初发现它主要与脂蛋白特别是残余乳糜微粒的清除有关,它有30多种配体分子,参与体内多种生理和病理过程[4]。通过配体竞争结合研究发现,与LRP的其他配体相比,结缔组织生长因子CTGF对LRP有非常高的亲合力;而其他配体与LRP具有中等亲合力。目前,CTGF与LRP之间高亲合力的机制尚不清楚,但这种高亲合力提示,LRP会在介导CTGF的生物学效应方面起重要作用;经基因敲除LRP基因缺陷细胞不能结合CTGF等研究证实,LRP是CTGF的受体,CTGF在细胞的快速内吞和降解过程依赖LRP[5]。LRP6作为CTGF受体之一,不仅与CTGF结合,还参与发育[6]。VEGFR2又称激酶功能区受体(kinase domain receptor,KDR),不仅是受体酪氨酸蛋白激酶。血管内皮细胞生长因子型受体2(VEGFR2)同时还是VEGF的主要功能受体。作为受体型酪氨酸激酶,主要通过调节血管内皮细胞的通透性,促进细胞有丝分裂趋化作用以及新生血管的形成,除此之外,还在抗内皮细胞凋亡、维持内皮细胞存活方面发挥重要作用[7]。VEGFR2与肺血管内皮细胞的凋亡有关。CTGF和VEGF与低氧条件下的肺有着十分紧密的联系[8-9]。国内外许多学者对LRP6和VEGFR2在肺癌、非小细胞肺癌和大鼠肺内的分布特点进行了研究[10-15]。本课题组之前对牦牛肺的组织结构进行过较为详细的研究[16-17]。研究表明,CTGF表达与分布是成年牦牛的基础分布,成年牦牛肺并未发生典型的肺纤维化或肺动脉高压的病理特征,即成年牦牛并未产生肺动脉高压。而在低氧环境下能刺激初生牦牛肺内VEGF含量增高,从而对牦牛的发育产生影响。但有关LRP6和VEGF在牦牛肺的分布特点未见报道。
本研究采用酶联免疫吸附方法、Western blot和免疫组织化学,对LRP6和VEGFR2在初生、半岁、成年和老年牦牛肺准确分布位置和表达量进行观察比较,为低氧环境下牦牛肺适应性结构的形成和机理提供部分理论基础,同时也为心肺疾病的治疗、高原医学和运动医学的研究提供部分理论资料。
1 材料与方法
1.1 试验动物及材料
本试验以牦牛为研究对象,分别采集新生(1~7日 龄)、半岁(5~6月龄)、成年(3~6岁)和老年(7~10 岁)健康牦牛肺组织样品,每个年龄段各5头 份,经颈动脉放血处死后,迅速采集肺膈叶的肺组织,固定于4%多聚甲醛溶液中,脱水、石蜡包埋,切片厚4 μm。其中新生牦牛购自甘肃省甘南自治州,其余组别牦牛购自青海省西宁市。
1.2 ELISA检测
1.2.1 材料 ELISA试剂盒购于武汉基因美生物科技有限公司(LRP6,JYM0135Bo;VEGFR2,JYM0139Bo)。
1.2.2 蛋白样品的提取 采集组织样本后,称重。加入一定量的PBS(pH7.4)。用液氮迅速冷冻保存备用。标本融化后,仍然保持2~8 ℃的温度。加入一定量的PBS(pH7.4),用手工或匀浆器将标本匀浆充分。离心5 min(2 000~3 000 r·min-1)。收集上清液。分装后,1份备用,其余-20 ℃冷冻保存。
1.2.3 方法 采用双抗夹心ELISA法,用纯化的LRP6和VEGFR2抗体包被微孔板,制成固相抗体,往包被抗体的微孔中依次加入LRP6和VEGFR2,再与HRP标记的LRP6和VEGFR2抗体结合,形成抗体-抗原-酶标记抗体复合物,经过彻底洗涤后,加底物TMB显色。TMB在HRP酶的催化下转为蓝色。用酶标仪在450 nm波长下的测定吸光值(OD值),通过标准曲线计算样本中LRP6和VEGFR2浓度。
1.3 Western-blot检测
1.3.1 蛋白样品的制备 取各个年龄段牦牛肺组织样品各0.1 g,分别加入等量的组织均质缓冲液(1 mLRIPA+10 μLPMSF),冰浴摇匀2 h,然后4 ℃,12 000 r·min-1离心5 min,吸取上清液,-20 ℃保存备用。
1.3.2 方法 取各年龄段牦牛肺的总蛋白各60 μL,分别加入20 μL溴酚蓝混匀,100 ℃煮10 min,冰上5 min,然后将蛋白进行SDS-PAGE,再用湿转法将其电极转移至硝酸纤维膜(NC)上,从正极~负极的顺序按4层滤纸、NC膜、凝胶块、4层滤纸的顺序摆放整齐,然后经50 g·L-1脱脂奶粉溶液室内封闭1.5 h,分别用LRP6和VEGFR2抗体4 ℃过夜孵育,用HRP标记山羊抗小鼠IgG温孵育1.5 h,每步完成后,用PBST洗膜,每次洗10 min,最后用ECL避光显色,X光显影、定影。扫描蛋白印迹条带。
1.4 免疫组织化学检测
1.4.1 抗体及检测系统 抗体和SP试剂盒均购自北京博奥森生物科技有限公司(Rabbit Anti-LRP6,bs-2905R;Rabbit Anti-VEGFR2,bs-10412R);DAB 显色试剂盒购自中杉金桥公司。
1.4.2 免疫组织化学染色 石蜡切片贴于免疫组化防脱切片上。60 ℃烘片4~6 h。切片脱蜡至水,蒸馏水浸泡5 min,PBS浸泡5 min。按照试剂盒说明书步骤进行处理,DAB显色。LRP6多克隆抗体和VEGFR2多克隆抗体均按照1∶400稀释后使
用,空白对照用0.01 mol·L-1的PBS代替一抗。
1.4.3 结果判定 以阳性表达强度为判定标准。深棕黄色为强阳性表达,浅棕黄色为阳性表达,浅黄色为弱阳性表达,接近背景色或无色为阴性。照片均通过Olympus-BX51生物显微镜和Olympus DP73照相系统进行拍摄。
1.5 数据分析

2 结 果
2.1 双抗体夹心ELISA检测LRP6和VEGFR2在牦牛肺的浓度
由表1和图1A可知,LRP6在初生和半岁的浓度均差异不显着(P>0.05),初生、半岁与成年和老年的LRP6浓度值均差异显着(P<0.05),成年和老年的LRP6浓度差异显着(P<0.05)。由表1和图1B可知,VEGFR2在初生和半岁的浓度差异不显着(P>0.05),初生、半岁与成年和老年的VEGFR2浓度差异均显着(P<0.05),成年和老年的VEGFR2浓度差异显着(P<0.05)。
表1LRP6和VEGFR2在不同年龄牦牛肺的浓度
Table1TheconcentrationofLRP6andVEGFR2inthelungofyaksatdifferentages

年龄 Age初生Newborn半岁Juvenile成年Adult老年Old LRP6 /(pg·mL-1)133.357±3.341c143.272±4.321c190.278±2.935b242.323±1.987aVEGFR2 /(mg·mL-1)136.028±2.414c140.074±3.040c173.378±4.186b241.954±3.909a
同一行字母不同表示组间差异显着(P<0.05),同一行字母相同表示组间差异不显着(P>0.05)
Different letters mean significant differences in the same row among different groups (P<0.05), same letters mean no difference in the same row among different groups (P>0.05)

不同年龄组间,字母不同代表组间差异显着(P<0.05),字母相同代表组间差异不显着(P>0.05)。下同Different letters mean significant differences among diferent age groups (P<0.05), same letters mean no difference among diferent age groups (P>0.05).The same as below图1 LRP6(A)和VEGFR2(B)在不同年龄牦牛肺的浓度Fig.1 The concentration of LRP6 (A) and VEGFR2(B) in the lung of yaks at different ages
2.2 Western-blot检测LRP6和VEGFR2在不同年龄牦牛肺的表达
由图2B可知,LRP6在初生和半岁牦牛肺的表达均差异不显着(P>0.05),初生、半岁与成年和老年牦牛肺LRP6表达均差异显着(P<0.05),成年和老年牦牛肺LRP6表达差异显着(P<0.05)。由图2C可知,在初生和半岁牦牛肺VEGFR2表达差异不显着(P>0.05),初生、半岁与成年和老年牦牛肺VEGFR2表达均差异显着(P<0.05),成年和老年牦牛肺VEGFR2表达差异显着(P<0.05)。
2.3 免疫组织化学观察LRP6和VEGFR2在不同年龄牦牛肺中的分布与表达
2.3.1 LRP6在牦牛肺的分布和表达情况 LRP6在初生和半岁年龄段牦牛肺的分布和表达量基本一致,在细支气管(图3a)、终末细支气管(图3b)、呼吸性细支气管(图3c)上皮细胞中以及肺泡

A. Western-blot结果; B. LRP6; C. VEGFR2A.The result of Western-blot; B. LRP6; C. VEGFR2图2 不同年龄中LRP6和VEGFR2蛋白在牦牛肺的表达Fig.2 The expressions of LRP6 and VEGFR2 protein in yak lung at different ages
Ⅱ型细胞中(图3d)呈弱阳性表达,在细支气管动脉(图3a)、伴行肺动脉(图3b)内膜上皮细胞和平滑肌也有分布,呈阳性表达。成年牦牛肺细支气管(图3e)、终末细支气管(图3f)上皮细胞和肺泡Ⅱ型细胞成阳性表达,呼吸性细支气管(图3g)上皮细胞的表达和初生以及半岁基本一致。而在老年牦牛肺细支气管(图3h)、终末细支气管(图3i)、呼吸性细支气管(图3j)上皮细胞呈强阳性表达,在细支气管肺动脉和肺泡Ⅱ型细胞(图3k)中也有大量分布,呈强阳性表达。图3l为空白对照。
2.3.2 VEGFR2在牦牛肺的分布情况 VEGFR2在初生和半岁年龄段牦牛肺的分布和表达量也基本一致,在细支气管(图4a)、终末细支气管(图4b)、呼吸性细支气管(图4c)上皮细胞中和平滑肌细胞以及肺泡Ⅰ型细胞中(图4d)呈弱阳性表达,在细支气管动脉(图4a)、伴行肺动脉(图4b)内膜细胞也有分布,也呈弱阳性表达。在成年牦牛肺在细支气管(图4e)上皮和管壁平滑肌中强阳性表达;在终末细支气管(图4f)只有上皮有阳性表达及管壁平滑肌中无表达;在呼吸性细支气管(图4g)和Ⅰ型肺泡上皮细胞和肺泡隔细胞(图4h)内强阳性表达。在伴行肺动脉血管壁平滑肌细胞和内皮细胞阳性表达(图4f)。而在老年牦牛肺细支气管(图4i)、终末细支气管(图4j)、呼吸性细支气管上皮和管壁平滑肌中以及Ⅰ型肺泡上皮细胞和肺泡隔细胞(图4k)上皮细胞呈强阳性表达,图4l为空白对照。

a.初生牦牛肺细支气管及肺动脉;b.半岁牦牛肺终末细支气管及伴行动脉;c.初生牦牛肺呼吸性细支气管;d.半岁牦牛肺泡囊;e.成年牦牛肺细支气管及肺动脉;f.成年牦牛肺终末细支气管及伴行动脉;g.成年牦牛肺呼吸性细支气管;h.老年牦牛肺细支气管及肺动脉;i.老年牦牛肺终末细支气管及伴行动脉;j.老年牦牛肺呼吸性细支气管;k.老年牦牛肺泡囊;l.空白对照。B.细支气管;TB.终末细支气管;RB.呼吸性细支气管;PA.肺动脉;AS.肺泡囊。下同a.Newborn yak lung bronchioles and pulmonary arteries; b.Juvenile yak lung terminal bronchiole and accompanying artery; c.Newborn yak lung respiratory bronchioles; d.Juvenile yak lung alveolar sac; e.Adult yak lung bronchioles and pulmonary arteries; f.Adult yak lung terminal bronchioles and accompanying arteries; g. Adult yak lung respiratory bronchioles; h.Old yak lung bronchioles and pulmonary arteries; i.Old yak lung terminal bronchioles and accompanying artery; j.Old yak lung respiratory bronchioles; k.Old yak lung alveolar; l. The blank control; B.Bronchioles; TB.Terminal bronchioles; RB. Respiratory bronchioles; PA.Pulmonary artery; AS.Alveolar sacs. The same as below图3 免疫组织化学染色检测LRP6在不同年龄牦牛肺的表达(a、c、d、e、g、h、i、k、l:400×;b、f、j:200×)Fig.3 Immunohistochemical expression of LRP6 in the lung of yak at different ages(a,c,d,e,g,h,I,k,l:400×;b,f,j:200×)
表2LRP6在不同年龄牦牛肺中的表达情况
Table2TheLRP6expressioninthelungatdifferentagesyak

年龄Age细支气管Bronchioles肺动脉Pulmonary artery终末细支气管Terminal bronchiole上皮Epithelium管壁平滑肌Smooth muscle内膜Ti中膜Tm外膜Ta上皮Epithelium管壁平滑肌Smooth muscle呼吸性细支气管Respiratorybronchiole肺泡囊Alveolar sacs初生 Newborn+++-+++++半岁Juvenile+++-+++++成年Adult++++++++++++老年Old++++++++++++++
+++.强阳性表达;++.阳性表达; +.弱阳性表达;-.阴性表达。下同
+++.The strong positive expression; ++.The positive expression; +.The weak positive expression; -.The negative expression. The same as below
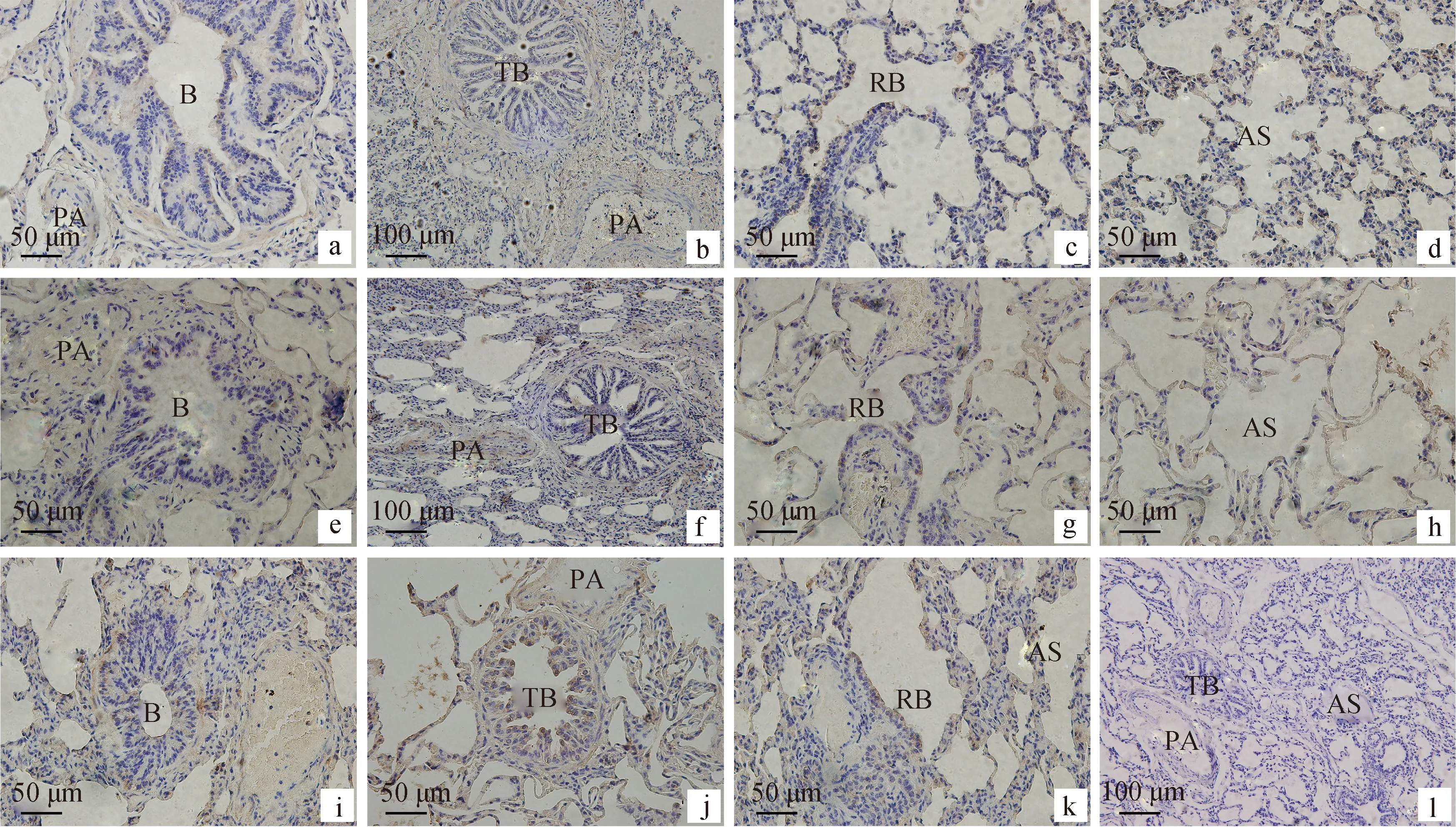
图4 免疫组织化学染色检测VEGFR2在不同年龄牦牛肺的表达(a、c、d、e、g、h、i、k、l:400×;b、f、j:200×)Fig.4 Immunohistochemical expression of VEGFR2 in the lung of yak at different ages(a,c,d,e,g,h,i,k,l:400×;b,f,j:200×)
表3VEGFR2在不同年龄牦牛肺中的表达情况
Table3TheVEGFR2expressioninthelungatdifferentagesyak

年龄Age细支气管Bronchioles肺动脉Pulmonary artery终末细支气管Terminal bronchiole上皮Epithelium管壁平滑肌Smooth muscle内膜Ti中膜Tm外膜Ta上皮Epithelium管壁平滑肌Smooth muscle呼吸性细支气管Respiratorybronchiole肺泡囊Alveolar sacs初生Newborn+++++++++半岁Juvenile+++-+++++成年Adult+++++++++++老年Old++++++++++++++
3 讨 论
VEGFR2广泛存在于正常机体的组织器官中。笔者观察到肺内VEGFR2主要分布于肺泡Ⅱ型细胞,支气管上皮细胞、肺血管平滑肌细胞、成纤维细胞、肺泡巨噬细胞及肺血管内皮细胞也有VEGFR2表达。生长发育过程中,肺组织内皮血管增生、迁移、出芽、新生心血管形成与细胞外基质重塑都需要VEGFR2参与[18]。有研究证实在新生大鼠予以VEGFR2受体拮抗剂后肺组织内皮细胞凋亡增加,出现肺气肿样病变[19]。VEGFR2与血导管、血管形成和造血有关。提示VEGFR2是血导管生成的主要调控因子[20]。Hanahan和Folkman[21]1996年提出了“血管形成的开关平衡假说”,认为血管生成受多种促进因子和血管生成抑制因子的共同调控,当生长因子的浓度下降时,开关处于开放状态导致血管形成。成年时期由于肺部血管内皮细胞增生不活跃,此时VEGFR2可能对维持肺血管的正常生理功能起一定的作用。VEGFR2是血管生长和发育的主要调节者,它们不仅在内皮细胞上有表达,在非内皮细胞上也有表达。说明VEGFR2可能在维持正常生理状况及抗损伤修复中发挥作用。
本研究发现随着年龄的增加,牦牛肺组织中的VEGFR2表达也逐渐上升,本研究结果与Hanahan和Folkman[21]对血管内皮生长因子及其受体在大鼠肺发育过程中的表达研究结果不同,大鼠肺内VEGFR2不仅在胎儿及新生儿肺内表达,以后也持续存在,但水平很低。这可能表明牦牛随着年龄的增长,肺组织中内皮细胞增生、迁移能力显着上升,其抗损伤能力也随之上升。肺内VEGFR2逐渐增加以满足其生长需要,说明可能与牦牛所处的高原低氧环境有关系。
LRP6是Wnt信号转导途径必不可少的受体[6],通过LRP6抑制Wnt信号传导降低了肺癌细胞体内自我更新的能力[22]。Wnt信号途径是胚胎早期发育过程中调控细胞生长、发育和分化的关键途径,使细胞沿着某一方向定向分裂,使新产生的细胞定位于某个区域,决定着细胞分化的命运[23], 并在涉及肺癌发展的多个过程中发挥作用[24]。LRP6与结缔组织生长因子CTGF有高度的结合能力,证实LRP6是CTGF的受体之一[5]。笔者观察到LRP6在牦牛不同发育时期肺组织中支气管上皮细胞、平滑肌细胞和肺动脉等也均有表达。这与Wang等[25]对Wnt信号传导通过LRP6作用激活上皮细胞和血管平滑肌细胞的研究结果相似。随着已有大量研究报道LRP6作为Wnt信号传导的受体可调节肺上皮细胞和内皮细胞的黏附、增殖、迁移和生长促进血管生长和细胞外基质沉积,调节血管生成因子的产生或活性,并参与直接和间接的血管生成调节机制,从而引起肺动脉和小动脉重塑[26-28]。
4 结 论
本研究结果表明:1)在分布区域上,VEGFR2和LRP6均在肺内支气管及其分支的上皮细胞、平滑肌细胞表达较高。2)在年龄方面,LRP6和VEGFR2在牦牛肺组织中表达丰富且在不同年龄段的表达有差异。说明这2种因子可能共同作用于牦牛肺细胞,促进肺动脉重建以抵抗高原低氧对肺的损伤。为进一步研究高原低氧对牦牛肺的损伤,还需对牦牛肺进行更深入的研究,从而为探索治疗肺疾病提供新的思路。



