曹晋康,张 纯,王佳瑶,李晓彤,王鹏宇,方颖妍,张 昱,丁 宁,姜 力
(中国农业大学动物科学技术学院,北京 100193)
公牛精液品质是综合反映精子授精能力和公牛繁殖力的重要指标。随着精液冷冻保存技术和人工授精技术的发展和普及,公牛冷冻精液质量的提高备受关注。冻精解冻后的精子活力对母牛的受孕率和奶牛生产系统有着重要的经济影响。精子冷冻保存是一个持续的过程,包括降低温度、细胞脱水、冷冻和储存。这个过程中精子细胞会受到生理损伤,如膜结构和精子代谢的改变,导致解冻后的精子活力和生育能力明显下降[1]。
目前,我国荷斯坦公牛冻精活力与国外一些奶业发达国家存在明显的差距,亟待进一步提高。赵俊金等[2]对全国39个牛冷冻精液生产企业的冷冻精液样品数据进行分析,结果显示我国各品种公牛的冻精解冻后平均活力仅为40.9%,其中743份奶牛冷冻精液解冻后的平均精子活力为41%。然而,欧共体等国家牛冷冻精液的冻后活力最低要求已经达到50%以上[3-4]。Kaminski等[5]的研究显示,波兰某一人工授精站统一环境条件下饲养的120头荷斯坦公牛冻精解冻后的精子活力平均值为62.51%。Hitit等[6]对加拿大Alta Genetics公司2008年至2016年间8年的公牛冻精解冻后精子活力进行统计,结果显示荷斯坦公牛群体冻精的解冻后精子活力平均值为(57.9±6.5)%,其中耐冻性好的公牛精子冻后活力平均值为63.83%,而耐冻性差的公牛精子冻后活力平均值也达到52.10%。
近年来研究人员发现,即便在相同的冷冻程序下,不同公牛的精液受到冷应激后所产生的变化也不相同,一部分种公牛虽然鲜精活力良好,但冻后精子活力大幅下降。Druet等[7]对法国10个荷斯坦公牛家系的515头公牛解冻后精子活力进行遗传力估计,结果显示该性状的遗传力为0.21,属于中等遗传力性状。这表明遗传因素对公牛冻精解冻后的精子活力具有重要影响。公牛精液冻后活力在个体间所表现的差异,显然一部分是由于遗传基础不同造成的。目前,对于精液冷冻的研究主要是围绕低温保护剂、添加剂和冷冻方法,而从遗传角度挖掘影响公牛精子耐冻性关键基因的研究仍非常有限。
随着近年来组学技术的快速发展,越来越多的研究利用组学技术从不同水平分析具有不同耐冻性公牛精子的遗传差异[8-11]。由于精液中含有多种代谢物,代谢组也被用于精子耐冻性方面的研究。Evans等[12]检测了12头高、低耐冻性荷斯坦公牛精子的脂肪酸组成,发现这些脂肪酸组成在两组间存在极显着差异(P<0.001),并且发现这些差异表达的脂肪酸在膜功能、细胞氧化应激以及解冻后精子的生存能力等方面具有重要的作用。很早以前就有学者发现精子经冷冻-解冻过程会发生膜蛋白分离或缺失的现象[13],因此蛋白质组学研究是揭示精子耐冻性机制的一条重要途径。目前已被报道的与精子耐冻性有关的蛋白家族主要包括HSP家族蛋白、BSP家族蛋白和AQP家族蛋白[14-16]。本研究以中国荷斯坦公牛精液为研究对象,选择精子耐冻性表型两尾极端个体的精子细胞进行蛋白质组学分析,通过检测差异表达蛋白并结合生物信息学分析,筛选与精子耐冻性相关的重要功能基因。研究结果不仅为揭示公牛精子耐冻性分子基础提供理论依据,同时为将来有效开展种公牛精子耐冻性性状的分子育种提供重要信息。
1 材料与方法
1.1 试验动物
本研究试验公牛来自山东奥克斯公牛站,所有公牛在同一环境条件下进行饲养管理,健康状况良好。按照鲜精精子活力和冻后活力多次表型记录对所有荷斯坦公牛进行筛选,最终得到高精子耐冻组(high freezability, HF)的9头荷斯坦公牛(鲜精活力> 0.65,冻后活力> 0.40)和低精子耐冻组(low freezability, LF)的6头荷斯坦公牛(鲜精活力> 0.65,冻后活力≤ 0.27)用于后续蛋白质组研究(图1)。
1.2 精液的采集与检测
采用假阴道法采集15头公牛新鲜精液,取到鲜精后使用19 ℃恒温冰箱转移至实验室,使用PBS稀释后,取10 μL的精液滴在载玻片上,利用计算机辅助精子分析系统(CASA)检测精子活力等各项参数。每头公牛精液的冻后精子活力为该个体采样前20次记录在册的冻精解冻后精子活力的均值。
1.3 总蛋白的提取
分别将采集的15头公牛的精子样品中加入裂解液大约400 μL(7 mol·L-1尿素,2 mol·L-1硫脲,0.1% PMSF蛋白酶抑制剂,65 mmol·L-1DTT),然后在冰浴条件下进行超声(70 W,5 s开,10 s关,3~5次)处理,随后在冰上放置40 min。将上述溶液14 000×g离心30 min后,收集上清。提取的总蛋白浓度采用Bradford assay (Beyotime, Shanghai, China)测定。
1.4 蛋白质组测序及数据分析
1.4.1 测序数据质量控制 采用Label-free技术对精子的蛋白质组进行分析。通过酶解和液相色谱串联质谱检测,获得测序数据后进行数据库搜库。本试验使用牛Uniprot蛋白序列库作为数据库(https://www.uniprot.org/proteomes?query=Bos+taurus)进行搜索。测序产生的原始文件采用Maxquant(1.5.2.8)软件分析,导入质谱原始文件及数据库文件,肽段质控FDR设为1%,特异性肽段设为1,最小肽段长度设为7,其他参数采用默认设置。
1.4.2 差异表达蛋白分析 对获得的测序数据进行quantile归一化处理,分别保留在两组中都有表达的蛋白(HF组中重复鉴定次数大于4,LF组中重复鉴定次数大于3),用最小值填补缺失值,使用在线网站 (https://www.omicstudio.cn/tool/13) 进行主成分分析(principal component analysis, PCA),然后采用R程序limma包进行差异表达蛋白筛选,以差异倍数|log2FC|>1以及P<0.05为显着性阈值;只在HF组或LF组中鉴定到的蛋白视为特异性表达蛋白,将鉴定到的显着差异表达蛋白和特异性表达蛋白统称为差异表达蛋白(differentially expressed proteins,DEPs)。
1.4.3 基因的富集分析及蛋白互作分析 通过DAVID数据库(https://david.ncifcrf.gov/)对DEPs进行GO和KEGG富集分析,以P<0.05为阈值,鉴定DEPs显着富集的GO条目和KEGG通路。利用STRING蛋白质互作数据库(https://cn.string-db.org/)进行DEPs的互作网络分析。利用Cytoscape软件构建互作关系网络图,使用Cytohubba插件中的Maximal Clique Centrality (MCC)方法给每个蛋白进行赋值评分,筛选评分前10的蛋白构建重要蛋白互作网络;使用MCODE插件的默认参数筛选网络得分最高的子网络。
1.4.4 QTL数据库比对 首先,搜索动物QTLs数据库中(https://www.animalgenome.org/,下载日期:2023年12月2日)与牛解冻后活精子百分比性状相关的QTLs,对其进行基因注释。其次,将检测到的差异表达蛋白与QTL区域内的关联基因进行比对,进一步筛选与精子耐冻性相关的重要候选功能基因。
1.5 数据统计分析
公牛冻前和冻后精子活力表型统计分析采用SPSS Statistics软件进行独立样本T检验,P<0.05被认为存在显着差异。
2 结 果
2.1 试验公牛精子耐冻性差异分析
对HF组和LF组公牛的精子活力表型进行分析,结果显示HF组鲜精的平均精子活力为70%,LF组鲜精平均精子活力为68%,两组精液冻前活力没有显着差异。然而,HF组冻精解冻后的平均精子活力为43%,显着高于LF组(22%),表明HF组和LF组的冻后精子活力存在显着差异(P<0.01,图1)。
2.2 精子蛋白质的鉴定与分析
蛋白质组测序结果显示,在所有样品中共检测到36 151个肽段,质控过滤后最终鉴定到1 944个蛋白,其中HF组鉴定到1 823个蛋白质,LF组鉴定到1 756个蛋白(图2A),两组都鉴定到的蛋白共1 635个。利用HF和LF组精子蛋白质表达量信息进行主成分分析,结果显示,HF组样品和LF组样品明显分为两簇(图2B),表明蛋白质丰度在两组之间存在较大差异。在HF和LF组同时鉴定到的1 635个蛋白质中,共检测到123个显着的组间差异表达蛋白(|log2FC|≥1,P≤0.05)。与LF组相比,HF组有73个差异表达蛋白显着上调,50个差异表达蛋白显着下调(图2C,D)。表1显示了差异倍数最高的前10个蛋白的信息。此外,在HF组和LF组分别鉴定到了只在单一组中表达的188和121种特异表达蛋白(图2D)。在本研究中,将显着差异表达蛋白和特异表达蛋白均定义为差异表达蛋白(differentially expressed proteins, DEPs),因此共鉴定到432个差异表达蛋白。
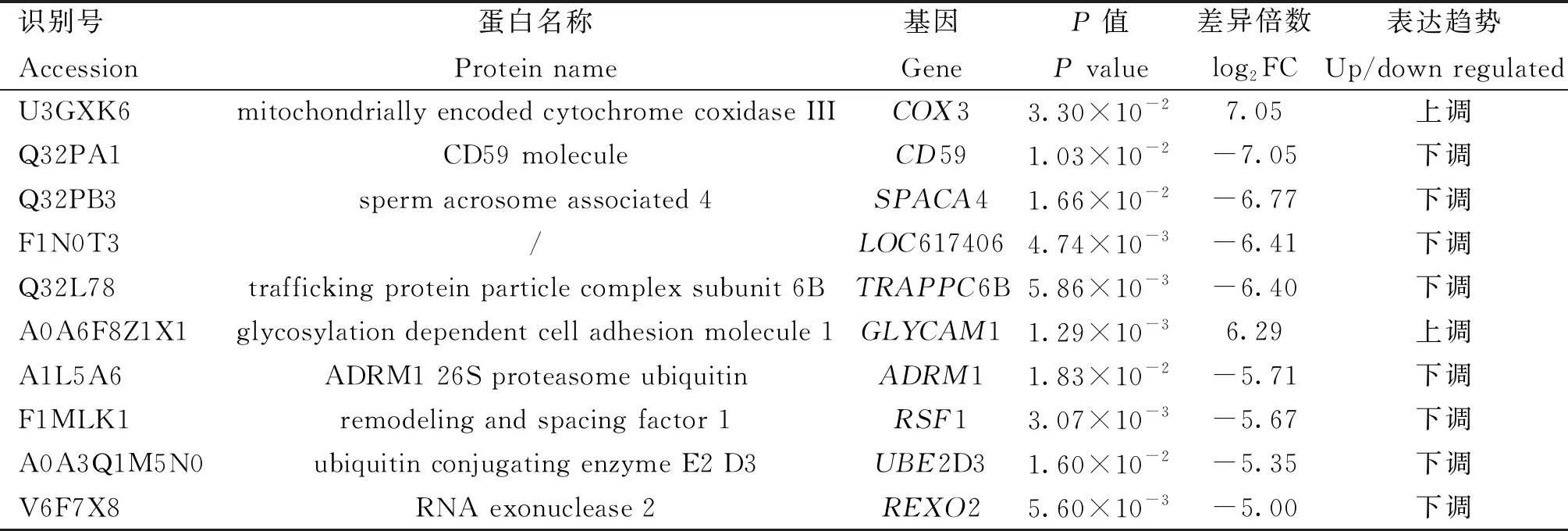
表1 高耐冻组前10个上调或下调的差异表达蛋白
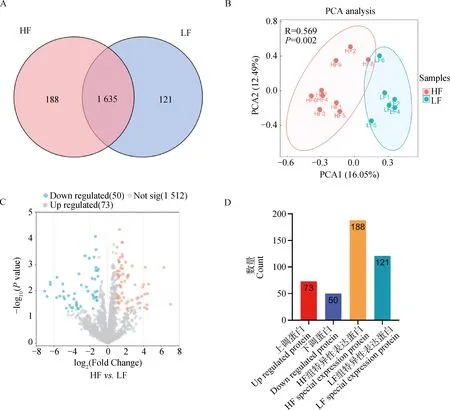
A. HF组和LF组精子中鉴定到的蛋白质数量;B. PCA分析结果显示HF和LF组公牛明显分为两簇;C. 差异蛋白火山图(红色圆点代表HF组上调蛋白,蓝色圆点代表LF组下调蛋白);D. 差异表达蛋白鉴定结果(红色柱子代表HF组上调表达蛋白;紫色柱子代表HF组下调表达蛋白;橙色柱子代表HF组特异表达蛋白;蓝绿色代表LF组特异表达蛋白)A. The number of proteins identified in the sperm of the HF and LF groups; B. PCA result showed a distinct separation between the HF and LF bulls; C. Volcano plot of differential proteins (Red dots represent up-regulated proteins in the HF group, and blue dots represent down-regulated proteins in the HF group);D. The result of differentially expressed proteins identification (Red bar represents up-regulated proteins in the HF group, purple bar represents down-regulated proteins in the HF group, orange bar represents special expression proteins in the HF group, and turquoise bar represents special expression proteins in the LF group)
2.3 差异表达蛋白功能富集分析
对DEPs进行GO富集分析,结果显示在生物过程(biological progress, BP)、细胞成分(cellular component,CC)以及分子功能(molecular function,MF)3个方面显着富集到147个GO条目,BP和MF分类中P值最显着的前10个条目如表2所示。在生物过程方面,主要富集到“抗原加工和内源性肽抗原通过MHC Ib类递呈”、“抗原加工与递呈”、“嘌呤核苷酸生物合成过程”和“精子与透明带结合”等生物学过程;在细胞成分方面,主要富集到“胞质”、“细胞质”、“内质网”等;在分子功能方面,主要富集“蛋白结合”、“ATP结合”、“特异性同型蛋白质结合”等。
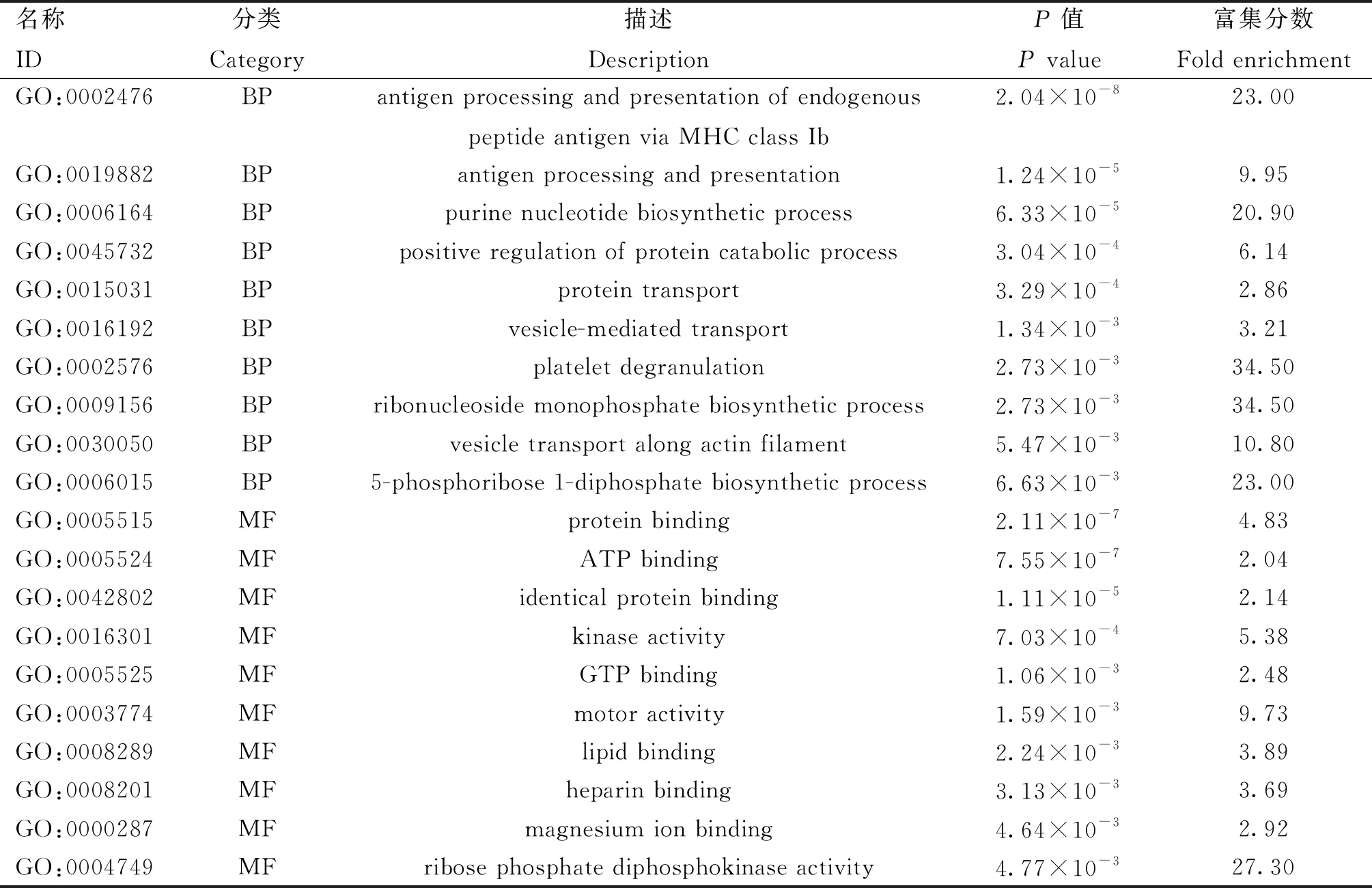
表2 GO富集分析BP、MF各前10显着的GO条目
对DEPs进行KEGG富集分析,结果显示36条通路显着富集,最为显着的前3条通路分别是“内吞作用”、“吞噬体”、“代谢途径”通路(表3)。这3条通路共包含了85个差异表达蛋白,其中ATP6AP1同时富集到“吞噬体”和“代谢通路”两条通路中,RAB7A、BoLA、RAB5C同时富集到“内吞作用”以及“代谢通路”两条通路中。ACSL4除了富集到“代谢通路”中以外,还富集到“线粒体”的细胞成分GO条目中以及“花生四烯酮-辅酶a连接酶活性”的分子功能GO条目中。

表3 KEGG 富集分析前10显着的通路
2.4 差异表达蛋白互作网络分析
利用STRING网站对DEPs进行蛋白网络互作分析,并使用Cytoscape中的Cytohubba插件计算出评分前10的具有强互作关系的蛋白,分别是NDUFS6、ND1、ND5、ATP5F1A、ACTB、HSPA1A、ANXA5、LAMP1、APP、CANX,其中6个蛋白在HF组表达显着上调,4个蛋白在LF组表达显着上调(图3A)。此外,研究发现一个重要的子网络(图3B),包含24个差异表达蛋白,其中17个蛋白在HF组显着上调,7个蛋白在HF组显着下调。值得注意的是,该网络中的蛋白显着富集于“线粒体呼吸链复合体I”、“ATP酶激活剂活性”、“线粒体电子传递-NADH到泛醌”、“氧化磷酸化”等,表明这些蛋白与精子能量供应存在密切关系。
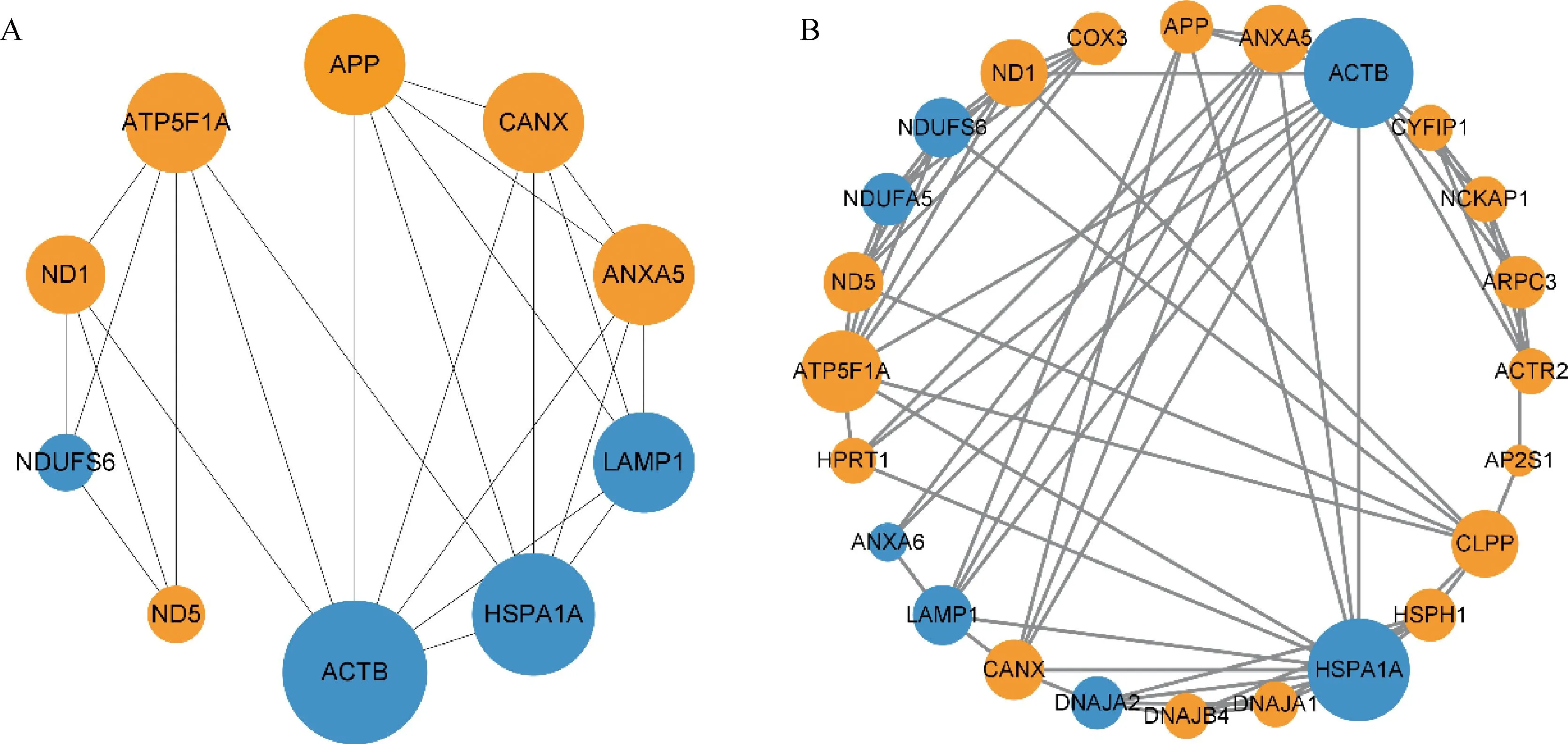
A. DEPs 中前10个具有强相互作用的蛋白网络;B. PPI 网络中的评分最高的子网络(蓝色圆圈代表HF组下调蛋白,橙色圆圈代表HF组上调蛋白,圆圈大小代表连接节点的多少)A. Top 10 DEPs with strong interaction relationships; B. The sub network with the highest score in the PPI network (The blue circles represent down-regulated proteins in the HF group, the orange circles represent up-regulated proteins in the HF group, and the size of the circle represents the number of connected nodes)
2.5 QTL数据库比对
在QTLdb数据库(https://www.animalgenome.org/)中检索与牛解冻后活精子百分比有关的QTLs,共涉及519个功能基因。通过与差异表达蛋白结果比对,鉴定到9个与精子抗冻性相关的重要候选基因,分别是CRISP3、TUBB、ABHD16A、CRISP1、HSPA1A、ADAM3A、VWA7、ENPP4和LY6G5C。其中CRISP3、TUBB、ABHD16A在HF组中显着上调表达,CRISP1、HSPA1A、ADAM3A、VWA7、ENPP4、LY6G5C在HF组中显着下调表达。其中HSPA1A不仅富集于最显着的“内吞体通路”中,同时还富集到“ATP结合”的分子功能GO条目。此外,CRISP1和ADAM3A显着富集到“精子和透明带结合”的生物过程GO条目。
3 讨 论
随着对优良种公牛冻精的需求越来越多,公畜的精液品质备受关注。有研究显示遗传基础是导致精子耐冻性差异的重要因素之一[7]。蛋白质作为生命活动的直接执行者,其表达差异能够对精子的耐冻性产生最直接影响。本研究对不同耐冻性的公牛精子细胞进行全蛋白质组测序和分析,结果共检测到1 944种蛋白质,其中432个为差异表达蛋白。相较于LF组,HF组有261个DEPs表达上调,171个DEPs表达下调。
目前对牛精子耐冻性生物标记物的研究集中于精子和精浆的蛋白质组学[14-16]、代谢组学[17]和脂质组学[12]。一些与精子耐冻性相关的重要蛋白已被报道,如HSP90、BSPs和AQPs[14-16]。HSP家族蛋白是生物机体或细胞受到突然应激而产生的一系列维持生命体正常生理功能且高度保守的蛋白,对细胞发挥保护作用[18]。据报道,热休克蛋白90(HSP90)的表达与公牛精子的耐冻性呈正相关[19]。Spinaci等[20]发现,精子遭受应激时,HSPA1A蛋白的细胞分布会发生变化。此外,有研究显示精子中HSPA1A的含量与精子氧化还原状态之间呈正相关关系[21]。本研究发现,HSPA1A在LF组中呈现高表达,并且富集于“ATP结合”等重要GO条目中,暗示HSPA1A在牛精子冻融过程中遭受到应激时可能发挥重要功能,进而影响精子的耐冻性。
BSP家族蛋白是由精囊分泌的大量存在于牛精浆中的蛋白家族,包括BSP-A1/BSP-A2(BSP1)、BSP-A3(BSP3)、BSP-30kD(BSP5)几种亚型[22],占精浆总蛋白质的50%~65%[23]。其中,BSP1是BSP-A1和BSP-A2蛋白的混合物,其在公牛精子冷冻保存过程中的作用已经被广泛研究[15]。BSP蛋白通过部分插入精子质膜覆盖在精子表面[24],与精子膜上的胆碱磷脂结合[25-26],在膜稳定和失稳过程中发挥作用,还可与获能因子结合促进精子获能。BSP蛋白可通过刺激胆固醇和磷脂外流引起精子质膜的改变[25-26],因此精子过度暴露于BSP中对精子质膜有害。Ardon和Suarez[24]发现,3种BSP蛋白(BSP1、BSP3、BSP5)在冷冻解冻后牛精子中的含量均高于新鲜精子。随后,Magalhães等[27]发现BSP1蛋白在精子抗冻性好的公牛精液中表达量低,而在精子抗冻性差的公牛精液中表达量高。本研究结果与前人的研究结果一致,BSP3蛋白在LF组中显着高表达(log2FC=-1.72,P=0.003),推测BSP3高表达会降低精子的耐冻性。
本研究发现,大量与代谢通路和能量有关的蛋白在HF和LF组间显着差异表达,如ACTR2、STK24、DNAJA2、ATP1A1等。在精子中,ATP是维持精子活力和精子获能所必须的能量来源。DGKA、ATP5F1A、ATP11C、HSPA1A等差异表达蛋白富集在“ATP结合”的GO条目。近年来有研究表明,脂肪酸代谢受阻也会显着影响精子活力以及获能[28]。同时有研究显示水牛精子的耐冻性与脂质代谢有关[29]。本研究发现,部分差异表达蛋白显着富集于代谢通路,其中4个蛋白(ACSL4、ACSL5、HACD3、TECR)显着富集于脂肪酸代谢通路。ACSL家族作为脂质代谢中间体,促进脂肪酸代谢和膜修饰。目前已在人类和啮齿动物中鉴定出5种ACSL亚型(ACSL1、ACSL3、ACSL4、ACSL5和ACSL6),它们在脂肪酸代谢中具有不同的功能[30]。本研究发现,ACSL4和ACSL5在HF组中显着上调表达,暗示ACSL4和ACSL5可能通过调节促进脂肪酸代谢,帮助精子在冻融过程中生存。
此外,本研究在蛋白质互作网络中发现6个DEPs (ATP5F1A、NDUFA5、NDUFS6、COX3、ND1、ND5)在氧化磷酸化通路显着富集,并且存在互作关系。其中NDUFA5、NDUFS6是NADH脱氢酶的组成成分[31],本研究结果显示NDUFA5、NDUFS6在LF组中高表达,这两个蛋白的高表达可能促进ATP的过量产生,使精子在冻融过程中提前获能,进而导致精子死亡。有研究显示,将雄鹿添加抗氧化剂的冷冻精液复苏后比未添加抗氧化剂的复苏后精子活力高,并且ATP5F1A表达量有显着上升[32]。本研究结果显示,ACTB蛋白是蛋白互作网络中连接度最高的蛋白,并且与HSPA1A蛋白存在直接或间接的互作关系。有研究显示,ACTB在细胞中主要是调节细胞体积,并构建精子细胞的细胞骨架[33],它定位于精子的鞭毛膜和顶体膜,其在精子运动和获能中发挥作用[34-36],除此以外,ACTB与TBC1D21互作可以调节精子中部的结构[37]。本研究中,ACTB蛋白的表达在LF组显着上调,表明ACTB蛋白可能对精子的耐冻性具有不利的作用。
通过与QTL数据库收录的QTL定位结果比对,发现了9个与精子耐冻性相关的重要候选基因。其中CRISPR3蛋白在HF组显着上调表达,而CRISPR1蛋白在LF组显着上调表达。已有研究显示CRISPR3可以与精子顶体膜相结合[38]。CRISPR1具有离子通路调节活性[39-40],可能会影响精子在获能过程中摄取离子[41],同时该蛋白参与精子与卵子的透明带结合[42-43]。研究发现,CRISPR3和CRISPR1蛋白在附睾精子成熟过程中被包裹在精子表面或插入质膜中[39,44],暗示这些蛋白可能通过与精子的顶体膜结合调节精子的冻后活力。
4 结 论
综上所述,本研究使用Label-free技术对中国荷斯坦公牛不同耐冻性精子进行蛋白质组学分析,筛选和挖掘与公牛精子耐冻性相关的重要功能基因。通过蛋白质组学差异表达分析,共鉴定到432个DEPs,其中9个DEPs同时位于牛解冻后活精子百分比相关的QTLs内。生物信息学分析显示这些DEPs主要集中在代谢通路和氧化磷酸化通路。本研究揭示了中国荷斯坦公牛不同耐冻性精子的蛋白质组成特征和差异,并挖掘了HSPA1A、BSP3、ACSL4等重要候选蛋白可作为预测精子耐冻性的标志物,为深入理解公牛精子耐冻性分子机制提供理论依据。



