陈虹宇,魏雅婷,李若玺,高留涛*,刘深贺*
(1.河南农业大学动物科技学院,郑州 450046;2.河南省鼎元种牛育种有限公司,郑州 450000)
性别控制技术通常与人工授精、体外受精以及胚胎移植等技术相结合来获得期望的后代性别,是畜牧业中一个具有重要生产实践意义的研究课题。在哺乳动物中,雄性产生两种类型精子,一类携带X染色体(X精子),一类携带Y染色体(Y精子),而雌性产生的卵子只携带X染色体。在受精过程中,X精子与卵子结合产生雌性(XX),Y精子与卵子结合产生雄性(XY),即后代的性别是由雄性产生的精子类型决定。根据X精子和Y精子在物理和化学方面的差异,可以实现二者的分离,从而选择特定类型的精子进行育种工作,实现后代性别控制。本文综述了用于分离动物精液中X精子和Y精子方法的研究进展,旨在为今后动物性控技术的应用提供理论参考。
1 流式细胞分离法
目前,流式细胞分离法是唯一商业化的性别控制技术[1],能够分离携带X染色体和Y染色体的精子。哺乳动物X精子的DNA含量比Y精子的DNA含量高[2-3],如人的X精子与Y精子的DNA含量差异大约为2.8%[4],而家畜的X精子与Y精子的DNA含量差异更加显着,平均值高达4%(表1)。基于两种精子DNA含量的差异,X精子经DNA荧光染料(Hoechast33342)染色后发出更强的蓝色荧光,将荧光信号转化为电脉冲,X精子施加正电荷,Y精子施加负电荷,在电场力作用下,最终分别被收集到相应的容器中,实现分离[5-6]。
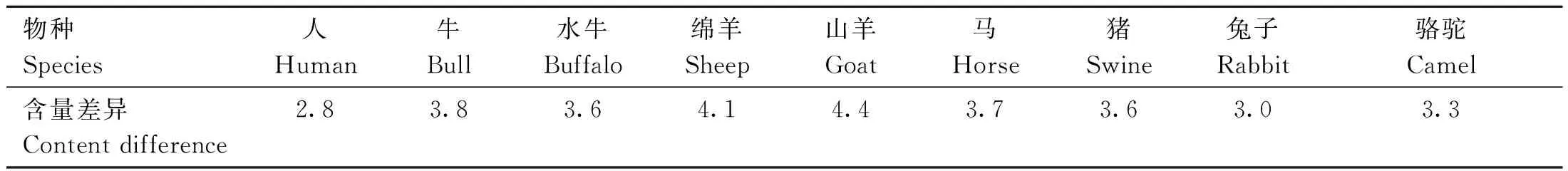
表1 不同物种X精子和Y精子DNA含量差异[7]Table 1 The difference of DNA content of X sperm and Y sperm in different species[7] %
对牛精液应用流式细胞仪进行分选,发现在输入4万个牛精子的情况下,每秒可分离8 000个精子,每小时大约可分离2 800万个精子,而每根性控冻精细管中约200万个精子,即每天仅能生产大约300根细管[8-9],可见该方法分离速度慢,产量低,且性控冻精细管所含的精子数目大约仅为常规冻精细管中精子数目的1/10[10],而且流式细胞术分选设备价格昂贵,需要专业人员操作,难以广泛应用[11-12]。该方法在分离精子的过程中,精子暴露于各种应激源[8],如荧光染料染色、激光照射、高稀释、高压以及培养基成分的变化等,会对精子造成一定程度的损害。Garner 等[2]使用流式细胞仪对分离过程中各步骤的精子存活率进行评估,发现最具有破坏性的因素是分离过程中的机械压力。自从使用流式细胞术获得第一根商业性控冻精细管以后,该技术已经进行了多项改进,例如在新一代更快、更高效的精子分选器Genesis中引入了定向喷嘴、数字处理、多头分选器和自动化[13];在精子处理、分离准备和培养基组成等方面得到的显着改进,使得性控精液的精子质量和受孕率与常规精液的差距有所减小[6,14];又如,将激光照射路径的形状从圆形光束改变为细椭圆形,带状光束使用特殊透镜,最大限度地减少精子暴露在紫外光线照射下的时间[12]。经过不断的改进和优化后,通过流式细胞术实现牛性别控制的准确率接近85%~95%[2],该方法在养牛生产中已经实现商业化发展[12]。
绵羊和山羊的X精子与Y精子的DNA含量差异分别约为4.1%和4.4%,比牛X精子和Y精子的DNA含量差异(3.8%)更大,理论上使用流式细胞术应有较好的分离效果,但实际上该方法会导致奶山羊精子的生存能力和受精能力下降[11],可见分离效果有一定的物种特异性[15],以后应进一步研究关于羊X精子和Y精子的分离参数。Garner 等[12]探究了优化流式细胞术进行性别控制所需的参数,分选指数用X精子和Y精子的DNA含量差异(%)乘以精子头部平坦轮廓的面积(μm2)来计算,分选指数表明公牛和野猪的精子非常适合使用流式细胞术进行分离,分别为131和115。然而在养猪生产中,很少用流式细胞术对精子进行分离,可能是因为猪的精子在分选过程中精子细胞膜会遭到破坏,导致其活力、受精能力等参数下降,因而难以应用于生产实践[16]。
在兼顾流式细胞术准确率的同时,今后的研究应着眼于优化分离过程,机器更新迭代,以提高分离效率[17],减少分离过程对精子的损害;充分利用X精子与Y精子DNA含量的差异性,研究确定不同动物的流式细胞仪分离参数[18],突破物种局限性,扩大应用范围。
2 免疫学分离法
流式细胞仪既可以应用于分离X精子和Y精子,又可分析X精子和Y精子之间的差异特性,比如两种精子在蛋白质组学水平上存在的差异[19]。携带X染色体和Y染色体的精子表达的基因是由各自性染色体编码的,尽管大多数基因表达产物通过细胞间桥在两种精子之间共享[20],使得X精子和Y精子合成蛋白质的数量均等,但并非所有基因产物都可以共享。通过流式细胞仪的分析检测,发现有些蛋白质仅在X精子或Y精子中积累[19],X精子与Y精子之间的这种差异表达蛋白为分离两种精子提供了理论依据[21],可用于开发性别控制的免疫学方法。免疫学分离方法的基本原理是基于识别和分离X精子与Y精子之间的蛋白差异,作为标记物,开发出特异性抗体,实现X精子与Y精子的分离[22]。
2.1 激活TLR7/8信号
精子特异性表达的toll样受体可以与特定的配体发生反应[23-24],假设在一定的条件下选择性地激活这些受体基因,X精子和Y精子在运动能力上会出现功能性差异[25-27]。Umehara等[27]从小鼠精子的RNA测序数据中发现,有492个基因在X染色体中选择性表达,其中有18个编码受体的基因,包含6个具有特定的配体(Ar、TLr8、Gpr174、TLr7、Gpr34、Eda2r)和12个具有共同配体的基因。其中TLr7和TLr8分别在小鼠精子尾部和中段表达TLR7和TLR8蛋白,二者拥有共同的配体R848,用该配体激活TLR7/8后用于培养精液,发现X精子的运动能力被选择性抑制,而Y精子不受影响,且R848处理不影响精子生存能力和顶体状态,即经R848处理后的精子仍保持受精能力,当R848撤去后,X精子活性可逐渐恢复。在分别添加R848和R837(TLR7的特定激活剂)的奶山羊精液中,检测发现X精子的ATP水平随着时间的延长逐渐下降,且R848处理后的精子其ATP水平低于R837处理组。ATP的产生受线粒体内三羧酸(TCA)循环和β-氧化以及细胞质中糖酵解的调节[27]。因此,Umehara等[27]跟踪了精子的线粒体活性和糖酵解途径中限速酶的活性,发现在精子中段表达的TLR8,其定位于线粒体,被R848激活后直接抑制线粒体活性,而位于精子尾部的TLR7被R848或R837激活后仅抑制糖酵解活性。既往研究表明,GSK3α/β磷酸化会降低树突状细胞中己糖激酶活性,降低ATP水平[25,28]。Umehara等[27]继续检测经R848处理后精子的GSK3α/β磷酸化水平,发现该磷酸化水平随处理时间的增加而上升,证明激活TLR7/8信号,通过GSK3α/β磷酸化抑制糖酵解过程中关键酶(己糖激酶)活性,导致ATP产生减少,X精子运动速度下降。
利用TLR7/8在小鼠X精子上的特异性表达分离X精子和Y精子的机制,为动物性别控制技术提供了一种新方法。研究人员用该方法进行了奶山羊[15]和肉牛[29]的精子分离,结果与小鼠试验一致。精子依靠细胞间信号转导系统复杂的相互作用,形成一个信号通路网参与介导精子的运动[30]。在Zhu等[31]和Umehara等[27,32]研究的抑制机制基础上,Ren 等[15]和Wen 等[29]分别对奶山羊和秦川牛精子的PI3Ks(一种脂质激酶家族)和AKT(PI3K的下游标靶蛋白)的磷酸化水平进行分析,综合得出结论:即TLR7/8的激活剂(R848)通过TRAF6/PI3K/GSK3α/β磷酸化和TRAF6/NFκB磷酸化路径,影响糖酵解活性和ATP的产生,进而选择性抑制X精子的运动能力,而Y精子运动速度不受影响。Umehara等[27]在小鼠试验中使用的精子是在附睾收集的新鲜精液,在公牛试验[32]中使用的是解冻后的精子,其细胞膜已部分受损,对R848的渗透性可能与新鲜精子不同,因此在处理新鲜精子时,需要改变培养基中的代谢底物,以及R848的浓度和处理周期[32]。在秦川牛[29]和关中奶山羊[15]试验中,其R848的处理水平与解冻精子有所不同,成功分离新鲜精子。TLr7/8基因在哺乳动物X染色体上的表达高度保守[33],因此使用R848激活TLR7/8信号通路分离X精子和Y精子有望成为一种新型的,操作简单的性控技术[34](图1)。
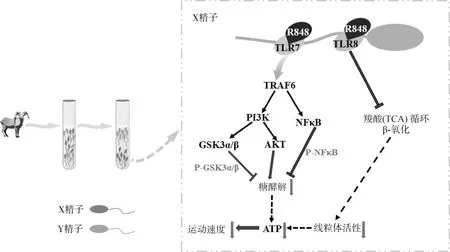
图1 激活TLR7/8信号抑制X精子运动能力的作用机制[15, 27, 29]Fig.1 Activation of TLR7/8 signal inhibits X sperm motility[15, 27, 29]
2.2 其他差异蛋白
一般认为成熟精子不能进行转录、翻译以及蛋白质合成[35],因而这些细胞非常适合进行蛋白质组学分析,通过直接比较细胞中的蛋白质水平,识别出导致细胞之间差异的标记物[20]。X精子或Y精子中具有特异性的细胞表面抗原,可作为分离精子的候选标记物。早期确定的精子细胞表面的HY特异性抗原能使Y精子失活[25],然而据Yadav等[21,36]研究发现,HY抗原还存在于X精子细胞表面,以及红细胞和减数分裂前生殖细胞中,因此HY抗原不能特异性结合携带Y染色体的精子。性别决定区Y(SRY)是一个特异性定位在Y染色体上的无内含子基因,通过SRY产生的抗体可以将携带Y染色体的精子与携带X染色体的精子分开,目前已经尝试开发针对重组SRY蛋白的抗体[36]。Soleymani等[37]开发了山羊SRY蛋白多克隆抗体(抗rbSRY),通过使用性控精子检验山羊抗rbSRYpAb的特异性,结果表明该抗体特异性结合Y精子。同时,针对公牛精液,也制备了针对牛SRY蛋白的单克隆抗体抗rbSRYmAb[38],证实含有SRY基因的Y染色体与mAbSRY特异结合。以上研究证明,SRY在Y染色体上特异性表达,可用于分离X精子和Y精子,但此试验并未跟踪洗脱后精子的受孕率数据,因此利用SRY分离精子的准确性还有待深入研究。Chowdhury 等[39]开发了一种针对Y精子的单克隆抗体WholeMom,此抗体能特异性结合在携带Y染色体的精子头部,发生头对头凝集,抑制运动能力,而携带X染色体的精子自由运动,但该试验样本数较少,因此WholeMom分离的适用性和稳定性还有待验证。
基因的差异表达导致X精子和Y精子的表型变异[21],Chen等[40]使用双向电泳结合质谱的方法,分析鉴定出42种蛋白质在X精子和Y精子中差异表达,其中牛心脏细胞色素c氧化酶在完全氧化状态下的锌离子结合结构(2EIN_R)仅在X精子中表达。差异蛋白与能量代谢、抗逆性、细胞骨架组成等密切相关,造成X精子和Y精子的表型不同。De等[41]使用液相色谱结合质谱的方法对X精子和Y精子进行蛋白质组学研究,发现X精子细胞产生更高水平的3-磷酸甘油醛脱氢酶。Scott等[42]使用数据独立采集的质谱法对精液中的蛋白质进行提取和分析,发现在X精子中,细胞色素C氧化酶亚基2(COX2)、β型乙酰辅酶A羧化酶(ACACB)等含量更为丰富;Y精子中含有更多有利于精子运动的DNAI2蛋白,因此携带Y染色体的精子比携带X染色体的精子运动速度更快。张洁等[43]使用高效液相色谱仪和质谱仪分析安格斯牛精子的蛋白质谱,发现在X精子中表达上调的蛋白质多与氧化磷酸化途径密切相关,而在Y精子中表达上调的蛋白质主要参与各种氨基酸分解代谢。以上蛋白质组学研究发现的X精子与Y精子之间的差异表达蛋白多与应激损伤、细胞骨架结构和能量代谢有关,这些差异进而可影响两种精子的运动能力。X精子中与能量代谢有关的差异蛋白,如3-羟基异丁酸脱氢酶(HIBADH)和线粒体异柠檬酸脱氢酶α亚基(IDH3A)促进电子传递与ATP合成相耦联[40],而牛心脏细胞色素c氧化酶在完全氧化状态下的锌离子结合结构2EIN_R对 ATP合成和细胞色素氧化酶血红素a起抑制作用[40],使X精子的运动速度降低;此外,X精子中高表达的蛋白质多与应激损伤有关[42],如诱导因子线粒体NADH脱氢酶(泛醌)铁硫蛋白(7NDUFS7)、NADH 脱氢酶[43]κβ1亚基复合物底物10(NDUFB10)会引起氧化应激损伤,ATP合酶耦联因子(ATP5PF)、ATP合酶亚基e (ATP5ME)在X精子中高表达导致ATP生成过多,引起一氧化氮(NO)激增,影响X精子的运动。而Y精子中存在谷胱甘肽合成酶(GSS)、谷胱甘肽S-转移酶(GSTZ1)等许多抗氧化酶,可防止应激损伤(表2、表3)。

表2 Y精子中高表达蛋白及其作用Table 2 The role of highly expressed proteins in Y-sperm

表3 X精子中高表达蛋白及其作用Table 3 The role of highly expressed proteins in X-sperm
质膜蛋白对于细胞黏附、免疫、精子获能、受精等过程十分重要[44],因此筛选X精子和Y精子细胞表面这一亚细胞结构的差异蛋白是实现免疫学分离的潜在方向。李淑芳[45]使用LC-MS/MS分别对奶牛和奶山羊的精子质膜蛋白进行鉴定分析,发现奶牛X精子和Y精子的膜差异蛋白主要参与精子运动、能量代谢以及有性生殖过程,而奶山羊精子的膜差异蛋白主要富集在粘附连接、疾病以及细胞凋亡等通路。Shen等[46]对奶牛X精子和Y精子膜表面进行蛋白质组学研究,发现X精子中解聚蛋白(DSTN)、肌动蛋白素(CFL1)、细胞周期蛋白依赖性激酶1(CDK1)等一系列与氧化应激诱导细胞衰老和凋亡过程相关的蛋白表达较多,推测X精子的免疫敏感性可能高于Y精子,同时X精子可能具有较强的超激活状态,与免疫敏感性协同作用导致细胞衰老或凋亡加速,使其寿命比Y精子短。跨膜结构预测、亚细胞定位和Western blotting验证结果表明,与其它差异表达蛋白相比,X精子中高表达的CLRN3蛋白和Y精子中高表达的SAMP1蛋白最有可能用作X精子和Y精子细胞表面的特异性候选抗原。Laxmivandana等[47]使用percoll梯度分离出驼峰牛精子的质膜部分,并经LC-MS/MS检测,发现Y精子中大量存在支持精子获能和精子运动速度的蛋白质,而X精子中存在较多与结构分子活性相关的蛋白质(表4)。

表4 X精子和Y精子质膜差异蛋白质Table 4 Differentially expressed plasma membrane proteins between X-sperm and Y-sperm
综上所述,基于X精子和Y精子及其亚细胞区域的蛋白质组学分析结果,发现重组SRY蛋白的抗体[37-38]和亚细胞区域发现的特异性候选抗原SAMP1、CLRN3[46],以及Chen 等[40]发现在X精子中特异表达的2EIN_R蛋白可作为新的生物标志物,用于分离X精子和Y精子[20],但需要进一步验证。激活TLR7/8信号分选技术已在小样本的关中奶山羊[15]和秦川牛[29]上取得了良好的分离效果,有望应用于生产实践,成为继流式细胞仪之后的候选技术。
3 pH分离
在不同pH条件下,哺乳动物X精子和Y精子的活力存在差异[48-49]。Muehleis和Long[50]将兔子精液稀释并培养在pH不同的缓冲液中,用该混合液对雌兔进行授精,检测发现后代性别比例发生明显改变。将人的精子置于pH不同的稀释液中培养一段时间后,上层精液中X精子和Y精子比例发生变化[48,51]。He等[11]将奶山羊的精液在pH为6.2下培养,上层精液中X精子所占百分比为(67.24±2.61)%;在pH为7.4下培养,上层精液中Y精子的比例为(69.53±3.04%);而当pH低于6.2(如pH=5.8)或高于7.4(如pH=7.8)时,X精子和Y精子在上层精液的比例降低。pH与精子活力直接相关,精子在碱性条件下培养时其动力学参数、膜完整性、线粒体活性更高[52-53]。且精子运动受ATP水平调节[27],研究表明ATP产生与GSK3α/β磷酸化和NFκB活化有关[15,27,29],He等[54]在pH为7.4的稀释液中培养奶山羊精子,发现精子NFκB和GSK3α/β磷酸化水平升高,影响X精子的线粒体活性和摄取葡萄糖的能力,从而降低X精子的活力,使X精子有效富集在下层。目前,这种分离方法仅在小规模奶山羊进行试验,还需多方面深入研究,弥补奶山羊性控技术在畜牧生产实践的空缺。
4 微流体和纳米技术
Zeta电位是指固体和液体之间形成的膜电荷。Wongtawan等[55]研究发现,Y精子和X精子分别是-16 mV和-20 mV的Zeta电位,此差异影响两种精子在静电场下的流动性[56-57],基于此原理,可用于开发磁性纳米颗粒和微流控介电泳芯片。磁性纳米颗粒可与Y精子结合形成复合物[56],该复合物可被磁铁吸附,实现分离;微流控介电泳芯片在不使用化学标记的情况下,通过非均匀电场可对细胞进行分类,生物医学领域中成功对循环肿瘤细胞、红细胞和血小板实现分离[58-60]。
金纳米颗粒通常需要与具有特定功能的生物分子发生作用,从而产生金纳米颗粒生物耦联物[61],Gamrad等[62]研究了牛精液中Y染色体特异性的三联体序列,利用三聚体形成的寡核苷酸(TFOs)作为配体,杂交获得纳米耦联物,可鉴定携带Y染色体的精子,为分离精子提供一种可行的方法。Domínguez等[57]使用磁性纳米颗粒(MNP)分离驴的精液,根据精子Zeta电位的差异,Y精子更易与MNP结合形成复合物。在电场力作用下,该复合物被拉向试管内壁,X精子仍悬浮在培养基中,可被收集。Wongtawan等[63]提出使用基于微流控介电泳的芯片作为分离牛精子的新方法。电解质电泳时,附着在电极上的精子称为正DEP(pDEP),远离电极的精子为负DEP(nDEP)。精子表现为pDEP或nDEP取决于施加的电位和频率[55,64],pDEP精子附着在电极,而nDEP精子漂浮在溶液中,据此可分离X精子和Y精子。Wongtawan等[63]发现大多数Y精子对频率变化较为敏感,在相同电压条件下,当施加最低频率(1 MHz)时,Y精子的pDEP比例较高;当使用最高频率(20 MHz)时,X精子的pDEP比例较高;而X精子对电压变化更敏感,增大电压,X精子pDEP比例明显增多。X精子和Y精子的pDEP比例差异最大的条件为4 V,1 MHz和8 V,20 MHz,在此条件下可分别收集到X精子与Y精子。但该结果存在个体差异,分选效率与分选周期、流速、电压和频率等有关,使用的缓冲液同样会影响精子质量。Quelhas等[65]讨论了免疫学方法在性别鉴定领域的重要性,强调可将免疫学方法和磁激活细胞分选技术相结合,免疫捕获所需精子。Sringarm等[66]使用Y精子的特异性单克隆抗体scFV耦联磁珠(PY磁珠)分离X精子和Y精子,PY磁珠选择性结合Y精子后被强钕磁铁所捕获,X精子可单独收集,实现分离。为了增大X精子富集比例,提高分离效率,Phiphattanaphiphop 等[56]在抗体耦联磁珠的方法之上,提出采用多层碳纳米管(MWCNTs)微流控装置分离奶山羊精子。精液与单克隆抗体耦联磁珠在试管中结合后,送入微流控芯片,与单抗抗体耦联的磁珠带正电荷,可附着在Y精子上,并将Y精子移动至负极,之后X精子在微通道层流的作用下移动至正极被收集。
5 总 结
以上X精子和Y精子分离方法在不同物种应用效果的分析比较结果如表5所示。李雪梅等[67]收集的荷斯坦奶牛的授精数据中,173头青年母牛和200头成年母牛使用性控冻精配种的产母犊率平均为(89.89±1.13)%。奶山羊试验[15]使用激活TLR7/8信号,得到的X精子占比(80.30±2.91)%,将X精子用于体外受精后,其中雌性胚胎占比为(80.52±6.75)%。在秦川牛精液的分离[29]中,得到下层X精子占比(72.5±2.12)%,但该研究人员未进行体外受精观察后代胚胎比例。日本黑牛试验[32]中,经R848处理的下层沉淀物中X精子占比约86.2%,用于体外受精后雌性胚胎占比为(84.2±5.3)%。Huang等[68]使用含R848的弱碱性(pH=7.4)稀释液培养奶山羊精液,得到X精子在下层富集达(85.57±3.27)%,体外受精得到的雌性胚胎比例为(83.25±2.77)%,人工授精后雌性后代占比约62.79%。He等[11]将在pH=6.2的稀释液中收集的X精子用于体外受精,经鉴定得到的雌性胚胎占比约(66.67±0.05)%。Sringarm等[66]使用Y-scFV抗体与磁珠耦联,上层X精子占比高达82.65%;Phiphattanaphiphop等[56]使用单克隆抗体耦联磁珠与精子在微流体系统中分选,Y精子的分离率约80.12%,通过该技术分离得到的精子用于体外受精的研究较少,暂时无法确定其后代比例。以上数据表明,流式细胞分离法的应用效果最好,是目前发展较为成熟的性控技术;在小样本试验中,TLR7/8信号激活分离精子的方法其应用效果仅次于流式细胞术,有望成为流式细胞术的候选技术。
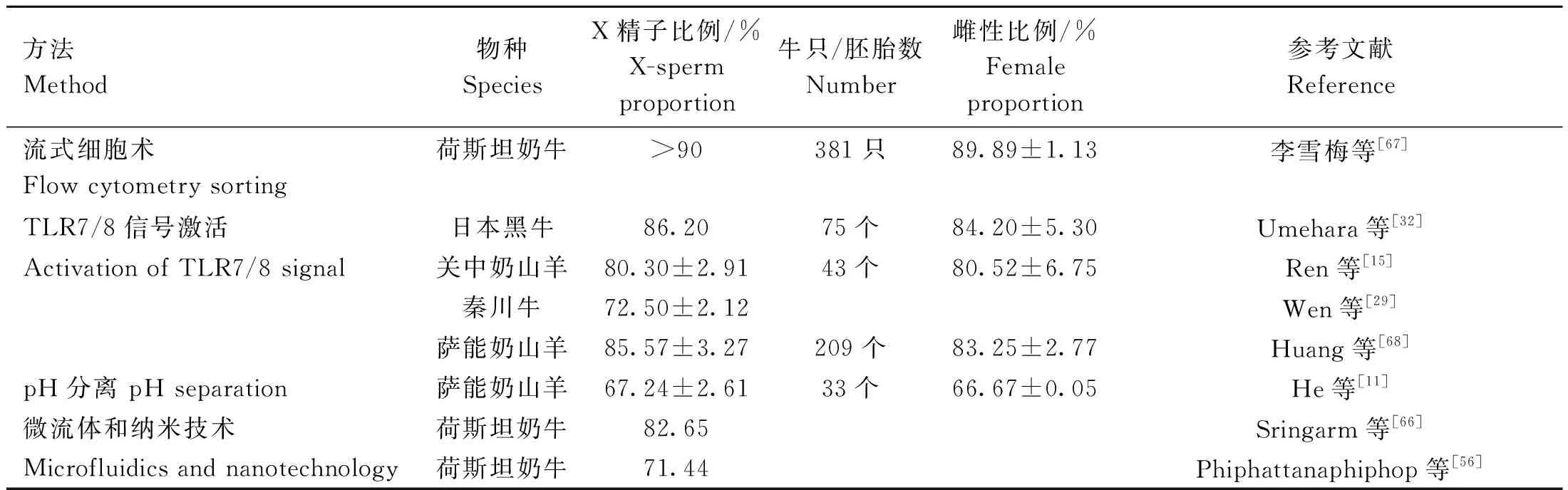
表5 X精子和Y精子分离技术应用效果对比Table 5 Comparison of application effect of X-sperm and Y-sperm separation techniques
6 展 望
随着分子生物学和细胞生物学的发展,通过分离X精子和Y精子,性别控制技术可以显着提高雌性繁殖效率,增加生产效益。迄今为止,流式细胞分离法是唯一有效实现性别控制的商业化方法,虽然在分选程序上对精液品质有一定的影响,但随着研究的不断深入,分离过程不断得到优化,对精子的损害也有所减少。新型的性控技术目前尚处于试验阶段,有待进一步完善分选体系。其中免疫学方法较为简单且易操作,激活TLR7/8信号分选技术已在小样本的关中奶山羊和秦川牛上取得了良好的分离效果,有望应用于生产实践,同时随着蛋白质组学研究的不断深入,可进一步验证2EIN_R、CLRN3、SAMP1等差异表达蛋白作为生物标记物分离X精子和Y精子的可行性,发展免疫学分离方法,以期应用于性控精液生产。



