宋 军,朱红倩,李 斓,肖仕珊,黄竹筠,贺 远
(1贵州省人民医院血液科,贵州贵阳 550002)
染色体t(9;22)及其形成的BCR/ABL融合基因,被认为是慢性髓细胞白血病(chronic myeloid leukemia,CML)的特征性遗传学标志。然而,在CML发生发展过程中,患者往往在原有遗传学异常的基础上出现其他附加染色体的异常。这种新出现的附加染色体异常提示病情的恶化及预后不良[1-3]。因此,为探讨附加染色体发生频率、类型、与治疗及预后的相关性,本研究采用染色体G显带检测收集CML伴附加染色体异常的CML患者73例,对于+8染色体异常的患者,我们还采用间期荧光原位杂交(I-FISH)技术进行了复测,以探讨这些附加染色体在CML疾病演进中的意义。
1 资料与方法
1.1 临床资料 收集2005年7月至2012年7月我院及南方医院住院、门诊CML伴附加染色体异常的患者73例,所有患者的诊断及分期均按照《血液病的诊断和疗效标准》进行。其中男性51例,女性22例,年龄14~75岁,平均年龄35.9岁。慢性期24例、加速期11例、急变期38例。所有标本均取自患者骨髓。
1.2 细胞遗传学分析 直接培养法和短期培养法制备骨髓细胞染色体,常规G显带,按ISCN1995标准进行核型分析。
1.3 间期荧光原位杂交(I-FISH) 采用美国Vysis公司的SpectrumOrange荧光素直接标记8号染色体着丝粒的DNA探针。按试剂盒提供的间期荧光原位杂交操作说明进行标本处理、变性、杂交、杂交后洗脱等操作。在Nikon E 600荧光显微镜下观察杂交信号;通过COHU高分辨CCD进行图像摄取,用Macprob4.0荧光图像处理系统(英国PSI公司)进行图像分析;每个红色荧光信号代表1条8号染色体;每份标本计数500个细胞。
1.4 FISH检查+8染色体及c-myc基因 伴+8的患者以及全部急变期患者使用8号染色体着丝粒探针进行了FISH检查。G显带出现+8的16例患者采用FISH检测均为阳性,比例为23%~67%。另有1例急变期患者染色体核型为46,XY,t(5;8)t(9;22),FISH检测+8阳性细胞比例达到52%。因此FISH检测+8阳性共17例(约占总数的23.28%),并对这17例患者进行了c-myc基因检查,均未检测到扩增信号。
1.5 治疗方案 随诊时间11月至52月不等,中位随诊时间为25月。羟基脲联合干扰素治疗组:共计33例。包括伴+8的患者17例;伴t(v;22)的患者加速期2例,急变期1例。伊马替尼治疗组:共计31例,慢性期30例,加速期1例。其中伴有t(v;22)的15例,均处于慢性期,BCR-ABL融合基因呈阴性。伴+8的慢性期患者1例,接受伊马替尼治疗11个月,目前处于慢性期。其余15例为伴其他附加染色体的患者。其余9例失访。
2 结果
73例伴附加染色体异常的CML患者的核型分析结果(见表1)。
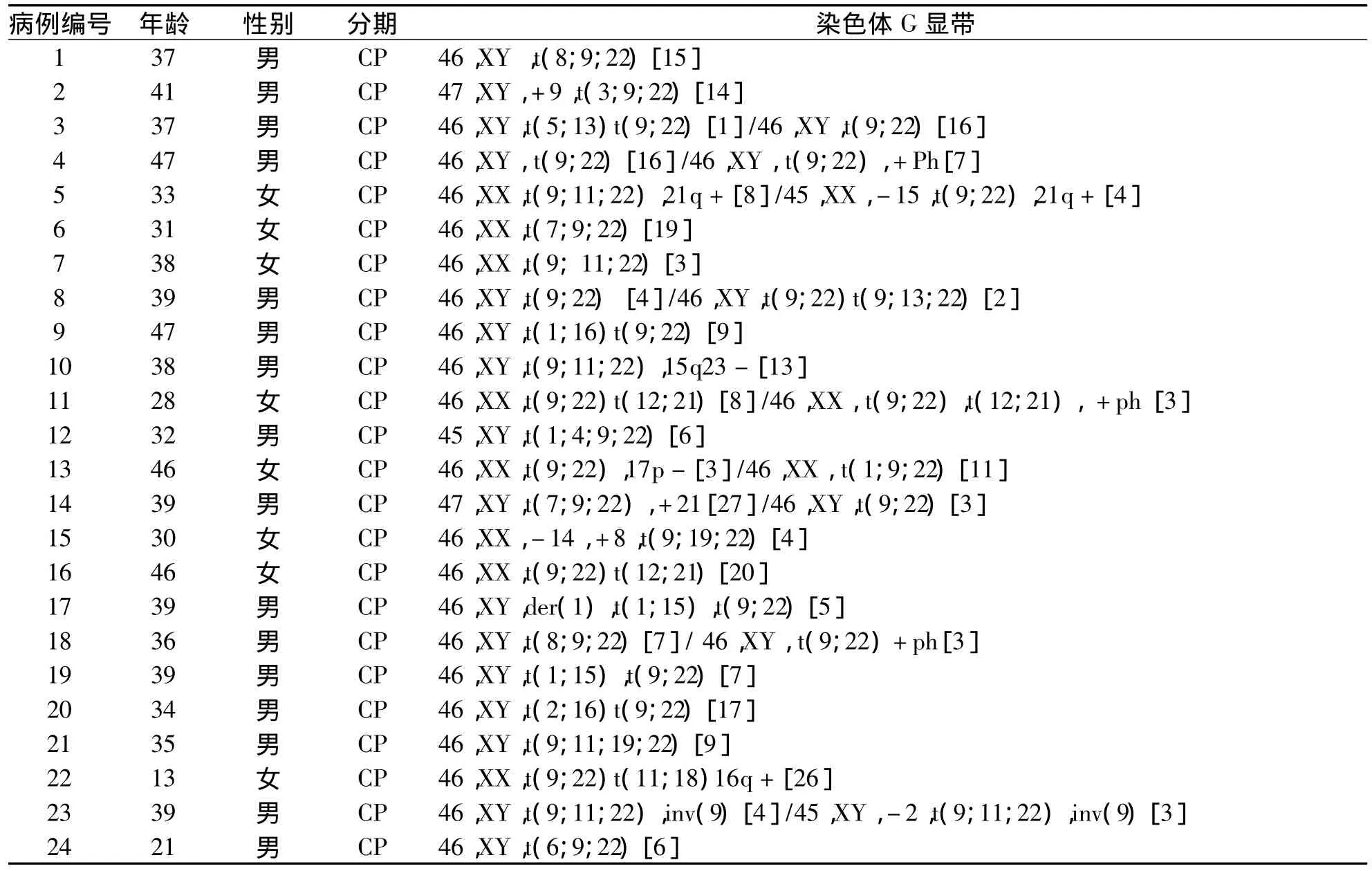
表1 73例CML患者的附加染色体检测结果
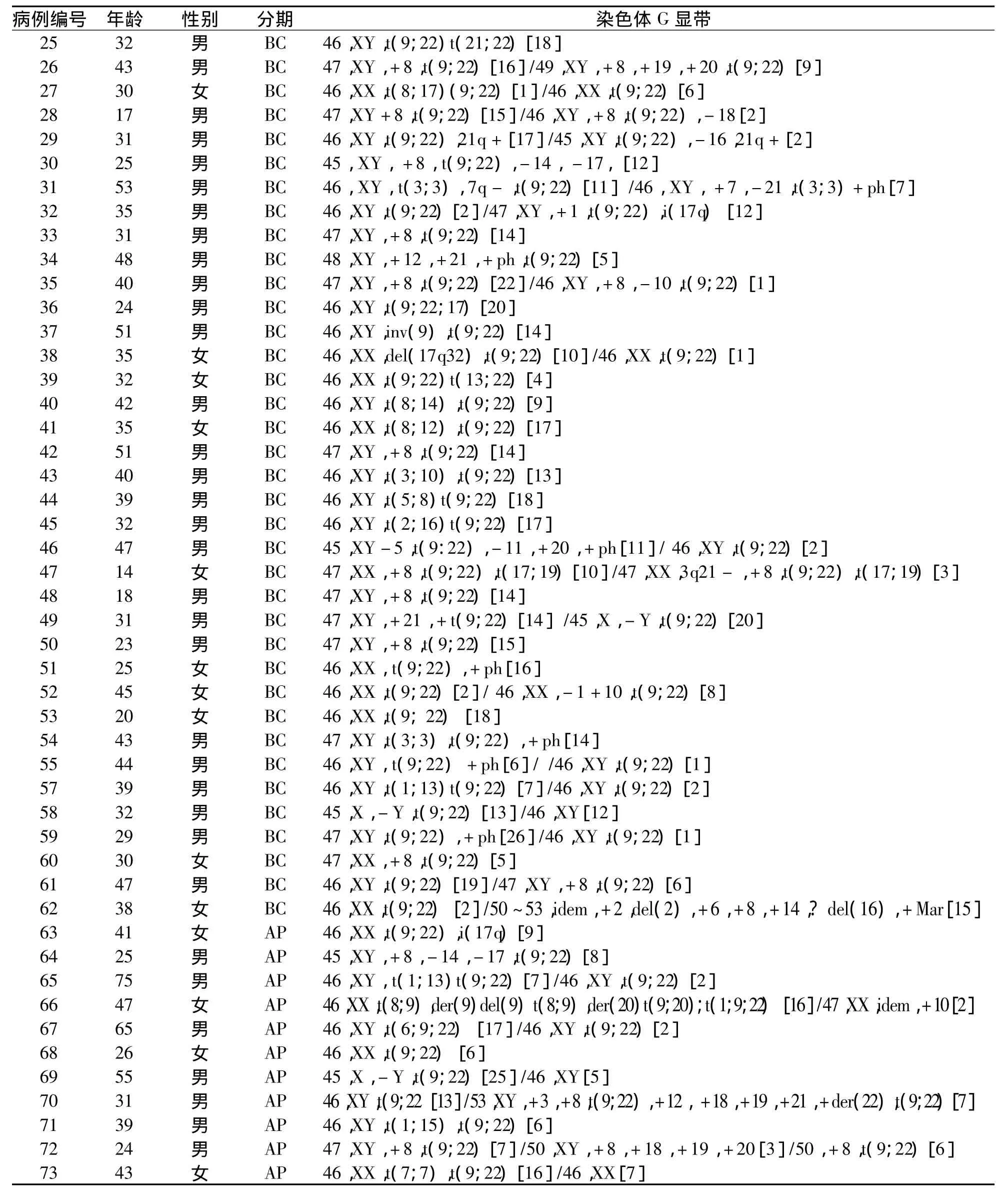
(续表)
73例CML患者中常见的附加染色体有+8、+Ph、+21、i(17q)以及 t(v;22),见表 2。另外伴罕见附加染色体24例,如 -Y、t(3;9)、t(7;7)等。
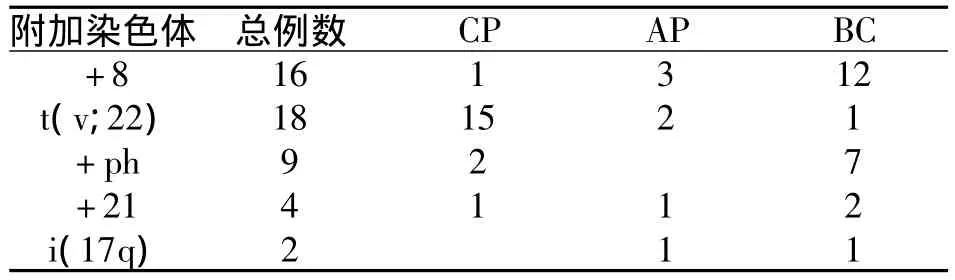
表2 伴常见附加染色体CML患者与分期
3 讨论
白血病的发生、发展伴随着大量非随机性染色体异常,急变期是CML晚期阶段,疗效差,存活期短。当前的证据表明:Ph染色体,即t(9;22)(q34;q11)以及其相应产物BCR-ABL融合基因,作为一个获得性基因不稳定性的结果,也可导致持续获得附加染色体异常和基因突变,因而CML疾病可进展至加速期和急变期[3-5]。近10% ~12%CML慢性期患者在诊断时伴有附加染色体异常,包括附加易位、Y染色体缺失 (-Y)、以及染色体数目增多等[6]。 +8,i(17q),+Ph 在 CML 疾病进展过程中常出现,但是以不同的组合方式出现。其中附加染色体以+8最为常见,它既可作为一个单独的染色体畸变出现,也可伴随其它染色体异常同时出现,并与白血病的临床表现、分型、演进和预后密切相关。
CML各个时期均可发现+8染色体异常,尤其在急变过程中多见。CML患者在病程进行中出现+8常提示病情的恶化。在本文+8共16例,约占21.9%,以加速期和急变期为主,这也印证了+8的出现提示疾病预后不佳。国外曾有研究[7]用多色FISH和特殊部位FISH探针研究了13例伴+8异常的AML患者、MDS和CML患者,结果没有发现8号染色体特定基因c-myc的重排和隐含融合基因的形成。在本文中也未检测到c-myc基因扩增信号,与其结果一致。而Oudat等[8]检测到10例不同阶段的Ph+的CML的患者伴+8异常,并用LSI c-myc探针检测了出现+8异常时c-myc表达情况,发现c-myc表达明显增加。另外,本文中38例急变期患者均以羟基脲干扰素联合治疗后,其中+8约占23.28%(17/73)。而使用伊马替尼治疗的CML患者,仅1例出现 +8染色体异常(1/73,1.37%),因此,我们认为对于无条件使用伊马替尼而采用羟基脲联合干扰素治疗的患者,定期监测染色体异常有助于早期发现附加染色体畸变,如能在早期发现+8染色体的异常,则往往预示着患者有可能预后差,有进入加速期及急变期的可能,而此时予伊马替尼治疗,或可改善患者预后。
附加易位[t(v;22)]是以除9和22,涉及1或2个附加染色体为特征,在CML患者的发生率5%~10%。在前伊马替尼时代,附加易位被认为是预后差的标志;然而,在伊马替尼时代,这已经不再是事实。国外有大宗调查研究发现当采用伊马替尼治疗后,伴有附加易位的CML患者与那些具有经典易位的患者相比,有相似的预后[9]。本文中伴附加染色体t(v;9;22)异位的CML初诊时即采用伊马替尼治疗的患者,共15例,目前处于慢性期,BCR-ABL融合基因监测呈阴性,无疾病进展的迹象,与上述研究相似。
综上所述,附加染色体在CML确诊时出现对预后的影响是具有异质性的,而且附加的类型是非常重要的,+8异常在CML疾病提示预后差。而对于此类患者,酪氨酸激酶抑制剂如伊马替尼或异基因造血干细胞移植可改善此类伴有附加染色体异常患者的预后。
[1]Farag S S,Archer K J,Mrozek K,et al.Isolated trisomy of chromosomes 8,11,13 and 21 is an adverse prognostic factor in adults with de novo acute myeloid leukemia:results from Cancer and Leukemia Group B 8451[J].Int J Oncol,2002,21(5):1041 -1051.
[2]Bruno C,Danilo P.The biology of CML blast crisis[J].Blood,2004,103(1):4010 -4022.
[3]Jabbour E,Kantarjian H.Introduction:chronic myelogenous leukemia(CML)[J].Semin Hematol,2007,44(1 suppl 1):1-3.
[4]Hehlmann R,Hochhaus A,Baccarani M.Chronic myeloid leukaemia[J].Lancet,2007,370(9584):342 - 350.
[5]Skorski T.BCR/ABL,DNA damage and DNA repair:Implications for new treatment concepts[J].Leuk Lymphoma,2008,49(4):610 -614.
[6]Alice F,Armin L,Andreas H,et al.Impact of additional cytogenetic aberrations at diagnosis on prognosis of CML:long-term observation of 1151 patients from the randomized CML Study IV[J].Blood,2011,118(2):6760 -6768.
[7]Oudat R,Khan Z,Glassman A B,et al.Detection of trisomy 8 in philadelphia chromosome-positive CML patients using conventional cytogenetic and interphase fluorescence in situ hybridization techniques and its relation to c-myc involvement[J].Ann Clin Lab Sci,200l,31(1):68 - 74.
[8]Batanian J R,Ma E,Huang Y,et al.Co- existence of alternative forms of 8q gain in cytogenetic clones of three patients with acute myeloid leukemia,pointing to 8q22 approximately 8qter as a region of biologic significance[J].Cancer Genet Cytogenet,2001,126(1):20 -25.
[9]Giulia M,Fausto C,Simona L,et al.Variant Philadelphia translocations:molecular-cytogenetic haracterization and prognostic influence on frontline imatinib therapy,a GIMEMA Working Party on CML analysis[J].Blood,2011,117(29):6793-6800.



