肖建辉
(遵义医学院附属医院暨贵州省细胞工程重点实验室,贵州 遵义 563099)
虫草,非指虫与草,而是虫与菌,亦是虫草属Cordyceps (Frey) Link中所有真菌的统称。其中冬虫夏草Cordyceps sinensis (Berk.) Sacc.(=Ophiocordyceps sinensis)是我国传统的名贵珍稀滋补中药材,应用历史久远,颇受华人青睐。应用虫草的最早文字记载,可追溯到1300余年前唐代《月王药诊》和《藏本草》,称其“润肺、补肾”。近20余年来,虫草已成为国内外生物医药领域的热点话题[1]。
虫草菌物种丰富多样。英国CABI databases登载的虫草菌有500余种(http://www.speciesfungorum.org)。排除同物异名因素,学术界公认的虫草物种约400种[2-3],其中我国报道了近100种[4]。在这数百种虫草菌中,冬虫夏草与人参、鹿茸齐名,位居我国3大名贵滋补中药之首。遗憾的是,这种声名深刻影响了冬虫夏草资源的可持续利用。一方面该物种野生资源数量受自身生物学特性严格限制,而规模化人工栽培迄今尚未实现,供给极其有限;另一方面,人民生活水平提高及中医药历史文化影响,市场需求旺盛。从而导致近10年来冬虫夏草价格飙升,赛过黄金。更严重的是,长期以来受利益驱动,人们无序、掠夺式采挖,使本来脆弱的、冬虫夏草赖以生存的生态环境遭受毁灭性破坏,野生资源濒临枯竭[3-4],已成为制约虫草产业发展的瓶颈。冬虫夏草真的有出神入化的功效吗?现代中药化学的研究结果并无重要发现,使一些国内外学者不得不怀疑[5]。不过,作为一种食用了千余年的名贵中药,其药性是不容质疑的。也许是我们尚未发现它为什么和怎样发挥功效的科学证据,而这涉及到虫草产业的未来发展方向。目前虫草制品主要是原料级生药或一次性粗制品,而市场鲜见高技术高附加值二次性产品,虫草产业亟待转型升级。另外,冬虫夏草已成濒危物种。基于生物协同进化理论,我们是否能在400多个虫草物种中,找到冬虫夏草的替代资源或者更具研发潜力的新资源?大量的研究表明,许多虫草物种具有替代冬虫夏草潜力,它们有类似的化学成分和药理作用[4,6],乃至存在冬虫夏草不具有的新物质与新功效。
综上所述,基于让人们更好地认识虫草资源未来深度开发利用的方向,本文拟评述虫草高附加值活性物质多样性的进展,为该类资源深度开发利用提供新思路。
1 虫草活性次生代谢物的多样性
虫草菌与寄主昆虫或节肢动物的关系,寄生或共生?迄今仍存争议[7]。在长期的进化过程中,为克服入侵时寄主的天然屏障,以及逃避侵入后寄主的免疫监控,达成与寄主的生活史同步化,最终完成自身细胞增殖、分化和整个生活史。在这个过程中,生成了与细胞信号传导、应激保护相关的,具有化学结构多样、生物功能多样和作用多靶点等特点的“功能性”活性代谢物[6, 8],并彰显具创制药物的巨大潜力[6, 8-9]。近些年来,随着天然产物化学和现代色谱技术的飞速发展,人们对虫草原料或粗提物的一次性直接利用,应该逐步过度到更高层次二次性化学成分的研发,即化学成分与药理作用点对点的研究。由此,虫草次生代谢产物的研究日益成为生物医药领域研究的热点,现已报道的代谢产物主要可概括为以下几大类:
1.1 生物碱类次生代谢产物 早在1950年,Cunningham等在蛹虫草菌中分离到一种抗菌的代谢产物,定名为虫草素(cordycepin),化学名为3’-脱氧腺苷(C10H13N5O3),并发表在Nature杂志上。随后数10年来,国内外学者对虫草素的来源、生物高效合成与分离制备,人工合成与修饰、药理活性及作用机制等方面进行了系统的研究。结果表明,虫草素不仅有明显的抗菌、抗病毒和杀虫功效[10-12],还有显着的抗肿瘤作用[13],是一种广谱抗生素。遗憾的是,肌体内腺苷脱氨酶(adenosine deaminase,ADA)可使虫草素脱氨,而生成3’-脱氧次黄嘌呤核苷,活性显着降低,使其成药性受到极大挑战。所幸的是,ADA抑制剂可延缓虫草素在体内的代谢,给其临床应用带来了转机[14]。Furuya等[4]在粉被虫草中,首次发现了生物来源的Ca2+拮抗剂,命名为N6-(2-羟乙基)腺苷(C12H17N5O5, N6-(2-hydroxyethyl)adenosine)。
吡啶酮类化合物是近些年报道的一类新的活性生物碱,有一定的抗肿瘤细胞毒活性。Isaka等[15]自C. nipponica菌中分离获得N-羟基及N-甲氧基吡啶酮,命名为cordypyridones A-D(见图1)。其中N-羟基吡啶酮cordypyridones A和B(C16H23NO3)是同分异构体,均有显着抗疟原虫活性,IC50值分别是0.066、0.037 μg/mL,但其抗肿瘤细胞毒性较弱。之后,德国学者Schmidt等[16-17]在蛹虫草菌中发现了吡啶酮生物碱militarinone A(C26H37NO6)和D(C26H31NO4),以及3-酰基四胺酸(tetramic acid) militarinone B(C26H33NO5)和C (C26H33NO4,图1),并认为militarinones C、B、D是A生物代谢合成途径的中间体。细胞毒活性结果提示,militarinone D对PC-12细胞有明显的细胞毒作用,而militarinones A、B和C没有细胞毒效应或不明显。有趣的是,Cheng等[18]自虫花棒束孢Paecilomyces farinosus (异名又称Isaria farinosa)中分离获得的脱氧militarinone A(C26H37NO5, 图1),对人神经元IMR-32细胞有明显的细胞毒作用。Cheng等[19]还从该菌中分离到两个新的吡啶酮生物碱farinosone A (C25H27NO4)和B (C25H27NO5),以及吡啶酮生物合成途径的中间体farinosone C (C19H25NO5, 图1),这几个化合物对PC-12细胞均无细胞毒效应。但是,Lang 等[20]从虫花棒束孢中分离获得两个化合物,farinosone B和一个新的四胺酸(tetramic acid)衍生物paecilosetin(C22H31NO4, 图1)。它们对小鼠白血病P388细胞均有明显的细胞毒效应。近来,Che研究组[21]从冬虫夏草定殖真菌虫花棒束孢Isaria farinosa中也分离到militarinones A和B,并获得两个新的N-羟基吡啶酮militarinones E和F,两个新苯腙化合物farylhydrazones A和B,以及一个新喹唑酮化合物2-(4-hydroxybenzyl)quinazolin-4(3H)-one(见图1)。活性检测的结果提示,militarinones A和E对肺癌A549细胞有显着的抗肿瘤细胞毒活性,而militarinones B呈现抗菌活性。这与Schmidt等报道militarinones A未检测到其明显的细胞毒性不一致,可能与选择的细胞株有关。因此,militarinones A对肿瘤细胞可能存在选择毒性。
不仅虫花棒束孢含有丰富的生物碱类物质,也从其它虫草棒束孢发现许多有潜在价值的生物碱。细脚棒束孢Isaria tenuipes(又称高雄山虫草菌)是在东南亚利用比较广的一种虫草菌。Isaka研究组[22-23]先后从细脚棒束孢两个菌株中获得6个新生物碱isariotins A-F (见图1) 和一个已知化合物TK-57-164A。其中isariotins A-D带独特的双环[3.3.1]壬烷环,而isariotins E和F带有螺环或双环半缩醛。Isariotins F有良好的抗恶性疟原虫Plasmodium falciparum K1活性(IC50=5.1μM),且对乳腺癌BC细胞和肺癌NCI-H187细胞具有显着的细胞毒活性,其IC50分别为2.4和1.6μM。日本棒束孢Isaria japonica(或日本虫草C. japonica),也称叫大孢虫花,其在日本广为利用。Lee研究组[24]从该虫草菌中分离到一种新的吗啉衍生物(3R,6R)-4-甲基-6-(1-甲基乙基)-3-苯基甲基全氢化-1,4-恶嗪-2,5-二酮(C15H19NO3,图1中化合物1) 和两种已知的吗啉衍生物lateritin与bassiatin,并发现这个新的化合物能诱导人白细胞HL-60细胞凋亡。另外,Chou研究组[25]从蝉花上也分离到bassiatin,并第1次获得天然来源的bassiatin A (见图1)。
另外,Isaka研究组[26]从Cordyceps brunnearubra BCC 1395菌中获得青黄霉素类生物碱cordyformamide,可能是青黄霉素 Y2的前体物,有中等抗疟原虫活性,但无细胞毒作用。最近,Yang等[27]在发掘冬虫夏草菌抗炎的物质基础过程,分离鉴定了50次生代谢物,其中5个新化合物命名为cordysinin A, B, C, D和E (见图1),仅cordysinin A有较弱的抗炎活性。但45个已知化合物中,发现生物碱perlolyrine(1-(5-Hydroxymethyl-2-furyl)-β-carboline,C16H12N2O2)有显着的抗炎潜力。
1.2 多肽类次生代谢产物 小分子多肽是药物研发关注的热点之一,它在肌体内有清除率高、半衰期短,且毒副作用小等特点。上世纪60年代末,Hamill等 (1969) 在昆虫病原真菌球孢白僵菌Beauveria bassiana中获得一种强杀虫活性的环己缩酚,命名为肽白僵菌素(Beauvericin,C45H57N3O9, 图2)。之后,在蝉花、高雄山虫草等多种虫草菌中分离到白僵菌素[25, 28-29]。Chou研究组[25]在蝉花中还获得两种白僵菌素的衍生物beauvericins A和B。白僵菌素可作为细胞内的离子载体,而对胞内电解质与细胞稳态起调节作用[30],其还有较强的抗肿瘤活性[28,31]。白僵菌素的抗肿瘤作用机制主要涉及激活内质网中Ca2+,致Ca2+大量释放到胞浆激活细胞凋亡路径[32-33]。2000年,姜泓等从蛹虫草子实体中分离鉴定了一种虫草环肽A(cordycepeptide A,C27H41N3O5, 图2)。之后,吴立军研究组(2003)从蛹虫草培养液中分离到环(苯丙氨酸-脯氨酸)、环(亮氨酸-脯氨酸)、环(缬氨酸-脯氨酸)和环(丙氨酸-脯氨酸等数个环二肽。这几种环肽的活性未见进一步的报道。不过,该研究组从冬虫夏草培养液分离到一种环二肽,命名cordycedipeptide A(C10H17N3O3,图2),其对L-929、A375和Hela等肿瘤细胞有显着的细胞毒作用[34]。Krasnoff研究组[35]从异足蛛虫草菌C. heteropoda中分离到两个具有抗菌作用的线性七肽cicadapeptins I和II(见图2)。Rukachaisirikul等[36]从未鉴定虫草Cordyceps sp. BCC 1788菌株中分离到一种环七肽,定名为cordyheptapeptide A(C49H65N7O8,图2),其对Vero细胞有细胞毒活性。Sakakura等从棒束孢虫草中分离获得一个新的拟二肽,命名为hanasanagin(见图2),具有明显的抗氧化作用[37]。最近,Asai等[38]从C. indigotica Kobayasi & Shimizu菌培养液中分离获得了8种已知环状缩酚肽类化合物,即腐败菌素(destruxins)A, A2, B, B2和E(见图2)。
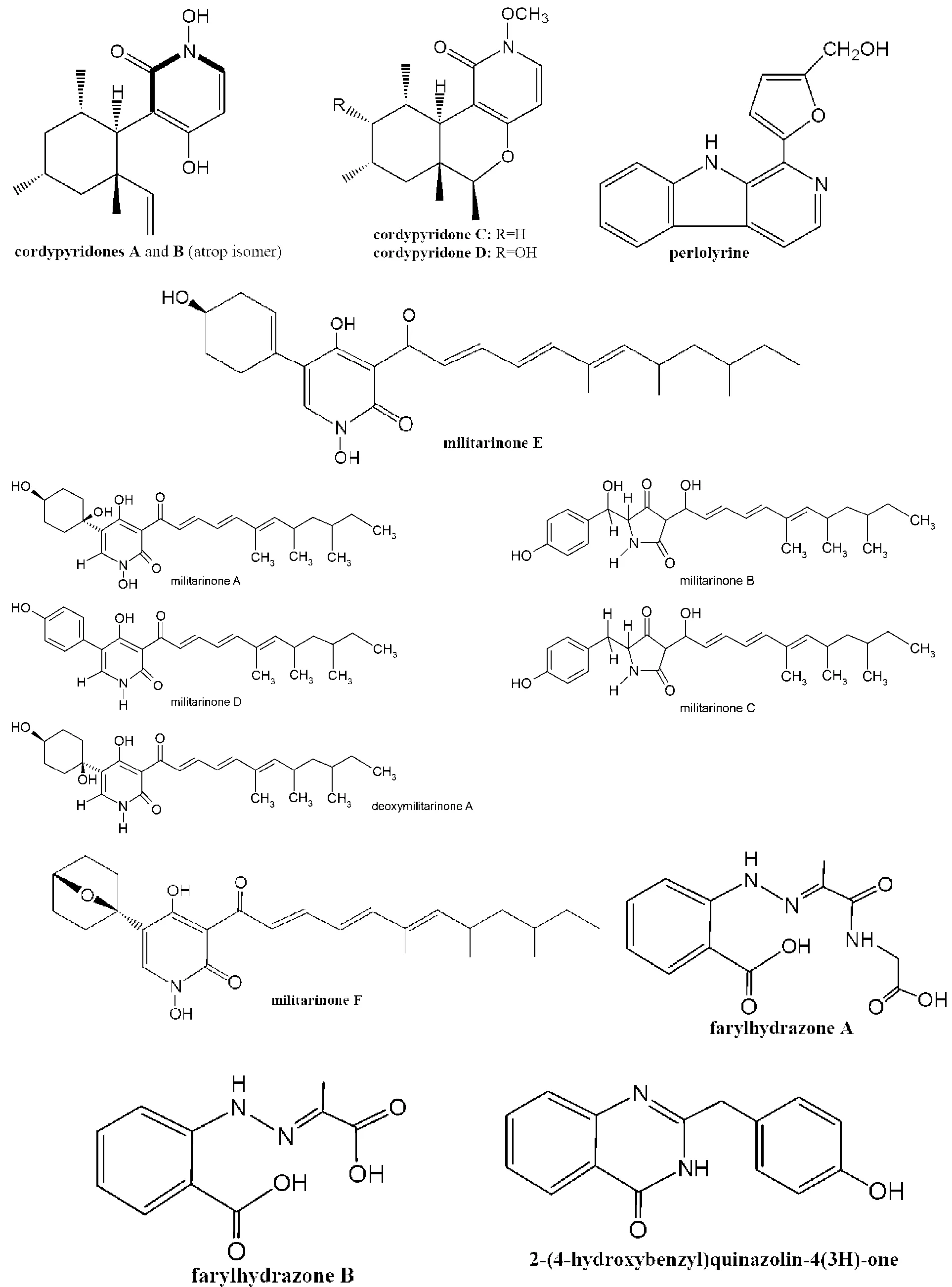
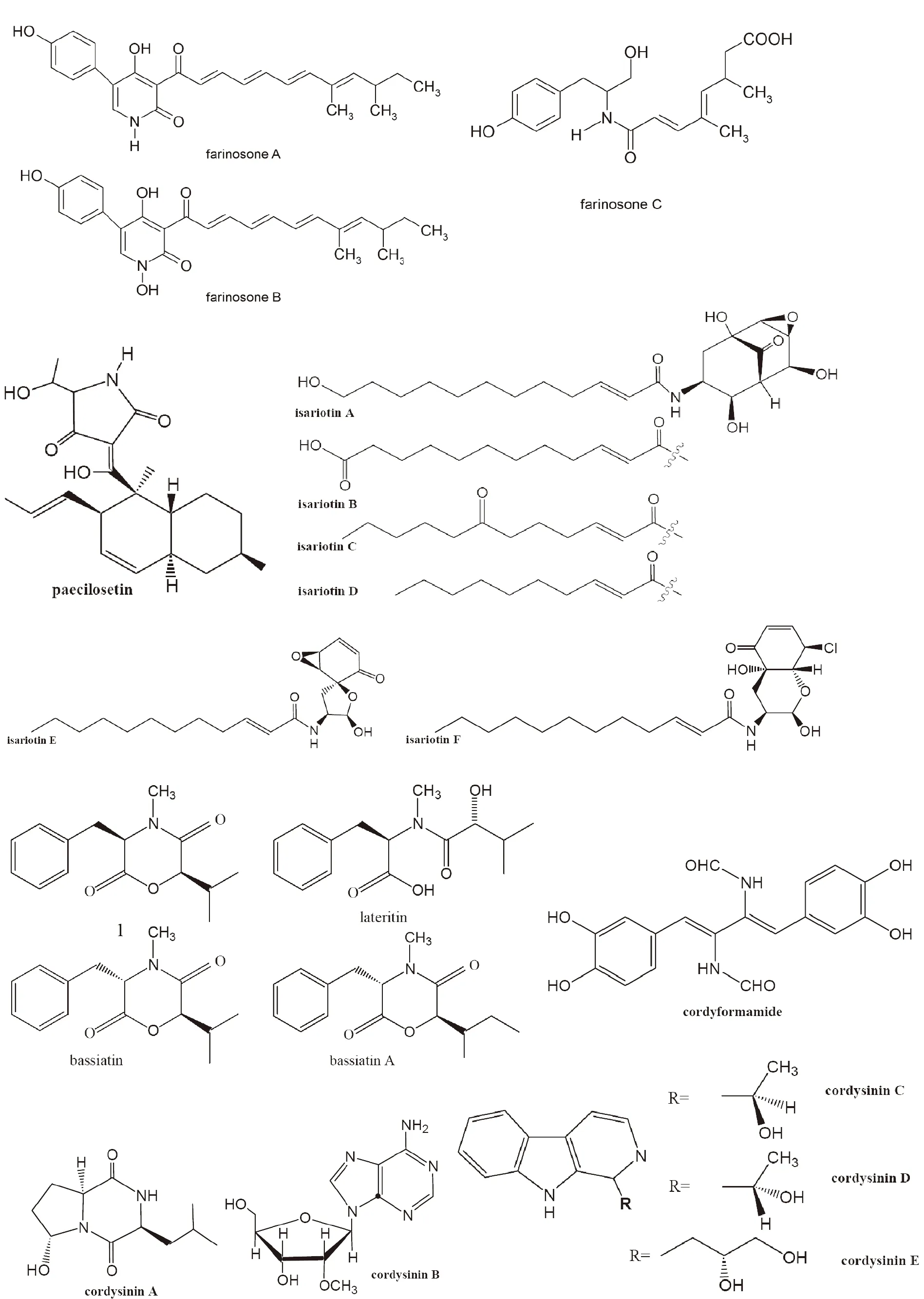
图1 虫草菌的生物碱类化合物结构图
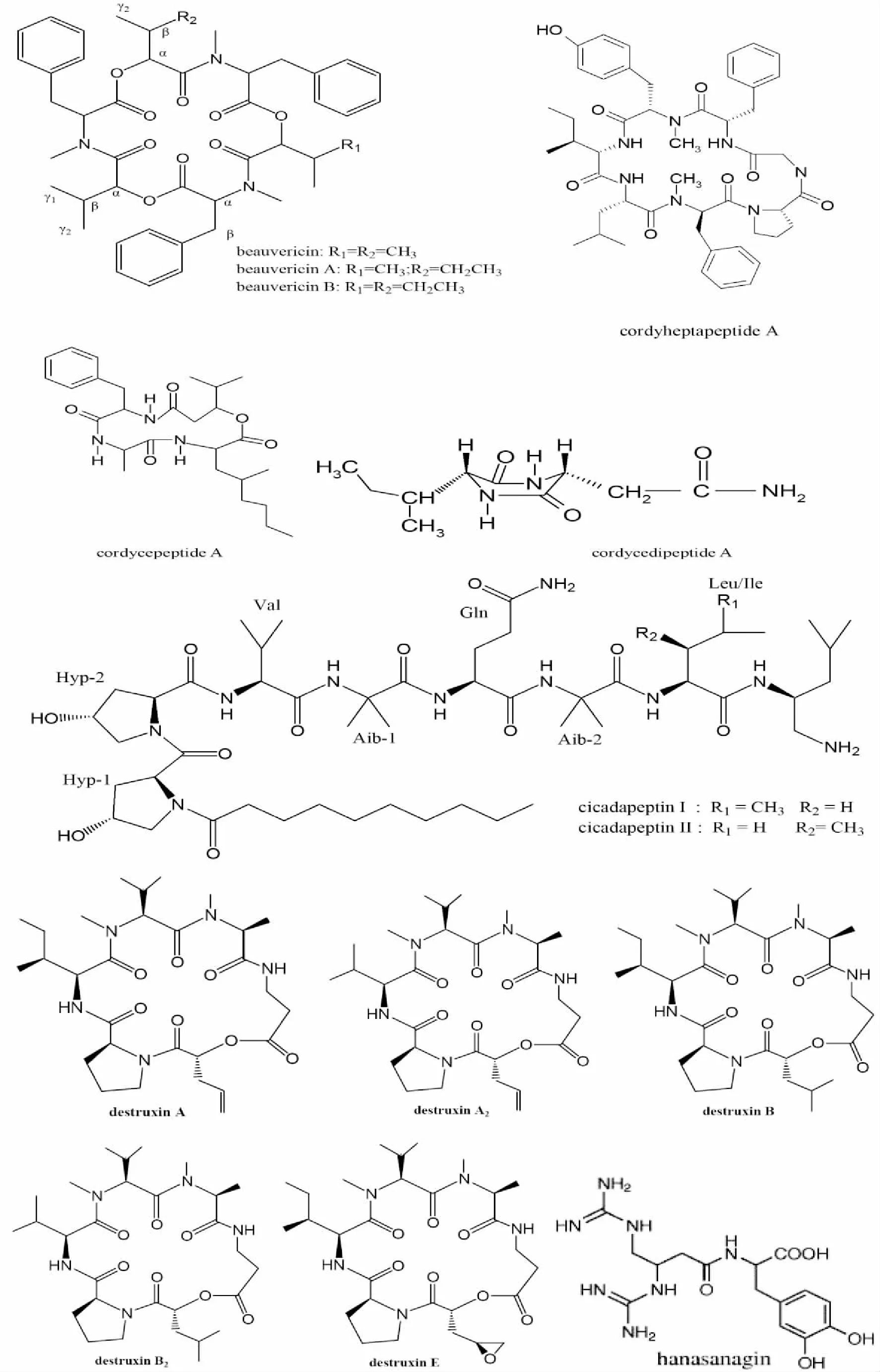
图2 虫草菌的多肽类化合物结构图
1.3 甾醇类次生代谢产物 Kuo等在1990年代初,自冬虫夏草子实体中获得两个组分CS-36-39 和CS-48-51,其对多个肿瘤细胞株具有显着细胞毒效应,进一步的化学分析提示,这个两个组分非多糖和虫草素。之后,Bok等 (1999) 在冬虫夏草菌丝体中获得两个新的抗肿瘤甾醇次生代谢物,即5α,8α-表二氧-24(R)-甲基胆甾烷-6,22-二烯-3β-D-吡喃葡萄糖(C34H54O8,图3中化合物1)和5α,6α-环氧-24(R)- 甲基胆甾烷-7,22-二烯-3β-醇(C28H44O2, 图3化合物2)。同时得到两个已知麦角甾醇衍生物 (见图3化合物3与4)。而且,其抗肿瘤药理实验结果提示,化合物1的葡萄糖配基是个增效基团,可明显提高其抗肿瘤作用。Kuo等[25]从蝉花中分离获得两个甾醇类物质,麦角甾醇及其过氧化物5α,8α-表二氧-24(R)-甲基胆甾烷-6,22-二烯-3β-醇(C28H44O3)(图3中化合物5和6),但未进行活性评价。不过,Nam等[39]对从高雄山虫草中获得的5α,8α-表二氧-24(R)-甲基胆甾烷-6,22-二烯-3β-醇进行了活性评价,发现其可抑制人胃癌SNU-1、肝癌SNU-354、结肠直肠癌SNU-C4和鼠肉瘤S180等多种肿瘤细胞增殖。最近,我们研究组从江西虫草菌中获得一种极有创制抗肿瘤新药潜力的新化合物jiangxienone(见图3中化合物7),其对不同肿瘤细胞的杀伤能力是一线抗肿瘤药物顺铂的至少6倍,且对正常细胞毒性小[40],其作用机制经由DNA损伤修复途径[41]。
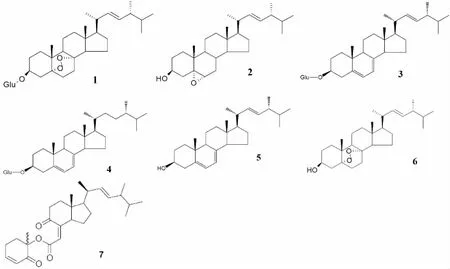
图3 虫草菌的甾醇类化合物
1.4 萜类次生代谢产物 虫草菌中含有丰富的萜类化合物。真菌毒素有一类重要的萜类化合物叫单端孢霉烯(trichothecane)。Nam等[39]在高雄山虫草菌中分离获得一个单端孢霉烯类化合物,命名为4β-乙酰氧藨镰刀菌烯-3α,15-二醇(acetoxyscirpenediol)(C17H24O6,图4化合物1),其抗肿瘤细胞毒效应是临床一线抗癌药物顺铂的4~6倍。其抗肿瘤细胞毒效应的作用机制结果提示,4β-乙酰氧藨镰刀菌烯-3α,15-二醇主要经由诱导细胞调亡途径发挥抗肿瘤作用[42]。Chung研究组[43-45]从日本棒束孢中分离鉴定了一种单端孢霉烯衍生物,4-乙酰基-12,13-环氧基-9-单端孢霉烯-3,15-二醇(见图4中化合物2)。该化合物抗癌谱广,对白血病、乳腺癌、卵巢癌、膀胱癌等多种肿瘤细胞株均有抑制效应。进一步的研究提示,它的作用机制与Caspase依赖凋亡途径有关,即通过促进胞内活性氧生成,使胞内谷胱甘肽抗氧化剂缺失,并激活Caspase-3凋亡酶,最终诱导肿瘤细胞凋亡。因此,来源虫草的单端孢霉烯具有创制抗癌药物的潜力。之后,Oshima研究组[46-48]先后从高雄山虫草菌中分离鉴定了6个新单端孢霉烯衍生物,其中paecilomycines A(C15H22O4)、B(C15H22O5)和C(C15H20O4)是带有三环结构的倍半萜(见图4),spirotenuipesines A (C15H22O4)和B(C15H22O5)是既带有三环结构又有螺环结构的倍半萜(见图4),而tenuipesine A 是带环丙烷环的新骨架单端孢霉烯。活性评价结果提示,倍半萜paecilomycine A、spirotenuipesine A和B可促使人星形细胞瘤1321N1细胞分泌神经营养因子,诱导鼠嗜铬细胞瘤PC-12细胞分化。综上,高雄山虫草称得上是生物合成新颖单端孢霉烯类化合物的细胞工厂。本项目组先后从戴氏虫草菌和江西虫草菌中分离到四环三萜化合物helvolic acid,其对多个肿瘤细胞生长均有抑制作用,尤其是对宫颈癌Hela细胞有显着的细胞毒性[49-50]。
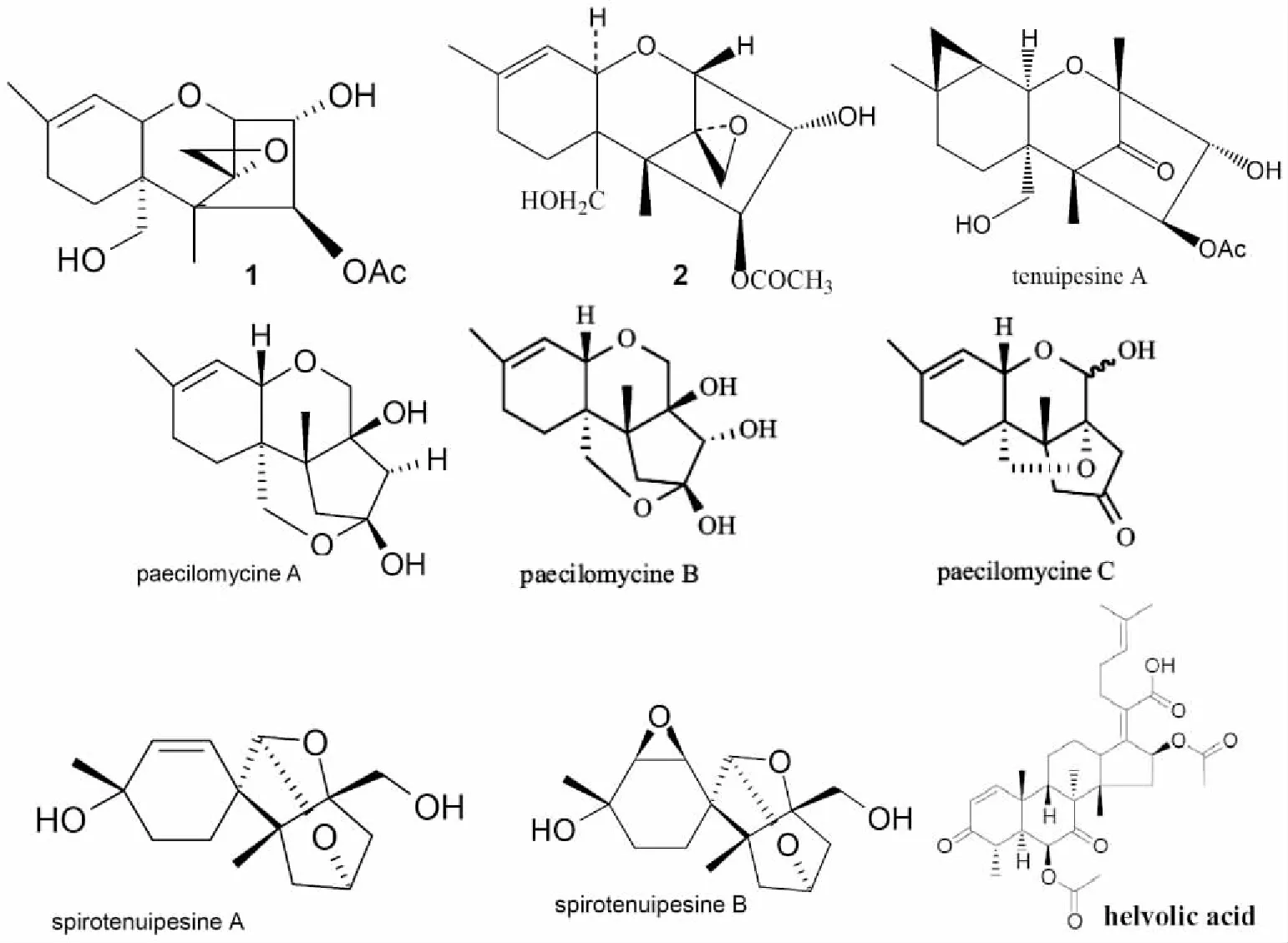
图4 虫草菌的萜类化合物结构图
1.5 聚酮类次生代谢产物 近些年来,在虫草菌中陆续发现聚酮类次生代谢产物,具有结构和生物活性多样等特点。Seephonkai等[51]从一种未鉴定的虫草菌Cordyceps sp. BCC 1681中分离到类似环庚三烯酚酮的次生代谢物,命名为cordytropolone(C9H8O4,图5)。该化合物呈现中等的抗恶性疟原虫Plasmodium falciparum K1与抗乳腺癌BC-1细胞毒活性(IC50=2.2μg/mL)。最近,Grudniewska等[52]从也一株未鉴定的虫草菌Cordyceps sp. NBRC 106954 获得了一个特殊骨架的聚酮化合物Opaliferin(见图5),其通过一个外部双键,把环戊酮和四氢呋喃链接在一起,但其功能活性尚待进一步研究。
一个不可忽视的生物现象是,真菌中许多代谢途径的次生代谢物质合成基因在常规实验室条件下并不表达。日本学者Asai研究组近几年的工作提示,表观遗传改良剂对虫草菌聚酮类次生代谢产物合成有重要影响。Asai等[53]在C. indigotica Kobayasi & Shimizu菌发酵液中分离到1个新的芳香聚酮糖苷类化合物indigotide A(C21H26O9,图5),以及1个已知的聚酮类化合物NG-393(C22H28NO7,图5)。有趣的是,在该菌培养液中加入表观遗传抑制剂5-氮杂胞苷(DNA甲基化转移酶抑制剂)后,其代谢合成另一个新的芳香聚酮糖苷类化合物indigotide B(C22H26O10,图5)。而添加另一种表观遗传改良剂软木肟酸(组蛋白脱乙酰基酶抑制剂)到该菌培养液后,不仅分离获得了indigotide A和B(见图5),还获得6种新的芳香聚酮类化合物indigotide C (C42H52O18,图5)、D(C42H52O18,图5)、E(C43H52O19,图5)和F(C15H18O5,图5),以及13-hydroxyindigotide A(C21H26O10,图5),8-O-methylindigotide B(C23H28O10)[54]。因此表观遗传改良剂对虫草菌的生物代谢合成有重要影响,将可有效唤醒编码次生代谢产物的沉默基因簇,从而使虫草菌合成一些新颖的具有潜在功效的次生活性代谢物。不过,这些新聚酮类化合物的功效迄今未见报道。该研究组[55]利用表观遗传改良剂软木肟酸处理另一个虫草菌C. annullata获得5个新聚酮类化合物annullatin A(C17H24O3,图5), B(C17H26O3,图5), C(C17H26O4,图5), D(C17H22O4,图5)和E(C12H8O3,图5),有趣的是它们具有类似四氢大麻酚结构,进一步的活性检测提示,annullatin A对大麻素受体1(CB1)和2(CB2)均有明显的拮抗活性,annullatin B是CB1的选择性拮抗剂,annullatin D则对CB2有逆拮抗活性。另外,同时加入不同类型的表观遗传改良剂对虫草菌的次生代谢产物合成有什么影响呢?为此他们在虫草菌Isaria tenuipes 生长过程同时加入组蛋白脱乙酰基酶抑制剂软木肟酸和DNA甲基化转移酶抑制剂RG-108,结果显示其极大地提高了次生代谢产物合成效率,并获得一种新骨架聚酮类化合物tenuipyrone(见图5)[56]。
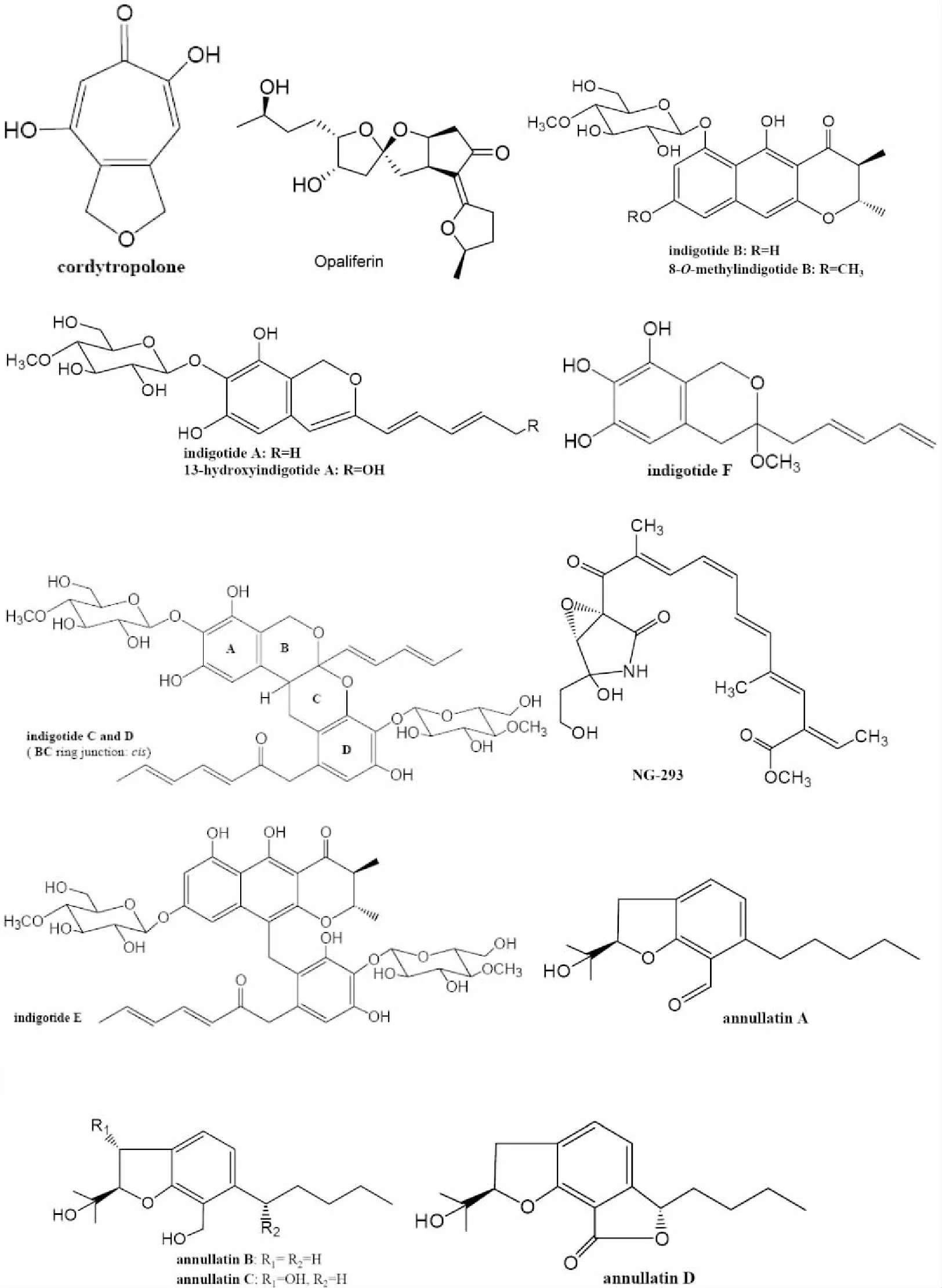
图5 虫草菌的聚酮类化合物结构图
1.6 其它次生代谢产物 虫草菌能代谢合成具有特定功能的天然萘醌、萘酚类次生代谢产物。Kittakoop等(1999)自单侧生虫草C. unilateralis获得6个萘醌类化合物,erythrostominone、deoxyerythrostominone、4-O-methyl erythro- stominone、epierythrostominol、deoxyerythrostominol和3,5,8-三羟基-6-甲氧基-2-(5-氧代-1,3-己二烯)-1,4-萘醌(见图6),均有抗疟原虫活性,且前5个化合物乳腺癌BC、鼻咽癌KB等肿瘤细胞具有一定的细胞毒效应,特别是对BC细胞成效显着。Isaka等[57]在拟蛹虫草C. pseudomilitaris 分离到11个联萘酚类(bioxanthracene)化合物(见图6化合物1-11),其中化合物1-10均具有较强的抗疟原虫活性,其IC50值在1.1~8.4μg/mL范围,化合物6、7和8对BC和KB癌细胞有一定的细胞毒活性。此外,他们还在拟蛹虫草菌中分离到cordyanhydrides A(C20H22O8)和B(C29H32O11),两个含2~3个马来酸酐的链烯酸(见图6)[58]。天然产物中带酸酐的化合物很罕见,虽然未见进一步活性评价,但这些稀有的天然产物也许为创新药物的研发提供了更多的选择。
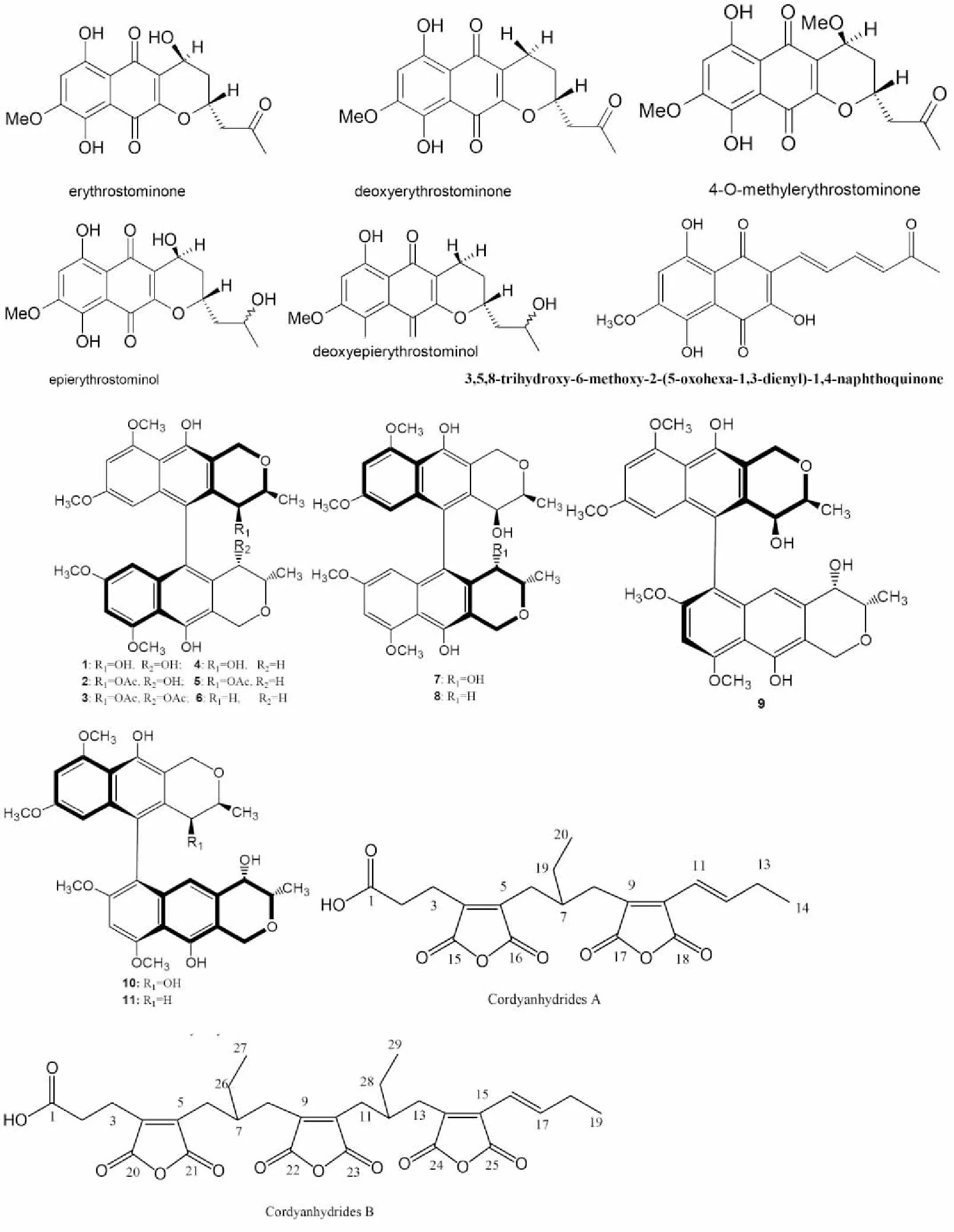
图6 虫草菌的萘醌、酚类化合物结构图
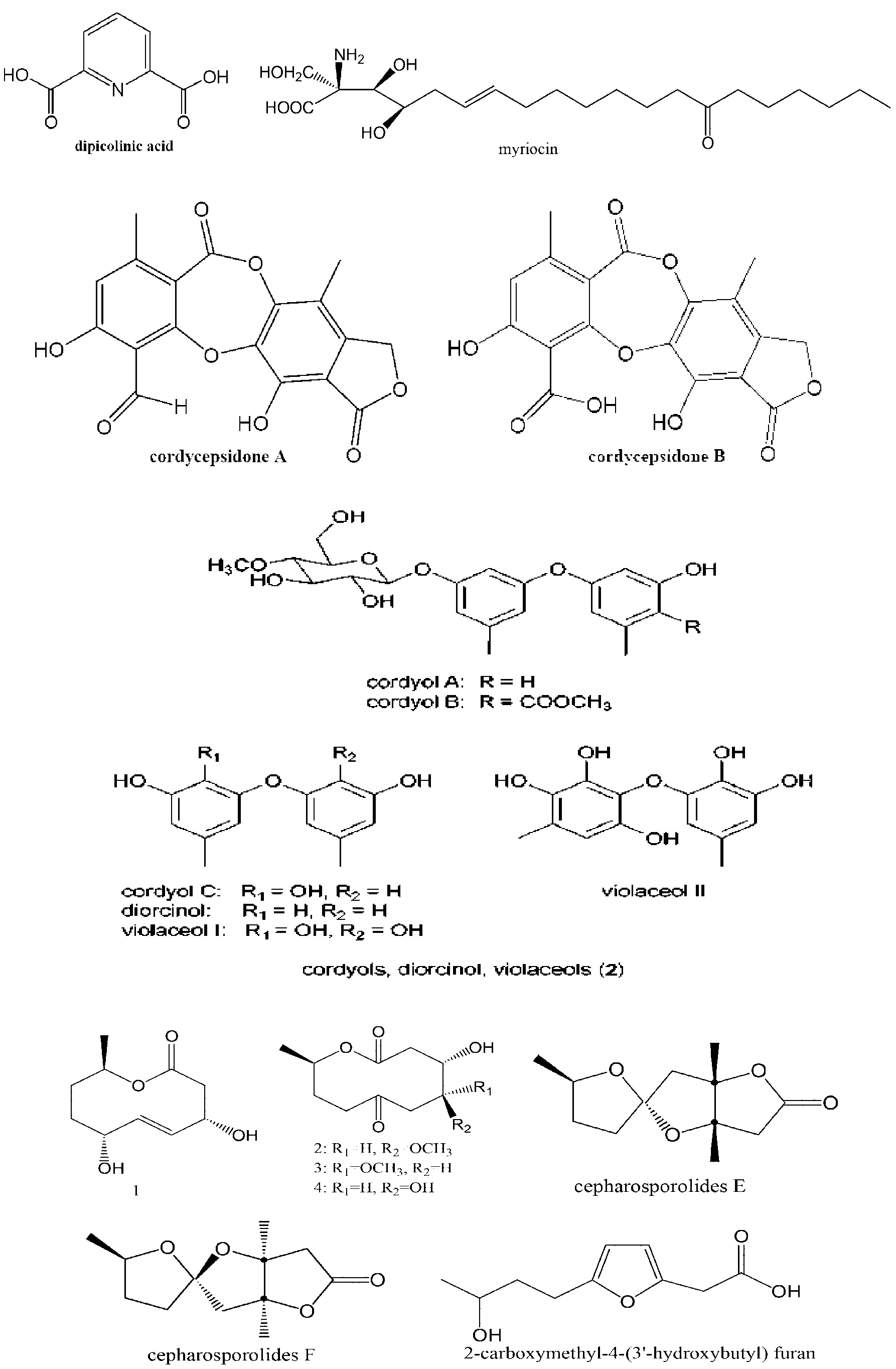
图7 虫草菌的有机酸、芳香醚等化合物结构图
虫草菌还能代谢合成有特殊结构与活性的有机酸、芳香醚、大环内酯等化合物。Watanabe等[59]在蛹虫草培养液中分离获得具有杀虫作用的吡啶二羧酸(见图7),可作为酚氧化酶原激活的抑制剂。更令人感到振奋的是,在辛莱克虫草C. sinclairii发酵液分离到(2S,3R,4R)-(E) -2-氨基-3,4-二羟基-2-(羟甲基)-14-氧代-6-二十烯酸(图7),亦称多球壳菌素(myriocin)或ISP-I。该化合物具有显着的免疫抑制潜力,Fujita等 (1994) 观察到其抑制T淋巴细胞和细胞毒T淋巴细胞增殖的能力是临床一线药物环孢菌素的10~100倍,与另一种免疫抑制药物FK-506相当。但是,其作用机制有别于环孢菌素和FK-506。譬如,Miyake 等(1995)发现myriocin是通过降低CTLL-2细胞(IL-2依赖的鼠细胞毒T淋巴细胞系)中的丝氨酸软脂酰转移酶活性,抑制其分泌能诱导细胞毒T淋巴细胞生IL-2因子,而环孢菌素和FK-506却能促使CTLL-2生成IL-2。值得提出的是,myriocin活性强,结构相对简单,成药性高,具有巨大的创制免疫抑制药物潜力,而替代易引起肾功能衰竭的临床一线药物环孢菌素和FK-506。更有趣的是,Fujita等 (1996) 发现2-烷基-2-氨基丙烷-1,3-二醇是myriocin的有效部位,为该类药物筛选及化学合成提供了宝贵信息。最近,Krasnoff等[35]在异足蛛虫草发酵产物中也分离到myriocin,还发现其有抗菌作用。因此,虫草资源是新药创制宝贵资源。
近来,Varughese等[60]从双翅目虫草C. dipterigena Berk.& Br中获得两个新的缩酚酸环醚类次生代谢物,cordycepsidone A (C18H12O8,图7)和B (C18H12O9,图7),cordycepsidone A中芳香A环上的甲醛基发生氧化后生成B,也致使其选择性抗植物病原真菌活性显着减弱。Bunyapaiboonsri等[61]在一个未定名的虫草菌株Cordyceps sp. BCC 1861中发现6个二苯醚类化合物,其中3个新化合物命名为cordyols A(C21H26O8,图7),B(C23H28O10,图7)和C(C14H14O4,图7),另3个已知化合物分别是diorcinol,violaceol-I和violaceol-II。有趣的是cordyol C具有显着的抗单纯疱疹病毒活性(IC50=1.3μg/mL),并对乳腺癌BC细胞核肺癌NCI-H187细胞具有中等细胞毒活性。violaceol-I和violaceol-II也呈现中等抗癌细胞毒活性,且有抗疟原虫活性。除cordyol B外,其它几个化合物还有一定的抗结核杆菌活性。另外,有些虫草菌也产大环内酯天然产物。Rukachaisirikul研究组[62]在蛹虫草中发现4个抗疟原虫活性的大环内酯内化合物,化合物1~3(图7)是新化合物,化合物4为已知化合物cepharosporolide C。另外还分离得到cepharosporolide E、cepharosporolide F和2-羧甲基-4-(3’-丁羟基)呋喃等3个已知化合物。
2 虫草资源深度开发利用的发展方向
近20多年来,人们一直致力于冬虫夏草替代品的研究,一方面是冬虫夏草菌的发酵生产;另一方面,虫草新资源的发掘。令人欣慰的是目前已证明巴西虫草C. brasilensis P. Henn.、九州虫草、高雄山虫草、日本虫草、粉被虫草、古尼虫草、香棒虫草C. barnesii Thwaites ex Berk. & Br.、甘肃虫草C. gansuensis Zhang ,Wang & Yan、蛾蛹草C. polyarthra Mêll.、凉山虫草、广东虫草C. guangdongensis等均为可利用的替代资源。但同样尚未解决人工规模培植关键技术,而天然野生资源的种群数量不可能满足产业发展要求。因此,要实现可持续开发利用虫草资源,必需在与虫草相关的生物学、生理学、遗传学等上游技术以及规模化发酵制备下游技术等方面取得突破,才是正确的选择。主要包括以下几方面:
2.1 虫草原料制备 虫草野生资源存在原料的数量不足、原料的质量不稳定以及破坏生态环境、甚至物种资源枯竭等诸多弊端。而绝大多数虫草的人工培植扩繁技术迄今尚未攻克。因此,规模化发酵制备提供了便捷途径。当然,虫草的发酵也存在许多待解决的问题,譬如,菌种分离难、保藏难、生长慢、难培养等系列生物学问题。不过,这些相比人工规模培植所涉及的分化问题更易获得突破。譬如冬虫夏草菌的低温发酵技术已取得良好进展,且已上市。
2.2 虫草制品亟待转型升级 当前,无论是虫草还是其培养物,虫草制品主要是一次性直接利用的生药或粗制品,产品的技术含量和附加值低。因此,虫草产品在国际生物医药市场竞争力弱,虫草原料的深加工刻不容。从长远看,更应该注重虫草产品内涵的提升,有更好更明确的功效,才会获得消费者持久的青睐。从本文评述的虫草多样的次生活性代谢产物进展看,虫草功效归因于其丰富多样的天然产物。同时我们也应关注到,这些次生代谢产物在虫草菌中含量极低,深刻影响到其品质。因此,可以采用合适的生物技术手段和发酵策略,把虫草发酵与特定活性物质的生物代谢合成调控相结合,着眼于高技术高附加值二次性活性物质的开发利用。
2.3 虫草新资源次生代谢产物库的建立及药效学评价 我国虫草的研究工作多集中在冬虫夏草、蛹虫草和蝉花等少数几种常见虫草,研究工作相对较深入。而对虫草新资源缺乏深入全面系统的研究。就物种本身而言,虫草菌在侵入寄主过程及定殖前为克服寄主天然的屏障,决定了其次生代谢产物的化学结构域生物活性的多样性,这些次生代谢产物是新药创制的突破点。然而,一个不容忽视的问题是,在常态下,许多虫草的特殊代谢途径并不启用,或者说调节特殊功能次生代谢产物合成的关键酶和基因处于沉默状态,故常规的培养方式影响对其次生代谢产物库的发掘。因此,我们在研究其代谢产物库时,既要考虑不同虫草物种间的差别,更要考虑同一物种不同环境条件下存在代谢途径的巨大差异。而在外界干预的特殊环境下,可能是发掘虫草资源开发利用潜力的有效途径。在系统研究虫草新资源次生代谢产物的基础上,建立天然产物化合物库,并积极开展活性评价、作用机制及成药性研究,为虫草资源的深度开发利奠定基础。
[参考文献]
[1] Buenz E J,Bauer B A,Osmundson T W,et al.The traditional Chinese medicine Cordyceps sinensis and its effects on apoptotic homeostasis [J].J Ethnopharmacol,2005,96(1):19-29.
[2] Sung G H,Hywel-Jones N L,Sung J M,et al.Phylogenetic classification of Cordyceps and the clavicipitaceous fungi [J].Stud Mycol,2007,57(1):5-59.
[3] Xiao J H and Zhong J J.Secondary metabolites from Cordyceps species and their antitumor activity studies [J].Recent Patents Biotechnol,2007,1(2):123-137.
[4] 梁宗琦,刘爱英,刘作易.中国真菌志虫草属 [M]. 第23卷.北京:科学出版社,2007.
[5] Paterson R R M.Cordyceps - a traditional Chinese medicine and another fungal therapeutic biofactory?[J].Phytochemistry,2008,69(7):1469-1495.
[6] Zhong J J and Xiao J H.Secondary metabolites from higher fungi:Discovery,bioactivity,and bioproduction [J].Adv Biochem Engin Biotechnol,2009,113:79-151.
[7] Holliday J C,Cleaver M.Medicinal value of the caterpillar fungi species of the genus Cordyceps (Fr.) link (Ascomycetes).A review [J].Int J Med Mushrooms,2008,10(3):219-234.
[8] Nikoh N,Fukatsu T.Interkingdom host jumping underground:phylogenetic analysis of entomoparasistic fungi of the genus Cordyceps [J].Mol Biol Evol,2000,17(4):629-638.
[9] Isaka M,Kittakoop P,Kirtikara K,et al.Bioactive substances from insect pathogenic fungi [J].Acc Chem Res,2005,38(10):813-823.
[10] Ahn Y J,Park S J,Lee S G,et al.Cordycepin:selective growth inhibitor derived from liquid culture of Cordyceps militaris against Clostridium spp [J].J Agr Food Chem,2000,48(7):2744-2748.
[11] Xu F L,Lee Y L,Tsa W Y,et al.Effect of cordycepin on Hantaan virus 76-118 infection of primary human embryonic pulmonary fibroblasts-characterization of apoptotic effects [J].Acta Virol,2005,49(3):183-193.
[12] Kim J R,Yeon S H,Kim H S,et al.Larvicidal activity against Plutella xylostella of cordycepin from the fruiting body of Cordyceps militaris [J].Pest Manag Sci,2002,58(7):713-717.
[13] Madla S,Methacanon P,Prasitsil M,et al.Characterization of biocompatible fungi-derived polymers that induce IL-8 production [J].Carbohydr Polym,2005,59(3):275-280.
[14] Rottenberg M E,Masocha W,Ferella M,et al.Treatment of African trypanosomiasis with cordycepin and adenosine deaminase inhibitors in a mouse model [J].J Infect Dis,2005,192(9):1658-1665.
[15] Isaka M,Tanticharoen M.Structures of Cordypyridones A-D,antimalarial N-hydroxy- and N-methoxy-2-pyridones from the insect pathogenic fungus Cordyceps nipponica [J].J Org Chem,2001,66(14):4803-4808.
[16] Schmidt K,Günther W,Stoyanova S,et al.Militarinone A,a neurotrophic pyridone alkaloid from Paecilomyces militaris [J].Org Lett,2002,4(2):197-199.
[17] Schmidt K,Riese U,Li Z Z,et al.Novel tetramic acids and pyridone alkaloids,militarinones B,C,and D,from the insect pathogenic fungus Paecilomyces militaris [J].J Nat Prod,2003,66(3):378-383.
[18] Cheng Y,Schneider B,Riese U,et al.(+)-N-deoxymilitarinone A,a neuritogenic pyridone alkaloid from the insect pathogenic fungus Paecilomyces farinosus [J].J Nat Prod,2006,69(3):436-438.
[19] Cheng Y,Schneider B,Riese U,et al.Farinosones A-C,neurotrophic alkaloidal metabolites from the entomogenous deuteromycete Paecilomyces farinosus [J].J Nat Prod,2004,67(11):1854-1858.
[20] Lang G,Blunt J W,Cummings N J,et al.Paecilosetin,a new bioactive fungal metabolite from a New Zealand isolate of Paecilomyces farinosus [J].J Nat Prod,2005,68(5):810-811.
[21] Ma C,Li Y,Niu S B,et al.N-Hydroxypyridones,phenylhydrazones,and a quinazolinone from Isaria farinosa [J].J Nat Prod,2011,74(1):32-37.
[22] Haritakun R,Srikitikulchai P,Khoyaiklang P,et al.Isariotins A-D,alkaloids from the insect pathogenic fungus Isaria tenuipes BCC 7831 [J].J Nat Prod,2007,70(9):1478-1480.
[23] Bunyapaiboonsri T,Yoiprommarat S,Intereya K,et al.Isariotins E and F,spirocyclic and bicyclic hemiacetals from the entomopathogenic fungus Isaria tenuipes BCC 12625 [J].J Nat Prod,2009,72(4):756-759.
[24] Oh H,Kim T,Oh G S,et al.(3R,6R)-4-methyl-6-(1-methylethyl)-3-phenylmethyl perhydro-1,4-oxazine-2,5-dione:an apoptosis-inducer from the fruiting bodies of Isaria japonica [J].Planta Med,2002,68(4):345-348.
[25] Kuo Y C,Lin L C,Don M J,et al.Cyclodesipeptide and dioxomorpholine derivatives isolated from the insect-body portion of the fungus Cordyceps cicadae [J].J Chin Med,2002,13(4):209-219.
[26] Isaka M,Boonkhao B,Rachtawee P,et al.A xanthocillin-like alkaloid from the insect pathogenic fungus Cordyceps brunnearubra BCC 1395 [J].J Nat Prod,2007,70 (4):656-658.
[27] Yang M L,Kuo P C,Hwang T L,et al.Anti-inflammatory principles from Cordyceps sinensis [J].J Nat Prod,2011,74(9):1996-2000.
[28] Jow G M,Chou C J,Chen B F,et al.Beauvericin induces cytotoxic effects in human acute lymphoblastic leukemia cells through cytochrome c release,caspase 3 activation:the causative role of calcium[J].Cancer Lett,2004,216(2):165-173.
[29] Nilanonta C,Isaka M,Kittakoop P,et al.Precursor-directed biosynthesis of beauvericin analogs by the insect pathogenic fungus Paecilomyces tenuipes BBC 1614 [J].Tetrahedron,2002,58(17):3355-3360.
[30] Kouri K,Duchen M R,Lemmens-Gruber R.Effects of beauvericin on the metabolic state and ionic homeostasis of ventricular myocytes of the guinea pig [J].Chem Res Toxicol,2005,18(11):1661-1668.
[31] Calo L,Fornelli F,Ramires R,et al.Cytotoxic effects of the mycotoxin beauvericin to human cell lines of myeloid origin [J].Pharmacol Res,2004,49(1):73-77.
[32] Ojcius D M,Zychilinsky A,Zheng L M,et al.Ionophore-induced apoptosis:role of DNA fragmentation and calcium flux [J].Exp Cell Res,1991,197(1):43-49.
[33] Kim M K,Seong S Y,Seoh J Y,et al.Orientia tsutsugamushi inhibits apoptosis of macrophages by retarding intracellular calcium release [J].Infect Immun,2002,70(8):4692-4696.
[34] Jia J M,Ma X C,Wu C F,et al.Cordycedipeptide A,a new cyclodipeptide from the culture liquid of Cordyceps sinensis (Berk.) Sacc [J].Chem Pharm Bull,2005,53(5):582-583.
[35] Krasnoff S B,Reátegui R F,Wagenaar M M,et al.Cicadapeptins I and II:new aib-containing peptides from the entomopathogenic fungus Cordyceps heteropoda [J].J Nat Prod,2005,68(1):50-55.
[36] Rukachaisirikul V,Chantaruk S,Tansakul C,et al.A cyclopeptide from the insect pathogenic fungus Cordyceps sp.BCC 1788 [J].J Nat Prod,2006,69(2):305-307.
[37] Sakakura A,Shioya K,Katsuzaki H,et al.Isolation,structural elucidation and synthesis of a novel antioxidative pseudo-di-peptide,Hanasanagin,and its biogenetic precursor from the Isaria japonica mushroom [J].Tetrahedron,2009,65 (34):6822-6827.
[38] Asai T,Yamamoto T,Chung Y M,et al.Aromatic Polyketide Glycosides from an Entomopathogenic Fungus,Cordyceps indigotica [J].Tetrahedron Lett,2012,53(3):277-280.
[39] Nam K S,Jo Y S,Kim Y H,et al.Cytotoxic activities of acetoxyscirpenediol and ergosterol peroxide from Paecilomyces tenuipes [J].Life Sci,2001,69(2):229-237.
[40] Xiao J H,Sun Z H,Pan W D,et al.Jiangxienone,a new compound with potent cytotoxicity against tumor cells from traditional Chinese medicinal mushroom Cordyceps jiangxiensis [J].Chem Biodiver,2012,9(7):1349-1355.
[41] Lü Y H,Pan W D,Xiao J H,et al.Cytotoxic mechanism of novel compound jiangxienone from Cordyceps jiangxiensis against cancer cells involving DNA damage response pathway [J].Process Biochem,2014,49(4):697-705.
[42] Han H C,Lindequist U,Hyun J W,et al.Apoptosis induction by 4β-acetoxyscirpendiol from Paecilomyces tenuipes in human leukaemia cell lines [J].Pharmazie,2004,59(1):42-49.
[43] Oh G S,Hong K H,Oh H,et al.4-acetyl-12,13-epoxyl-9-trichothecene-3,15-diol isolated from the fruiting bodies of Isaria japonica YASUDA induces apoptosis of human leukemia cells (HL-60) [J].Biol Pharm Bull,2001,24(7):785-789.
[44] Pae H O,Oh G S,Choi B M,et al.Induction of apoptosis by 4-acetyl-12,13-epoxyl-9- trichothecene-3,15-diol from Isaria japonica Yasuda through intracellular reactive oxygen species formation and Caspase-3 activation in human leukemia HL-60 cells [J].Toxicol Vitro,2003,17(1):49-57.
[45] Kim H J,Jang I J,Kim Y J,et al.4-acetyl-12,13-epoxyl-9-trichothecene-3,15-diol from Isaria japonica mediates apoptosis of rat bladder carcinoma NBT-II cells by decreasing anti-apoptotic Bcl-2 expression and increasing pro-apoptotic bax expression [J].Am J Chin Med,2004,32(3):377-387.
[46] Kikuchi H,Miyagawa Y,Sahashi Y,et al.Novel trichothecanes,paecilomycine A,B,and C,isolated fromentomopathogenic fungus,Paecilomyces tenuipes [J].Tetrahedron Lett,2004,45(33):6225-6228.
[47] Kikuchi H,Miyagawa Y,Sahashi Y,et al.Novel spirocyclic trichothecanes,spirotenuipesine A and B,isolated from entomopathogenic fungus,Paecilomyces tenuipes [J].J Org Chem,2004,69(2):352-356.
[48] Kikuchi H,Miyagawa Y,Nakamura K,et al.A novel carbon skeletal trichothecane,tenuipesine A,isolated from an entomopathogenic fungus,Paecilomyces tenuipes [J].Org Lett,2004,6(24):4531-4533.
[49] Dou Y,Xiao J H,Xia X X,et al.Effect of oxygen supply on biomass and helvolic acid production in submerged fermentation of Cordyceps taii [J].Biochem Eng J,2013,81(1):73-79.
[50] 陈超,潘卫东,肖建辉,等.江西青霉甲醇提取物中的化学成分研究[J].中国实验方剂学杂志,2011,17(22):97-101.
[51] Seephonkai P,Isaka M,Kittakoop P,et al.A new tropolone from the insect pathogenic fungus Cordyceps sp.BCC 1681 [J].J Antibiot,2001,54(9):751-752.
[52] Grudniewska A,Hayashi S,Shimizu M,et al.Opaliferin,new polyketide from cultures of entomopathogenic fungus Cordyceps sp.NBRC 106954 [J].Org Lett,2014,16(18):4695-4697.
[53] Asai T,Yamamoto T,Chung Y M,et al.Aromatic Polyketide Glycosides from an Entomopathogenic Fungus,Cordyceps indigotica [J].Tetrahedron Lett,2012,53(3):277-280.
[54] Asai T,Yamamoto T,Oshima Y.Aromatic polyketide production in Cordyceps indigotica,an entomopathogenic fungus,induced by exposure to a histone deacetylase inhibitor [J].Org Lett,2012,14(8):2006-2009.
[55] Asai T,Luo D,Obara Y,et al.Dihydrobenzofurans as cannabinoid receptor ligands from Cordyceps annullata,an entomopathogenic fungus cultivated in the presence of an HDAC inhibitor [J]. Tetrahedron Lett, 2012,53(18):2239-2243.
[56] Asai T,Chung Y M,Sakurai H,et al.Tenuipyrone,a novel skeletal polyketide from the entomopathogenic fungus,Isaria tenuipes,cultivated in the presence of epigenetic modifiers [J].Org Lett,2012,14(2):513-515.
[57] Jaturapat A,Isaka M,Hywel-Jones N L,et al.Bioxanthracenes from the insect pathogenic fungus Cordyceps pseudomilitaris BCC 1620-I.taxonomy,fermentation,isolation and antimalarial activity [J].J Antibiot,2001,54(1):29-35.
[58] Isaka M,Tanticharoen M,Thebtaranonth Y.Cordyanhydrides A and B.two unique anhydrides from the insect pathogenic fungus Cordyceps pseudomilitaris BCC 1620 [J].Tetrahedron Lett,2000,41(10):1657-1660.
[59] Watanabe N,Hattori M,Yokoyama E,et al.Entomogenous fungi that produce 2,6-pyridine dicarboxylic acid (dipicolinic acid) [J].J Biosci Bioeng, 2006,102(4):365-368.
[60] Varughese T,Riosa N,Higginbotham S,et al.Antifungal depsidone metabolites from Cordyceps dipterigena,an endophytic fungus antagonistic to the phytopathogen Gibberella fujikuroi [J].Tetrahedron Lett,2012,53(13):1624-1626.
[61] Bunyapaiboonsri T,Yoiprommarat S,Intereya K,et al.New diphenyl ethers from the insect pathogenic fungus Cordyceps sp.BCC 1861 [J].Chem Pharm Bull,2007,55(2):304-307.
[62] Rukachaisirikul V,Pramjit S,Pakawatchai C,et al.10-membered macrolides from the insect pathogenic fungus Cordyceps militaris BCC 2816 [J].J Nat Prod,2004,67(11):1953-1955.



