王 琴,黄 兰,李 霞,葛 颂
(遵义医科大学附属口腔医院 牙周科,贵州 遵义 563099)
牙周炎是菌斑引起的发生于牙周支持组织的免疫炎症性疾病,可导致附着丧失,牙槽骨吸收,牙齿脱落等临床症状[1]。牙周支持组织炎症会导致牙龈上皮通透性增加,微生物、内毒素和炎性细胞因子可能藉此进入全身血液循环,进而引发全身炎症反应[2]。最近研究表明,牙周病与多种肠道疾病的进展有关[3]。牙周病原体的异位定植可导致肠道微生态失衡和炎症。与此同时,牙周病原体的毒力因子会破坏肠道上皮的物理屏障,使肠道腔的细菌和代谢物泄漏到血液中。此外,牙周病原体可以直接或间接地调节免疫系统并破坏体内平衡[4]。
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的痴呆类型,神经炎症在AD神经病理变化的进展中起着至关重要的作用[5]。越来越多的证据支持牙周炎与AD之间的联系[6]。Chen等[1]研究发现患有牙周炎的病人发展为AD的风险约增加1.7倍。口腔菌群失衡会导致肠部菌群改变,并与胃肠道、神经系统疾病等多种全身性疾病有关[7]。肠道菌群失调可通过微生物群-肠-脑轴导致神经行为变化[8]。然而,牙周炎影响AD的具体机制还未阐明。本研究旨在通过分析实验性牙周炎对大鼠水迷宫实验、回肠组织形态及occludin表达水平、血液炎症因子水平的影响,初步探讨牙周炎对大鼠学习记忆能力的影响,继而推测牙周炎影响AD的可能机制。
1 材料与方法
1.1 实验动物 选用8周龄SPF级雄性SD大鼠30只(辽宁长生生物技术股份有限公司),每笼5只,饲养温度22~25℃,12 h/12 h昼夜循环,噪音不超过60 dB,标准饲料喂养,饮食饮水自由,垫料每周更换2次,定期消毒。
1.2 主要试剂与材料 灭菌3-0、5-0缝合丝线(金环,上海),β-淀粉样蛋白(β-amyloid,Aβ)25-35(Sigma,美国),Aβ1-42一抗(Abcam,美国),闭锁蛋白(Occludin)一抗(赛维尔,中国),大鼠白细胞介素-6(Interleukin-6,IL-6)、脂多糖(Lipopolysaccharide,LPS)酶联免疫吸附测定试剂盒(江莱生物,上海);BX43正置显微镜(Olympus,日本);Centrifuge5417R 低温超速离心机(Eppendorf,德国);EG1150石蜡包埋机(Leica,德国);RM2245 轮转式切片机(Leica,德国);TKY-TKA摊片烤片机(泰康,湖北);TopScan行为学分析系统(Cleversys Inc,美国)。
1.3 方法
1.3.1 实验分组与动物模型建立 适应性喂养7 d后,按随机原则将30只大鼠分为3组:对照组(C)、牙周炎组(P)、AD模型组(AD)。牙周炎组采用3-0缝合丝线行双侧上颌第一、二磨牙结扎,总持续时间为8周。每周查看1次结扎线情况,发现脱落及时重扎。牙周结扎45 d后建立AD模型,术前大鼠禁食12 h,腹腔注射2%戊巴比妥钠(30 mg/kg)麻醉后,将大鼠颅平面固定在脑立体定位仪,去除头部毛发,碘伏消毒后纵行切开至骨面,暴露颅骨后将前囟设为零点,确定进针位点为前囟后1 mm,中线旁开1.5 mm,进针深度为颅骨下3.5 mm。通过微量注射器将Aβ25-35(2 μg/μL)注入大鼠双侧侧脑室(每侧5 μL),注射完毕后停留5 min,最后缓慢退出注射器,用5-0缝合丝线缝合创口。C组用等量生理盐水替代Aβ25-35溶液进行侧脑室注射。
1.3.2 Morris水迷宫实验 AD模型建立14 d后进行为期5 d的Morris水迷宫实验,水迷宫泳池分为4个象限,其中第1象限中心放置直径12 cm的站台,泳池水面要求没过站台2 cm。整个实验过程保持安静并在暗处进行,水温控制在(22±1)℃。4 d的定向航行实验中,将大鼠依次从2、3、4象限面朝池壁、头朝上放入水中,记录每只大鼠在120 s内到达站台的时间,若120 s内未找到站台,则用长棍引导其至站台,并停留10 s后再结束实验,每次结束实验后擦干其身体。最后1 d为空间探索实验,拆除第1象限的平台,将大鼠从任意象限(除目标象限)放入水中,对其120 s内在目标象限停留时间及穿越平台次数进行记录。利用TopScan行为学分析系统自动计算出大鼠在目标象限停留时间百分比。
1.3.3 实验动物处死与取材 大鼠5 d水迷宫实验结束后,自然喂养1 d,麻醉后腹腔下静脉取血,4℃过夜后,3 000 r/min、4℃离心10 min,上清-80℃保存备用。取出颌骨,各组随机选取3只用4%多聚甲醛固定1 d后,脱钙液脱钙,常规脱水,蜡块包埋;剩下颌骨进行修整并去除周围软组织,用PBS清洗干净后室温保存。取出末端回肠组织2 cm,PBS冲洗后,4%多聚甲醛固定1 d,常规脱水,蜡块包埋。同时,取出大脑,PBS清洗后,低温快速分离海马组织,-80℃保存备用。
1.3.4 牙周炎模型检测 HE染色:牙槽骨蜡块切成厚度为4 μm切片,自动染色机染色后晾干,中性树脂封片。亚甲蓝染色:去除颌骨软组织,1%亚甲蓝染液染色数秒后流水冲洗。晾干后用体式显微镜扫描,测量并记录上颌第二磨牙颊、腭侧釉牙骨质界至牙槽嵴顶的距离(Cemento-enamel junction to alveolar bone crest,CEJ-ABC),每侧记录近中、中央、远中3处位点,取平均值作为牙槽骨吸收量。
1.3.5 酶联免疫吸附实验测定大鼠血清中IL-6、LPS水平 标准孔中按浓度梯度加入50 μL标准品,样本孔中加入样本稀释液50 μL,所有孔加入酶标剂,贴上封板膜,在37℃烘箱中放置60 min。撕掉封板模后甩去液体,吸水纸拍干,每孔加入适量洗涤剂静置30 s后甩去,洗涤重复5次。将反应底物混合溶液A、B依次加入每孔中,封板膜覆盖避光,37℃烘箱中放置30 min。每孔加入终止液50 μL,使用酶标仪测量吸光度。
1.3.6 回肠组织形态 回肠组织蜡块切成厚度为5 μm切片,自动染色机染色后晾干,中性树脂封片。为评估肠道屏障的完整性,随机选择在100×放大镜下HE染色的切片图像。采用Image-Pro Plus软件测量肠绒毛高度、肠隐窝深度,并计算肠绒毛高度与隐窝深度比值,以评价肠道绒毛的形态学特征。根据以往的研究,肠绒毛高度定义为肠绒毛顶端至相关肠隐窝口的距离,肠隐窝深度定义为肠隐窝口至其基底的距离[9]。
1.3.7 免疫组织化学法检测回肠occludin表达 回肠组织蜡块切成厚度为5 μm切片,脱蜡后枸橼酸盐微波修复8 min,3%过氧化氢室温孵育15 min,山羊血清封闭20 min,甩去山羊血清后滴加兔抗occludin多克隆抗体,4℃过夜后滴加二抗,室温孵育20 min,显色,流水冲洗终止反应。苏木素复染,1%盐酸-酒精分化2 s,梯度脱水,晾干后封片。通过Image-Pro Plus软件进行光密度值分析。
1.3.8 免疫印迹法检测海马Aβ1-42表达 取30 mg海马组织剪碎,加入裂解液400 μL,冰上裂解15 min后研磨,将匀浆于12 000 r/min、4℃离心15 min,取少量上清BCA法定量,剩余上清储存于-80℃冰箱。根据测量蛋白浓度,于蛋白原液中加入蛋白上样缓冲液及PBS,高温变性10 min。取10 μL蛋白电泳分离,采用半干转法将蛋白样品转移至聚偏二氟乙烯膜上。5%脱脂牛奶室温下摇床封闭2 h后添加Aβ1-42一抗(1∶1 000),4℃过夜孵育。TBST洗膜后添加相应二抗(1∶5 000),37℃孵育1 h,曝光剂显色。以β-actin为内参蛋白,采用Imagelab软件进行灰度值分析。
1.4 统计学分析 SPSS 18.0统计软件分析数据,均数±标准误(Mean±SEM)表示。Morris水迷宫逃避潜伏期实验数据采用重复测量方差分析,其他实验数据组间比较使用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 实验性牙周炎模型建立 HE结果显示C、AD组表现为正常牙周组织,牙龈上皮完整,结合上皮位置正常,牙槽骨未见吸收。P组上颌第二磨牙结合上皮向根方迁移,附着丧失,沟内上皮出现溃疡、坏死,部分增生呈网眼状,牙槽嵴顶降低(见图1)。
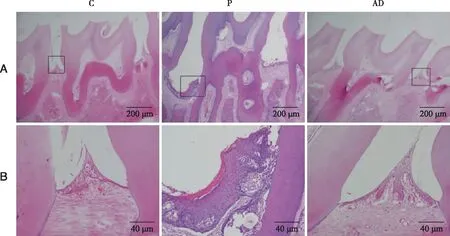
A:×40;B:×200。图1 牙槽骨HE染色
各组牙槽骨亚甲蓝染色后,经体视显微镜记录后牙牙槽骨的吸收程度,结果表明P组上颌第二磨牙牙槽骨吸收较C、AD组严重(P<0.05);AD组与C组牙槽骨吸收程度相似(P>0.05,见图2)。
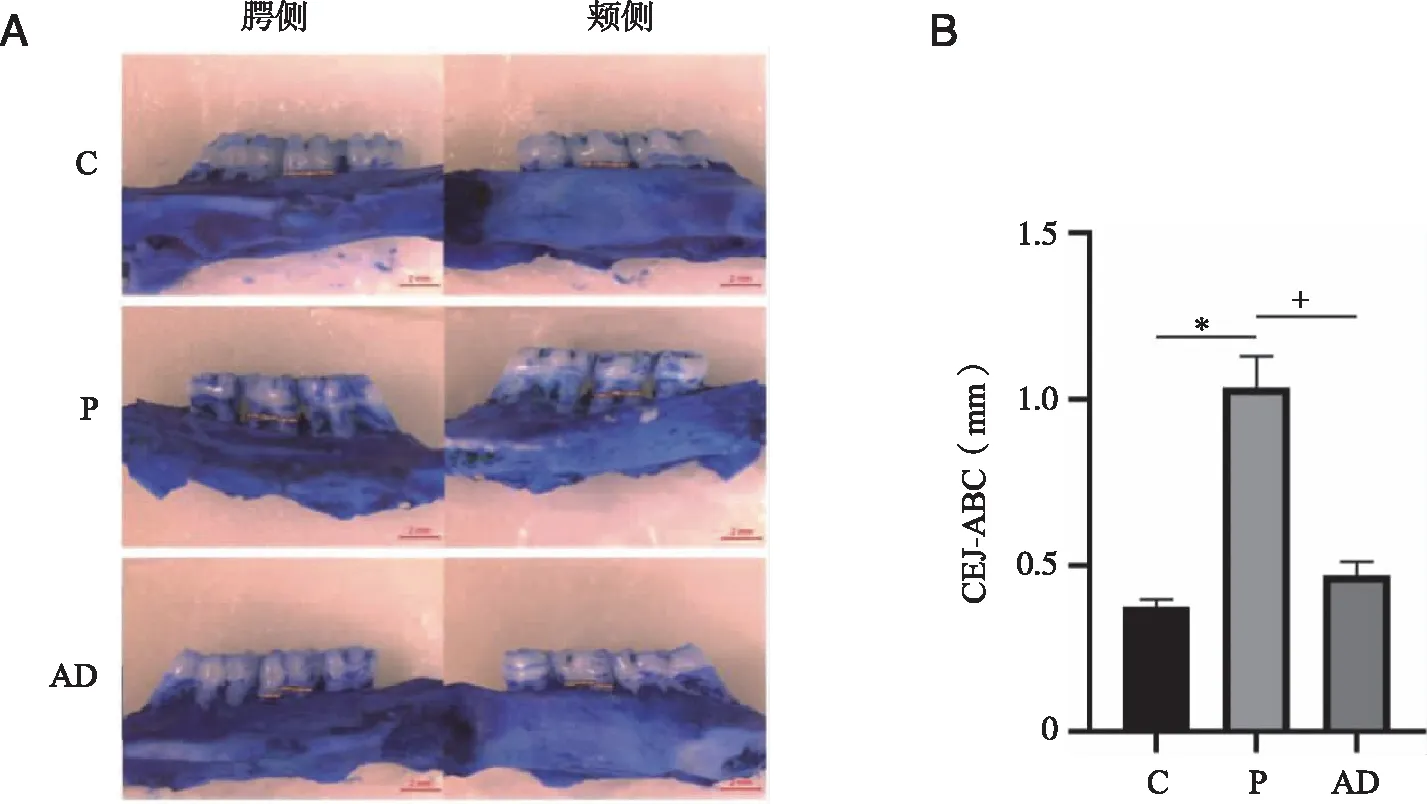
A:牙槽骨亚甲蓝染色;B:牙槽骨吸收量;*:与C组比较, P <0.05;+:与 P组比较, P <0.05;n=4。图2 牙槽骨亚甲蓝染色及统计结果
2.2 实验性牙周炎对大鼠空间记忆能力的影响 Morris水迷宫实验结果表明各组大鼠平均逃避潜伏期随着训练增加而逐日变短。图3A结果显示,第3、4天P组及AD组逃避潜伏期明显长于C组(P<0.05)。在第5天的空间探索实验中,与C组相比,P组及AD组目标象限停留百分比及穿越平台次数均下降(P<0.05,见图3B、C)。
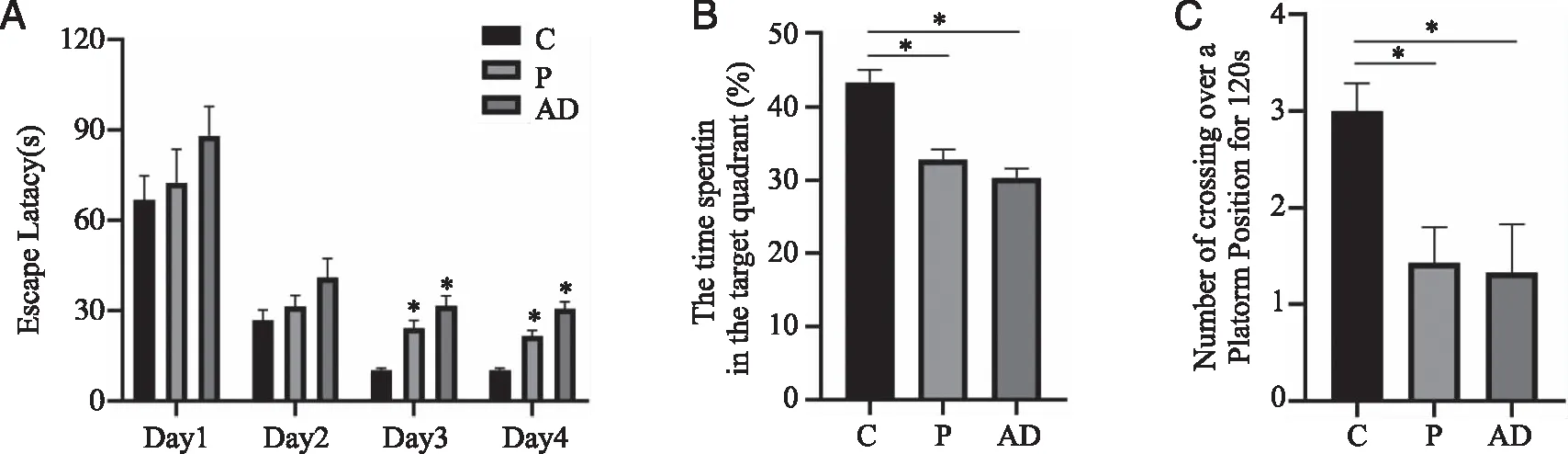
A:平均逃避潜伏期;B:目标象限停留百分比;C:穿越平台次数;*:与C组比较, P <0.05;n=6~9。图3 水迷宫实验结果
2.3 实验性牙周炎对大鼠血清IL-6、LPS浓度的影响 血清IL-6浓度,P组、AD组高于C组(P<0.05,见图4A);血清LPS浓度,P组高于C、AD组(P<0.05,见图4B)。
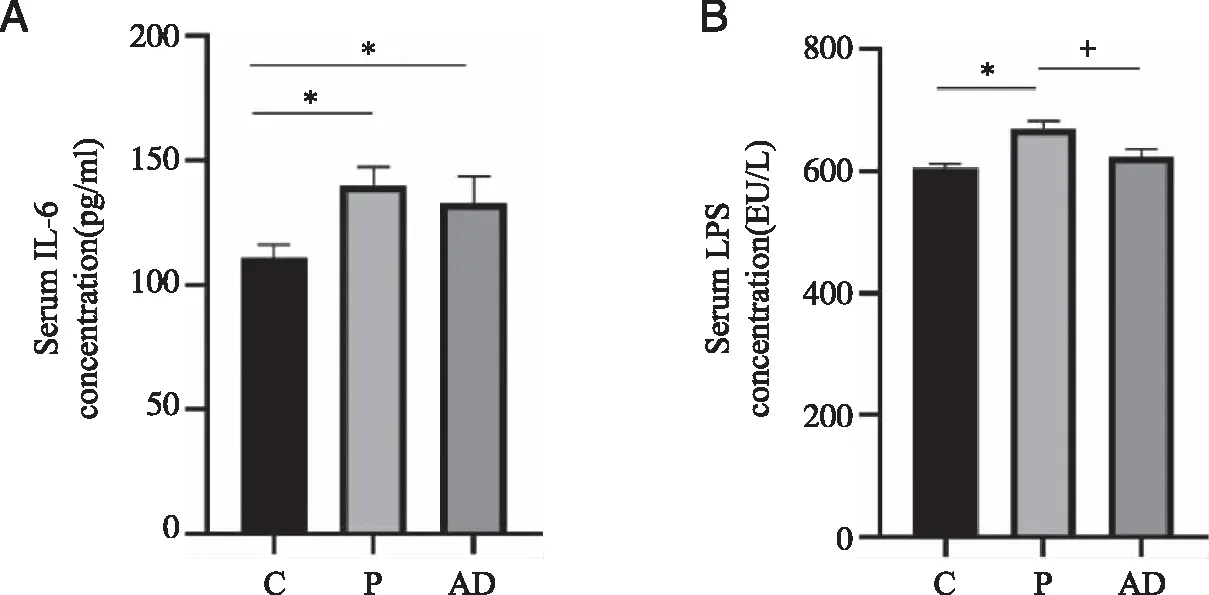
A:血清IL-6浓度;B:血清LPS浓度;*:与 C组比较, P <0.05;+:与 P组比较, P<0.05;n=6。图4 实验性牙周炎对大鼠血清IL-6、LPS浓度的影响
2.4 实验性牙周炎对回肠绒毛组织形态的影响 HE结果显示:C组肠绒毛呈指状未见水肿,结构正常。P组、AD组肠绒毛变粗变钝,粘膜层可见炎症细胞浸润(见图5A)。与C组相比,P组、AD组肠绒毛高度(Intestinal villus height,V)降低(P<0.05,见图5B);3组肠隐窝深度(Intestinal crypt depth,C)的差异无统计学意义(P>0.05,见图5C);与C组相比,P组、AD组肠绒毛高度与隐窝深度之比(V/C)降低(P<0.05,见图5D)。
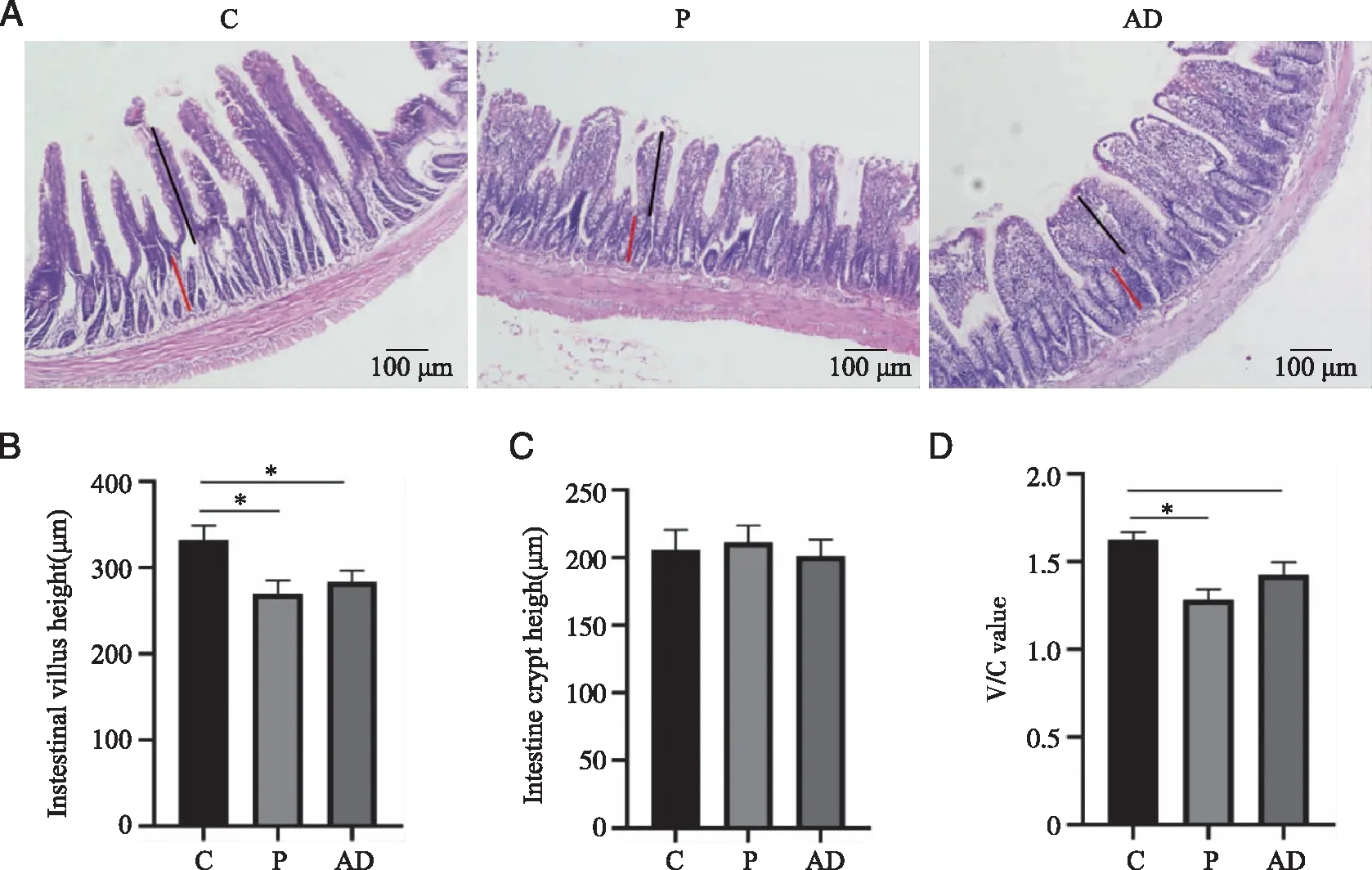
A:肠部HE染色;B:肠绒毛高度;C:肠隐窝深度;D:绒毛高度与隐窝深度比值;*:与 C组比较,P <0.05;n=6。图5 实验性牙周炎对回肠绒毛组织形态的影响
2.5 实验性牙周炎对回肠occludin表达的影响 显微镜下观察回肠组织中occludin蛋白的表达,肠黏膜上皮层和腺体中棕黄色为阳性表达。occludin位于胞膜和靠近胞膜的胞浆中。与C组相比,P组、AD组occludin蛋白表达降低(P<0.05,见图6)。
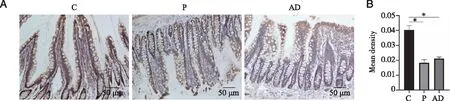
A:回肠免疫组织化学染色(×200);B:平均光密度值统计结果;*:与 C组比较,P <0.05;+:与P组比较,P<0.05;n=3。图6 实验性牙周炎对回肠occludin表达的影响
2.6 实验性牙周炎对海马Aβ1-42含量的影响 与C相比,P组及AD组Aβ1-42表达增加(P<0.05)。与P组相比,AD组Aβ1-42表达增加(P<0.05,见图7)。
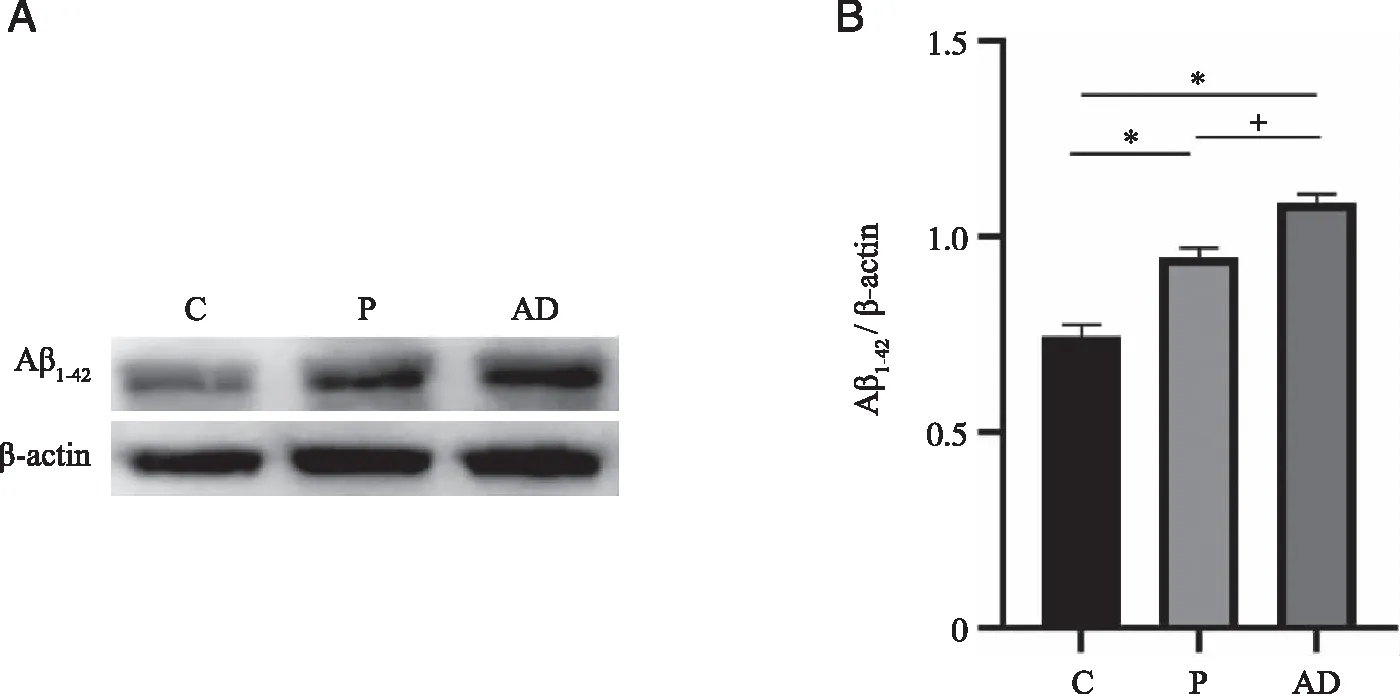
A:大鼠海马Aβ1-42蛋白表达情况;B:大鼠Aβ1-42蛋白表达统计结果; *:与 C组比较,P<0.05;+:与 P组比较,P<0.05;n=3。图7 实验性牙周炎对大鼠海马Aβ1-42含量的影响
3 讨论
牙周炎是由于菌斑微生物的改变以及炎症介质的释放,最终导致牙周结缔组织附着破坏和牙槽骨吸收的炎症性疾病。模拟动物牙周炎的各种方法中,结扎诱导是最常用的模型。丝线结扎可导致菌斑堆积,发生类似于临床中观察到的附着丧失和骨吸收等症状。本研究对上颌第一、二磨牙进行结扎处理2个月,经HE染色及亚甲蓝染色结果表明,P组较C组有更严重的牙槽骨吸收等病理改变,证实大鼠牙周炎模型构建成功。AD组与C组相比,在牙槽骨吸收方面无统计学差异。然而,临床上AD患者通常表现出更严重的牙周炎,这在一定程度上是合理的,因为在痴呆进展过程中,患者认知能力和自我管理的能力将逐渐丧失。本研究中AD组未见明显的牙槽骨吸收,可能与造模时间有关。
AD主要的病理特征是细胞外Aβ沉积形成老年斑(Senile plaque,SP)和细胞内神经元纤维缠结(Neurofibrillary tangles,NFT)的形成[10]。Aβ25-35是Aβ完整肽链的关键片段,可以产生相同的神经毒性效应[11]。已有研究表明双侧海马或侧脑室注射Aβ25-35可以诱导大鼠出现AD学习记忆障碍,该模型已被广泛应用于AD研究[12]。本研究通过脑部双侧侧脑室注射Aβ25-35诱导大鼠AD模型来研究牙周炎对学习记忆功能障碍的影响。Aβ是细胞外沉积物,主要由错误折叠的Aβ1-40和Aβ1-42组成。本研究AD组与C组相比,海马Aβ1-42表达水平显着增加,这与Aβ25-35诱导大鼠学习记忆障碍并伴随较高的Aβ1-42蛋白水平的报道相一致[13]。并且,水迷宫实验结果显示AD组与C组相比,在目标象限停留的百分比及穿越平台次数明显减少。这些研究结果说明AD模型建立成功。
IL-6在AD中的记忆和代谢失调中具有核心作用[14]。一项荟萃分析指出,与对照组相比,轻度认知障碍和AD患者的脑脊液和血浆中IL-6均升高[15]。同样,本研究中,与C组相比,AD组IL-6水平升高。此外,与C组相比,P组IL-6水平升高。牙龈卟啉单胞菌是牙周炎公认致病菌之一,LPS是其主要毒力因子。肠道作为下消化道的一部分,与口腔有着密切的联系。在肠道中,LPS被认为是导致肠道屏障功能障碍的主要刺激物[16]。本研究发现P组LPS水平较C组、AD组增加,说明牙周炎可导致外周血液IL-6及LPS水平升高。
肠道物理屏障主要由肠上皮细胞和紧密连接组成。occludin是第一个被发现的紧密连接蛋白,对于维持肠上皮屏障的稳态是必需的[17]。在患有克罗恩病、溃疡性结肠炎等涉及肠道通透性障碍疾病的临床研究中以及在肠道炎症疾病的动物模型中都可以观察到肠组织occludin表达显着降低,这表明它在维持屏障完整性中具有关键作用[18-19]。此外,肠道绒毛高度、隐窝深度、V/C是肠道健康的指标,常用于评估肠道形态功能的完整性。隐窝基底部存在肠干细胞,其增殖分化后可迁移至绒毛,以替换损伤的肠上皮细胞,隐窝深度增加是肠上皮受损的标志[20]。若损伤的肠上皮过多,更新不足以修复则会导致肠绒毛高度降低。据报道,动物早期断奶应激对肠屏障功能有破坏作用,其典型的病理表现为肠绒毛高度降低及隐窝深度增加[21]。本研究发现与C组相比,P组、AD组肠绒毛高度、V/C、occludin表达水平显着降低,表明P组、AD组肠道屏障受损。越来越多的人认识到促炎细胞因子,例如白细胞介素-1β、IL-6和肿瘤坏死因子-α等也参与了调节肠道屏障,它们可导致肠黏膜紧密连接的通透性增加[22]。促炎细胞因子的过度释放通过诱导肠形态损伤、减少肠部紧密连接、促进上皮细胞凋亡和阻止上皮恢复等不同的机制在导致肠屏障功能障碍中起着至关重要的作用[23]。此外,有研究发现腹腔注射LPS会导致小鼠回肠绒毛高度降低[9]。因此,本研究中肠部HE及免疫组织化学检测结果显示P组发生与AD组类似的肠粘膜屏障受损,可能是牙周炎导致肠道外周血液中的促炎细胞因子IL-6、LPS浓度增高所致。本研究发现AD组大鼠肠黏膜屏障受损,与Shukla等[24]研究发现AD转基因模型小鼠相较于非转基因小鼠表现出肠道屏障功能受损的结果一致。
本研究水迷宫实验中,与C组相比,P组逃避潜伏期延长,目标象限停留百分比及穿越平台次数下降,说明P组大鼠认知行为能力显着下降,发生与AD类似的行为学改变。并且,相较于C组,P组海马Aβ1-42表达水平增加。这些结果表明牙周炎可导致大鼠认知障碍。肠-脑轴是指肠道微生物群和中枢神经系统之间复杂的双向相互作用,涉及代谢、内分泌、神经和免疫等途径,对维持大脑稳态至关重要[25]。有研究表明肠上皮屏障功能障碍可引起宿主免疫系统的变化,导致肠道微生物重塑,从而促进肠道菌群失调[26]。肠上皮功能障碍和菌群失调可以独立或协同作用,影响对胃肠和胃肠外病变的免疫反应[27]。当肠道屏障受损、通透性增加时,会使肠道微生物、微生物衍生代谢物和微生物相关分子模式易位到肠系膜淋巴组织,从而引起神经炎症反应,进而造成神经系统疾病的发生和发展[28]。此外,Honarpisheh等[29]通过对转基因小鼠及同龄野生型小鼠在不同时间段进行脑部Aβ及肠上皮紧密连接蛋白表达水平检测,证实了转基因小鼠肠部屏障功能障碍发生在脑部出现Aβ沉积之前。因此,受损的肠道黏膜屏障可能通过肠-脑轴导致大脑神经炎症进而影响AD的发生发展。
综上所述,牙周局部炎症刺激可能通过增加循环毒力因子和炎症介质水平影响肠屏障,进而通过脑肠轴影响AD发生发展。然而,牙周炎影响AD的具体机制还未明了,需进一步深入研究。



