袁栋波,陈 瑶,龙兆钇,钟 源,谢 爽,黄俊琼
(遵义医科大学附属医院 输血科,贵州 遵义 563000)
流感病毒是流行性感冒的病原体,每年引起300~500万重症病例,导致30~60万人死亡[1]。血凝素(hemagglutinin,HA)是流感病毒表面一种重要的抗原,分布多种B细胞表位和T细胞表位。B细胞表位是病毒中和抗体的靶标[2]。T细胞表位可刺激T细胞,促进辅助性T细胞(Helper T cell,Th)分化。不同亚型流感病毒HA上存在数量不等的保守表位。由保守Th表位诱导产生的CD4+记忆T细胞受其他亚型流感病毒刺激后能迅速被激活,辅助B细胞或记忆B细胞产生抗体,在不同亚型流感病毒感染中提供保护[3]。H3N2流感病毒自1968年以来长期流行,每年冬春季节引起流行,以H3N2为主的流感季节有更多的住院病人和死亡人数[4-5]。本研究采用生物信息学预测和筛选H3N2病毒HA中保守Th表位,鉴定其免疫原性,探讨保守Th表位对CD4+T细胞活化及分化的影响。
1 材料与方法
1.1 材料 淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司;RPMI1640培养基为Gibco公司产品;抗人CD4-FITC、CD3- PE-Cy5抗体购自Biotech公司;Brefeldin A、抗人CD69-PE-Cy7、IFN-γ-PE-Cy7和IL-4-APC抗体购自BD公司;表位由上海楚肽生物科技有限公司合成。
1.2 方法
1.2.1 HLA-DRB1表位预测 从全球共享流感数据倡议组织(Global initiative on sharing all influenza data,GISAID)数据库中下载以下流感病毒株的HA氨基酸序列:H7N9 A/Anhui/1/2013、2019~2020年度H3N2疫苗株A/Kansas/14/2017以及其他已发布的人源H7N9和H3N2病毒株,剔除相同序列和不完整序列。以HLA-DRB1为目标基因型,使用在线分析工具NetMHCⅡpan-4.0预测A/Kansas/14/2017HA的Th表位,以IC50小于500 nmol/L为标准筛选阳性预测表位[6-7]。
1.2.2 保守Th表位的筛选 利用IEDB-AR的Epitope Conservancy Analysis在线工具将阳性预测表位与62 304个H3N2 HA氨基酸序列进行比对,筛选保守的Th细胞表位,需满足以下条件:每个保守表位中至少有90%的氨基酸序列在H3N2 HA中是保守的,即15个氨基酸至少有14个氨基酸序列是相同的。
1.2.3 同源建模 以蛋白质数据库中已有的H3N2 A/Victoria/361/2011 HA蛋白晶体结构(PDB ID:4WE8)为模板,采用同源建模软件SWISS-MODLE构建A/Kansas/14/2017HA的3D结构模型。2株H3N2病毒HA氨基酸序列同源性为97.2%。用PROCHECK、ERRAT和Verify-3D对建模质量进行评估,并使用SWISS-Pdb Viewer在3D模型中标识保守Th表位。利用Epitope Conservancy Analysis分析工具将保守Th表位与1 387个H7N9HA氨基酸序列进行比对,分析H3N2 HA中保守Th表位与H7N9 HA的同源性。
1.2.4 保守Th表位潜在免疫原性分析 下载并整理IEDB-AR中已发布的H3N2 HA Th表位,对数据集进行保守表位序列同源性搜索。根据IEDB数据库中已有的经实验证实的Th表位对筛选到的保守表位的潜在免疫原性进行评估。人工合成筛选得到的高保守表位,表位纯度均大于95%。
1.2.5 Th表位对T细胞活化的影响 纳入近3个月内未感染流感病毒或接种流感疫苗的健康志愿者。采集志愿者外周血10 mL,分离PBMC,调整细胞浓度为1×106个/mL,接种于24孔板。实验组分为6个组,分别加入IL-2和6种不同的Th表位(E1~E6),对照组加入IL-2,每组设4个重复。IL-2和表位多肽的工作浓度分别为50 ng/mL、10 μg/mL。于37 ℃,5%CO2培养箱中培养24 h。收集细胞,加入荧光素标记的抗人CD3、CD4、CD69、IFN-γ和IL-4抗体进行染色,Beckman coulter公司流式细胞仪分析荧光强度。研究方案获得遵义医科大学伦理委员会批准,志愿者已签署书面知情同意书。
1.2.6 统计学分析 使用Graphad Prism 8软件进行统计分析。采用秩和检验分析组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 H3N2 Th表位预测 以HLA-DRB1为目标基因型,通过在线MHC Ⅱ类抗原表位分析软件从A/Kansas/14/2017 病毒HA上共筛选出48个Th表位。48个Th表位在H3N2病毒间的保守性为28%~99%(表1)。
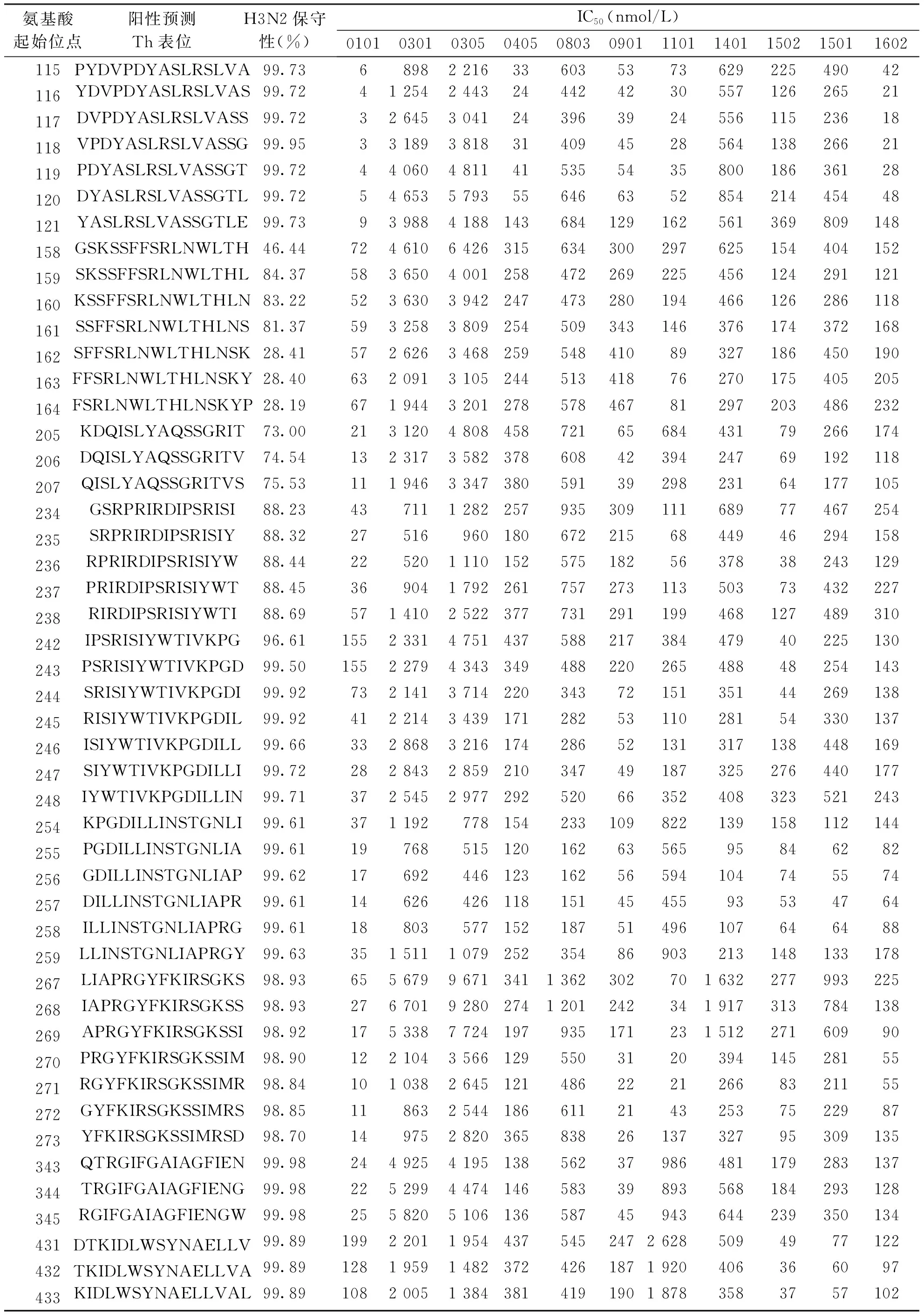
表1 H3N2 HA Th表位预测
2.2 保守Th表位的筛选 48个阳性预测表位中33个在H3N2中同源性大于90%,为保守表位。同源建模分析见红色核心区域(A、B、L)占88.3%,亮黄色额外允许区(a、b、l、p)占10.5%,超过99.5%的氨基酸处于合理区域(图1);HA模型的ERRAT得分为96.260 4,88.28%的氨基酸的Verify-3D得分大于0.2,表明A/Kansas/14/2017 HA模型是高质量的。33个保守Th表位中27个位于HA头部(图2A)。进一步根据表位在H3N2病毒中的同源性及IC50选择6个高度保守、高亲和力的Th表位(图2B),此6个保守表位目前尚未见报道。6个高度保守表位与IEDB库中的Th表位同源(表2),提示所有6个保守表位具有潜在免疫原性。
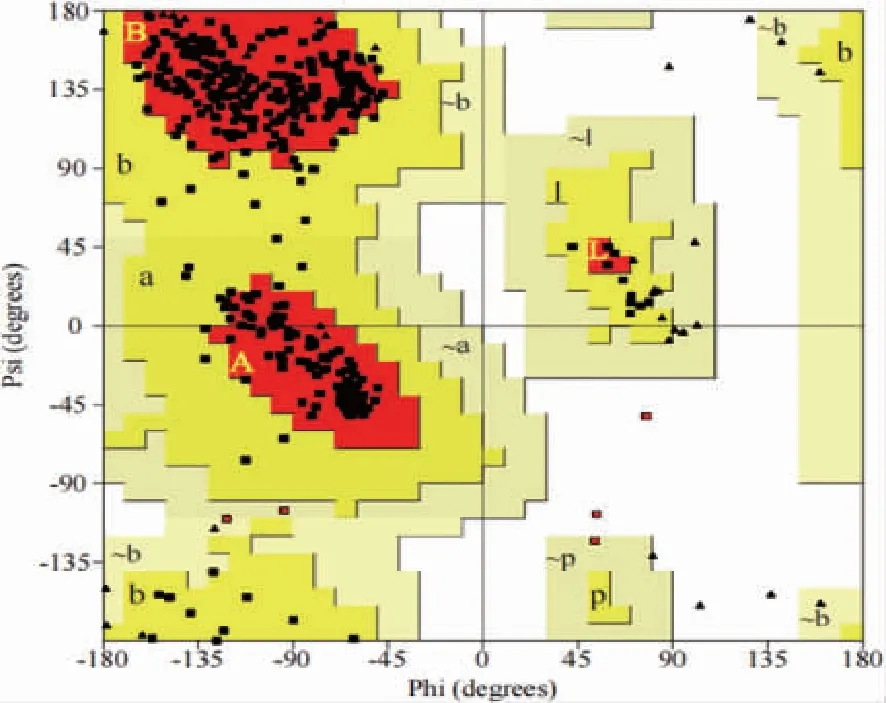
Psi、Phi:3D结构中肽键内α碳原子和羰基碳原子间键的旋转度及α碳原子和氮原子间的键的旋转度;■▲ :氨基酸残基;红色、亮黄色、淡黄色和白色区域分别代表氨基酸残基分布的核心区、额外允许区、大致允许区、不允许区。图1 A/Kansas/14/2017 HA模型的Ramachandran
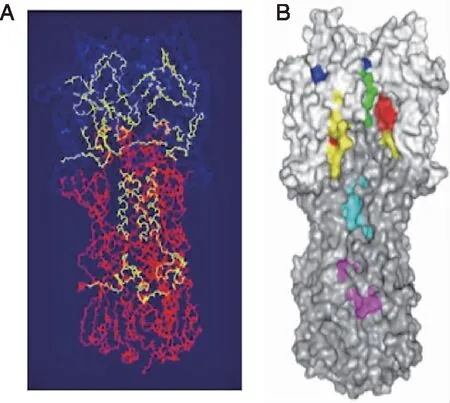
A:保守表位;蓝色为HA头部,红色为HA杆部,黄色为保守表位;B:6个高保守表位;每种颜色代表一个表位。图2 保守Th表位在 HA的定位

表2 6个高保守Th表位的特征
2.3 保守Th表位与H7N9 HA的同源性 通过在线工具分析6个高保守表位与GISAID库中的1 387个H7N9 HA氨基酸序列的同源性,发现位于HA头部的4个表位(E1~ E4)与H7N9的同源仅为26.67%~40.00%,4个头部表位与A/Anhui/1/2013 HA的同源性为26.67%~33.33%;位于杆部的2个表位(E5、E6)与A/Anhui/1/2013的同源性分别为80.00%、66.67%,表明H3N2保守Th表位与H7N9同源性较差。
2.4 保守Th表位对CD4+T细胞活化及分化的影响 PBMC经6条保守Th表位(E1~E6)单独刺激24 h后,流式细胞仪分析结果显示,各实验组CD4+CD69+T细胞比例明显高于IL-2对照组,表明来源于H3N2病毒HA的6条保守Th表位均能激活CD4+T细胞,具有免疫原性。与IL-2对照组比较,保守表位刺激后各实验组CD4+IFN-γ+T细胞和CD4+IL-4+T细胞比例明显增加,表明6条保守的H3Th表位均能诱导CD4+T细胞分化为Th1和Th2细胞,后者分泌IFN-γ或IL-4(图3)。
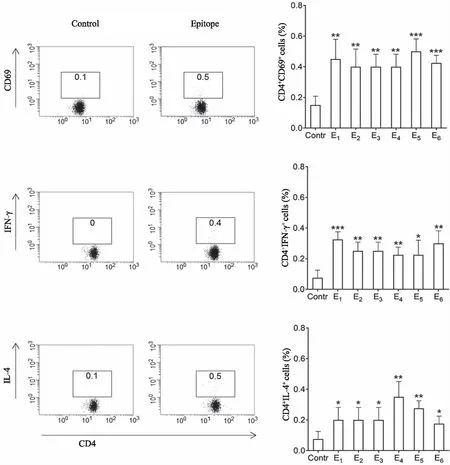
*、**、***:与IL-2对照组比较,P< 0.05, P< 0.01 ,P< 0.001。 图3 保守Th表位诱导CD4+ T细胞活化与分化
3 讨论
CD4+T细胞抗原表位(Th表位)通常由13~17个氨基酸残基组成。CD4+T细胞识别与主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类分子结合的表位。直接参与结合MHC-Ⅱ类分子的核心肽序列通常由9个氨基酸残基组成。HLA-DRB1为已知的人类最常见的与流感病毒HA结合的MHC-Ⅱ类分子[8-9]。本实验采用在人群中覆盖率较高的11个HLA-DRB1基因型,通过表位预测软件从2019-2020年度H3N2疫苗株A/Kansas/14/2017HA共筛选出48个阳性预测表位。利用保守表位在线分析软件从48个阳性预测表位中筛选到33个保守表位,大多数保守Th表位位于HA头部。
CD4+T细胞受抗原刺激后分化为效应性Th细胞,分泌IL-4、IL-21等细胞因子,辅助B细胞产生抗体。Wilkinson等[10]研究发现,H3N2病毒感染后第7天,人外周血中流感特异性T细胞数量大大增加,流感病毒反应性CD4+T细胞与病毒减少、症状减轻有关。Nienen等[11]报道,流感疫苗接种后第7天,外周血CD4+记忆T细胞数量明显增多,且记忆T细胞数量与疫苗诱导的抗体滴度的增加呈正相关。HA是流感病毒的主要抗原,不同亚型流感病毒之间HA的差异较大。Duvvuri等[12]报道,H7N9病毒HA的氨基酸序列与其他甲型流感病毒如H1N1、H2N2、H3N2等的相似性仅为39.2%~41.6%,远远低于内部蛋白PB1、PB2、PA、M1(相似性>90%),导致其抗原性出现较大差异。本研究发现H3N2病毒A/Kansas/14/2017 HA上33个保守Th表位中仅1个存在于A/Anhui/1/2013 H7N9病毒,与Duvvuri等[12]报道一致。这可能与H7N9免疫原性较弱有关。
反复流感病毒暴露或疫苗接种导致机体存在HA特异性记忆T细胞,选择性激活HA特异性CD4+记忆T细胞可增强机体对弱免疫原性HA的抗体应答[13]。因此,在接种H7N9或H3杆部疫苗时引入保守H3 Th表位激活CD4+记忆T细胞有助于抗体的产生。本研究根据Th表位亲和力、保守性以及核心序列的位置,最后筛选出6个高保守Th表位,其中杆部表位E5(QTRGIFGAIAGFIEN)在H7-HA中同源性最好,推测可能是因为包含融合肽序列,融合肽序列在HA蛋白中高度保守。经体外刺激实验证实,6个保守Th表位单独使用均可刺激健康人外周血CD4+T细胞活化及分化,细胞表面CD69分子表达增高,细胞因子IFN-γ和IL-4分泌增加。IL-4主要由Th2细胞分泌,可促进B细胞活化、增殖及产生抗体[14-16]。
本研究通过生物信息学的方法从H3N2病毒HA筛选到33个保守Th表位,人工合成6 个无重叠的高保守表位,经体外实验证实6个保守表位均可刺激Th细胞活化及分化,表明本研究筛选得到的保守H3Th表位可作为抗原诱导体内预先存在的CD4+记忆T细胞分化为Th细胞,为后续新型通用流感疫苗的研究提供思路与方向。



