余曦 张莹 颜桂兰 唐祥蜀
(1.贵州省人民医院急诊外科;2.贵州省人民医院肝胆外科,贵州 贵阳 550002)
雷帕霉素对肝脏缺血-再灌注中线粒体DNA D-Loop区的修复作用
余曦1张莹2△颜桂兰2唐祥蜀2
(1.贵州省人民医院急诊外科;2.贵州省人民医院肝胆外科,贵州 贵阳 550002)
目的 研究大鼠肝脏缺血-再灌注(HIRI)损伤中mtDNA的损伤机制及雷帕霉素对其的修复作用。方法 SD大鼠60只,制作大鼠肝脏缺血-再灌注模型,分为A、B、C、D四组;A组:肝脏缺血30 min处理;B组:缺血50 min处理;C组:缺血50 min并雷帕霉素干预处理;D组:假手术组。分别于术后24 h、3 d、5 d处死,取部分肝组织进行线粒体DNA D-Loop区进行PCR扩增、测序,与GENBANK参考序列对比查找变异位点。结果 在HIRI中存在DNA D-Loop区突变,其中C组大鼠mtDNA D-Loop区突变率低于B组(P<0.05)。结论 HIRI中mtDNA D-Loop区产生突变,而雷帕霉素可能通过降低线粒体DNA D-Loop区突变率而减轻其氧化损伤,从而对肝脏缺血-再灌注损伤过程产生保护作用。
肝脏; 缺血-再灌注; 线粒体DNA D-Loop; 雷帕霉素; 大鼠
肝脏缺血-再灌注损伤(HIRI)是临床上肝脏外科常见的病理生理过程,如何减轻HIRI对肝细胞的损伤,保护肝功能,防止肝衰竭一直是国内外研究者十分关注的课题[1]。线粒体是细胞内除细胞核以外唯一含有DNA的细胞器,随着对线粒体DNA(mtDNA)的深入研究,发现多种疾病与mtDNA突变相关,但对于HIRI中mtDNA突变的研究较少,我们通过建立大鼠HIRI模型,对mtDNA D-Loop区进行测序,分析其变异位点,了解HIRI时mtDNA D-Loop区的突变情况,并探讨雷帕霉素对HIRI中mtDNA D-Loop突变位点的修复作用。
1 材料与方法
1.1 材料 由第三军医大学实验动物中心提供SPF级雄性SD大鼠(n=60),体质量200~250 g,术前12 h禁食,自由饮水。以灭菌药用蓖麻油配制浓度为0.345 mg/mL的雷帕霉素溶液用于灌胃。基因组DNA提取试剂盒由北京天更生物提供。
1.2 方法
1.2.1 实验动物与造模 60只动物随机分为四组,乙醚气体麻醉,无菌条件下参照Pringle’s[2]法制作大鼠肝脏HIRI模型,切开腹壁后找到第一肝门,以血管夹夹闭,以肝脏表面出现瘀斑为缺血成功表现。A组(18只):肝脏缺血30 min恢复血供;B组(18只):肝脏缺血50 min恢复血供;C组(18只):肝脏缺血50 min恢复血供;D组(6只):假手术对照组:仅翻动肝脏随即关腹。其中C组在术前3 d和术后用雷帕霉素[1.5 mg/(kg·d)]灌胃,而A组和B组在术前3 d和术后每日仅用灭菌药用蓖麻油1 mL灌胃1次。各组大鼠于术后24 h、3 d、5 d三个时间点分别处死1/3,取部分肝组织于液氮保存。
1.2.2 肝脏组织基因组DNA的提取 取肝脏组织15 mg按试剂盒说明提取肝脏组织基因组DNA,分光光度计测定260 nm和280 nm处吸光度(A)值,A260/A280值在1.8~2.0者用于PCR扩增。
1.2.3 肝脏组织基因组DNA PCR扩增 通过Primer3 Output软件设计引物:F:5-ACA TTA AAT TAT TTT CCC CAA GCA-3’;R:5-TTG GTG TAT GTG GAA TTT TCT GA-3’扩增长度850 bp。由上海生工生物技术有限公司合成。取2 μL基因组DNA溶液进行PCR反应,PCR反应体:ddH2O 10 μL Mix(含Mg2+)13 μL上、下游引物(0.5 μg/μL)各1 μL,DNA模板1 μL,94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环,72 ℃延伸10 min,4 ℃终止。取5 μL PCR产物进行电泳,制备2%琼脂糖凝胶,用移液器取5 μL上述PCR产物与1 μL上样缓冲液混匀后点样,DL2000 Marker用量5 μL,120 V,40 min后置凝胶成像仪下成像。
1.2.4 测序 上述剩余PCR产物4 ℃保存,取PCR产物送上海生工生物有限公司纯化、测序。将结果与NCBI GENBANK参考序列(X04734.1)对比查找变异位点。测序结果所得突变率利用SPSS19.0软件分析,应用卡方检验方法分析结果。
2 结 果
2.1 mtDNA D-Loop区PCR产物扩增结果 各PCR产物于琼脂凝胶中电泳、成像,可见条带清晰明亮、完全、整齐,纯度较高,无降解及杂质、及拖带现象产生,特异性扩增产物大小为850 bp左右(图1)。
注:M.marker;1~4.为术后5 d A、B、C、D四组条带;5~8.为术后3 d A、B、C、D四组条带;9~12.为术后1d A、B、C、D四组条带。图1 各组大鼠肝脏mtDNA D-loop区PCR产物扩增凝胶成像图
2.2 各组大鼠肝脏组织mtDNA D-Loop区核苷酸变异情况 各组mtDNA D-Loop区测序结果与GENBANK参考序列通过MegAlign软件进行对比后共发现2个点缺失、51个点突变、8个插入及1个片段缺失共62个变异位点,而D组也发现有7个位点与参考序列有差异,此现象我们考虑为mtDNA D-Loop的多态性,剩余发现的核苷酸变异我们考虑为HIRI所致,见表1。B组突变率较A、C组明显升高(P<0.05)。
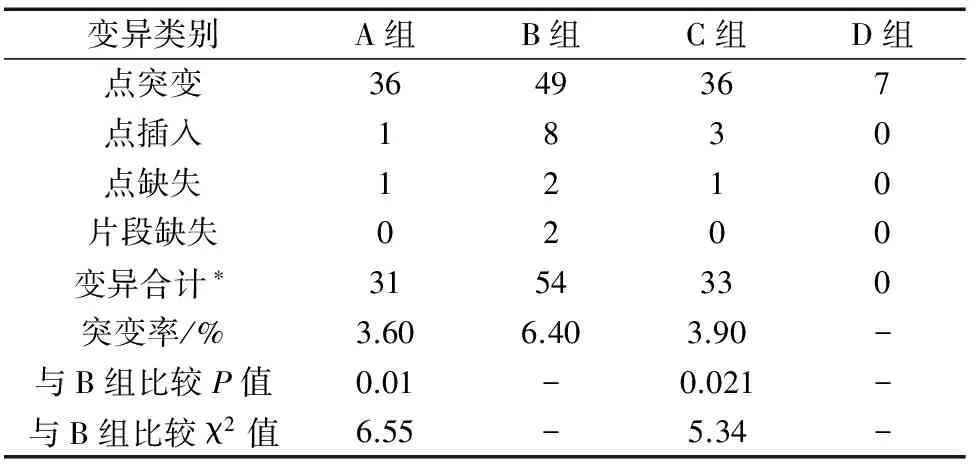
表1 各组大鼠mtDNA D-Loop区测序结果
注:*此处合计为减去D组7个考虑为多态性后剩余变异数目。
3 讨 论
线粒体是细胞能量代谢的关键场所[3],缺血、缺氧等因素均可引起线粒体结构、功能的异常,导致细胞能量代谢障碍并引起其他细胞器乃至整个细胞、组织的变化。细胞中活性氧(ROS)的大量产生可导致DNA片段化从而造成DNA损伤[4],而mt DNA相对核DNA其缺乏组蛋白的保护以及有效的DNA损伤修复系统,并且mtDNA长期暴露于ROS中,使得mt DNA比核DNA更容易损伤,其损伤将直接引起线粒体ATP生成减少,从而加剧细胞损伤[5]。研究[6]表明,肝细胞mtDNA的损伤在HIRI中起重要作用,大鼠mtDNA D-Loop长度为901 bp,mtDNA复制的起始位点及转录的启动子便位于其中,可调控mtDNA的复制、转录[7],mtDNA D-Loop区的突变可能会影响mtDNA的复制,该区也是mtDNA突变的热点部分[8],所以我们选择D-Loop区作为研究对象。
雷帕霉素目前作为免疫抑制剂广泛应用于临床,但在缺血-再灌注损伤中是否存在保护机制尚有争论。雷帕霉素可保护线粒体的结构、功能,研究[9]表明雷帕霉素可提高缺氧状态中线粒体内呼吸酶的活性并减少氧自由基的产生从而增强线粒体的呼吸作用,T.Pan[10]等的研究表明雷帕霉素可减轻乳胞素引起的细胞变性凋亡,减轻线粒体损伤。Y.Dai[11]等的研究表明雷帕霉素可用于治疗mtDNA突变的相关疾病。
通过本研究发现,在HIRI中,在mt DNA D-loop区内共发现62个变异位点,其中B组每例大鼠测序结果都出现变异,显示该区域的多态性且具有高度突变性,同时也说明mtDNA的损伤对缺血、缺氧极为敏感,并且肝脏缺血时间越长,基因突变率越高,而在D组(即对照组)并未发现以上突变,说明我们所发现的mtDNA突变为致病突变。现有研究[12]已证实,ROS可以影响DNA的稳定性,并导致高活性的DNA碱基如鸟嘌呤的损伤,是许多疾病产生的原因之一。在HIRI中,造成肝功能损害的一个重要原因即是ROS,线粒体即为ROS产生的关键场所。所以通过本研究,我们考虑,缺血缺氧首先引起线粒体功能障碍,继而产生能量代谢障碍,使细胞内生成大量ROS,而高水平的ROS可造成DNA链断裂、碱基与核糖氧化、碱基缺失,线粒体DNA D-loop的基因突变可对mtDNA的拷贝产生影响,可能导致编码区突变,从而引起相应蛋白质合成改变;还有研究[13]认为,正常细胞的mtDNA转录水平降低提高了细胞的凋亡水平,发生程序性死亡。而mtDNA D-Loop区的突变势必影响mtDNA的转录、复制水平,进而进一步加剧对肝细胞、组织的损伤。我们的研究发现,应用雷帕霉素干预,mt DNA D-Loop区基因突变率明显下降,其可能机制为,雷帕霉素可通过维持线粒体的结构及功能,减少缺血-再灌注中缺氧所带来的ROS等呼吸链功能的障碍所造成的细胞凋亡,并通过降低缺血缺氧时DNA的突变率,维持线粒体的功能,从而减轻缺血-再灌注中肝脏细胞的损伤程度。
而mtDNA D-Loop区基因突变后会对相应的tRNA造成什么样的影响,以及影响了哪些编码区DNA的拷贝,并造成相应的蛋白表达异常,值得我们进一步深入研究。
[1] Rao J,Qin J,Qian X,et al.Lipopolysaccharide Preconditioning Protects Hepatocytes from Ischemia/Reperfusion Injury(IRI)through Inhibiting ATF4-CHOP Pathway in mice[J].PLOS ONE,2013,6:e65568.
[2] Pannen BH,Al-Adili F,BauerM,et al.Role of endothelinsand nitric oxide in hepatic reperfusion injury in the rat[J].Hepa-tology,1998,3:755-764.
[3] 张莹,范伟,张玉,等.移植肝冷保存-再灌注过程中线粒体Ⅴ复合体蛋白表达与肝细胞凋亡的关系[J].第三军医大学学报,2012,34(12):1247-1249.
[4] 韩丽红,闫斌,于跃利.胃癌线粒体DNA D-loop区碱基突变的检测分析[J].当代医学,2011,17(34):34-36.
[5] 陈萍,董学斌,赵红玉,等.急性白血病患者线粒体DNA D-loop区突变的临床研究[J].临床血液学杂志,2014,27(3):371-374.
[6] 张莹,别平,石承先.线粒体ATPase6、8基因及编码蛋白表达改变对移植肝脏能量代谢的影响[J].中华医学杂志,2010,90(10):708-711.
[7] 马佳,陈治文,梅传忠,等.淋巴瘤组织中线粒体DNA突变的研究[J].华中科技大学学报(医学版),2010,39(2):202-206.
[8] Guo W,Yang D,Xu H,et al.Mutations in the D-Loop region and increased copy number of mitochondrial DNA in human laryngeal squamous cell carcinoma[J].Molecular biology reports,2013,1:13-20.
[9] Villa C E,Holmbeck MA,Rand DM.Rapamycin increases mitochondrial efficiency by mtDNA-dependent reprogram ming of mitochondrial metabolism in Drosophila[J].J Cell Sci,2014,127,10:2282-2290.
[10] Pan T,Rawal P,Wu Y,et al.Rapamycin protects against rotenone-induced apoptosis through autophagy induction[J].Neuroscience,2009,2:541-551.
[11] Dai Y,Zheng K,Clark J.Rapamycin drives selection against a pathogenic heteroplasmic mitochondrial DNA mutation[J].Hum Mol Genet,2014,3:637-647.
[12] Markkanen E,Hübscher U,Loon BV.Regulation of oxidative DNA damage repair:The adenine:8-oxo-guanine problem[J].Cell Cycle,2012,6:1070-1075.
[13] 陈飞雄,申林娜,蒲军,等.线粒体DNA编码蛋白质亚基的研究[J].中国医药指南,2011,9(1):6-7.
Recovery effect of rapamycin to mitochondrial DNA D-Loop in liver iachemia
YuXi1,ZhangYing2,YanGuilan2,TangXiangshu2.
1.DepartmentofEmergencySurgery,Guiyang550002,China. 2.DepartmentofHepatobiliarySurgery,GuizhouProvincialPeoole'sHospital,Guiyang550002,China.
Objective To evaluate the hepatic ischemia-reperfusion injury in rats of mitochondrial DNA damage and rapamycin to its repair effect. Methods To be established the whole liver ischemia-reperfusion injury in rats model, and divided into four groups which were group A (ischemia 30 min group), Group B (ischemia 50 min group), Group C (preoperative rapamycin lavage, 50 min of ischemia group), and Group D (control group). 24 h after surgery, 3, 5 days respectively execution groups of animals, take part in liver mitochondrial DNA D kit instructions-Loop area for amplification and product sequencing, compared with GENBANK reference sequence search mutation loci. Results Group C mitochondrial DNA D-Loop area mutation rate was lower than that in group B (P< 0.05). Conclusion Liver ischemia-reperfusion injury of mutations in mitochondrial DNA D-Loop area, rapamycin could alleviate the liver ischemia0reperfusion injury, its mechanism may be through reduced mitochondrial DNA D-Loop area mutation rate so as to reduce the oxidative damage, which produces the process of liver ischemia-reperfusion injury protection.
Liver; Ischemia-reperfusion injury; Mitochondrial DNA D-Loop; Rapamycin; Rats
贵州省科技厅专项基金[黔科合J(2008)-2302];贵州省优秀青年科技人才基金[黔科合人字(2011)29]
R-332,R575
A
1000-744X(2016)03-0230-03
2015-10-03)
△通信作者,E-mail:zhangyingdoc@163.com



