谢禹然,钟瑜红,张占义,杨静思,张梦婷,罗年华
(1. 赣南医学院药学院;2. 赣南医学院教务处,江西 赣州 341000)
烯丙胺是一类具有代表性的重要分子骨架,广泛存在于许多具有生理活性的天然产物和药物分子中[1-3],也是一些重要的关环复分解反应中的合成骨架[4]。另外,烯丙胺的双键还可以被氧化、还原等,能够合成一些具有重要生理活性的α 或β-氨基酸及生物碱等,因此烯丙胺的合成已成为当今研究的一个热点。
萘替芬是上市的第一个烯丙胺类广谱抗真菌药[5],临床上用于治疗皮肤真菌感染,如体股癣、手足癣、头癣、甲癣、花斑癣、浅表念珠菌病等,其疗效优于发癣退、克霉唑、美康唑和益康唑等,毒性较低[6-7]。与咪唑类抗真菌药不同,它选择性地作用于真菌麦角甾醇的生物合成,即使达到高浓度也不影响肝脏的药物代谢[8]。
作为与人类休戚相关的重要药物,萘替芬的合成一直是研究的热点。目前,该药物的合成主要有以下几种方法:⑴经典合成法:取代萘苄胺与苯乙酮在四氢硼钠存在下发生反应得萘替芬[9];⑵肉桂醛法:肉桂醛与1-萘甲胺发生缩合反应生成Schiff碱,用硼氢化钠还原为仲胺后,与甲醛发生N-还原甲基化反应制得目标产物[10];⑶肉桂基氯法:在室温下,由肉桂基氯与N-甲基-1-萘甲胺进行取代反应得抗真菌药物萘替芬[11];⑷相转移催化合成盐酸萘替芬:萘在多聚甲醛、冰醋酸和磷酸存在下进行氯甲基化反应制备1-氯甲基萘,再与甲胺反应得N-甲基-1-萘甲基胺,然后苯乙烯与甲醛和盐酸反应生成3-氯-苯丙烯,再与N-甲基-1-萘甲基胺发生N-烃基化反应合成萘替芬[12]。上述方法存在一些不足,如:经典合成法中生成的亚胺中间体不稳定,导致产率不高;肉桂醛法形成仲氨副产物较多导致成本较高;肉桂基氯法一般由肉桂醇与浓盐酸反应制备中间体肉桂基氯,而肉桂基氯易水解,导致反应不易完全,副产物较多,难以分离纯化。因此,发展一种简便、高效的制备萘替芬类化合物的方法具有重要理论和现实意义。
近年来,由于金属催化借氢反应具有原子经济性高、操作简单等优点,成为最受关注的催化反应之一[13-14]。环金属铱催化剂在氢转移反应中是一类非常有效的金属催化剂,在不同底物的氢转移反应中表现出很好的催化效率与选择性,由于铱催化剂对空气稳定且易合成[15],已成为研究热点。此外,该类催化剂的水溶性好,能够用水作溶剂,反应符合绿色要求[16-19]。
本课题组从事环金属铱催化剂合成及其催化反应研究,并取得了一些研究结果[16-20]。结合课题组前期的研究结果[16-20]及烯丙胺类化合物(如萘替芬)的重要性,我们对环金属铱催化肉桂醇与二级胺类的氢转移反应进行了研究。以1.0 mmol肉桂醇1和1.1 mmol 二级胺2 为原料,以KOH(1.2 mmol)为碱,1.0 mmol%环金属铱为催化剂,2 mL水为反应溶剂,在100 ℃下搅拌反应,以高收率获得了烯丙胺类化合物3(图1)。并将所发展的氢转移反应用于抗真菌药萘替芬的合成,为其工业化合成提供理论和方法学支持。
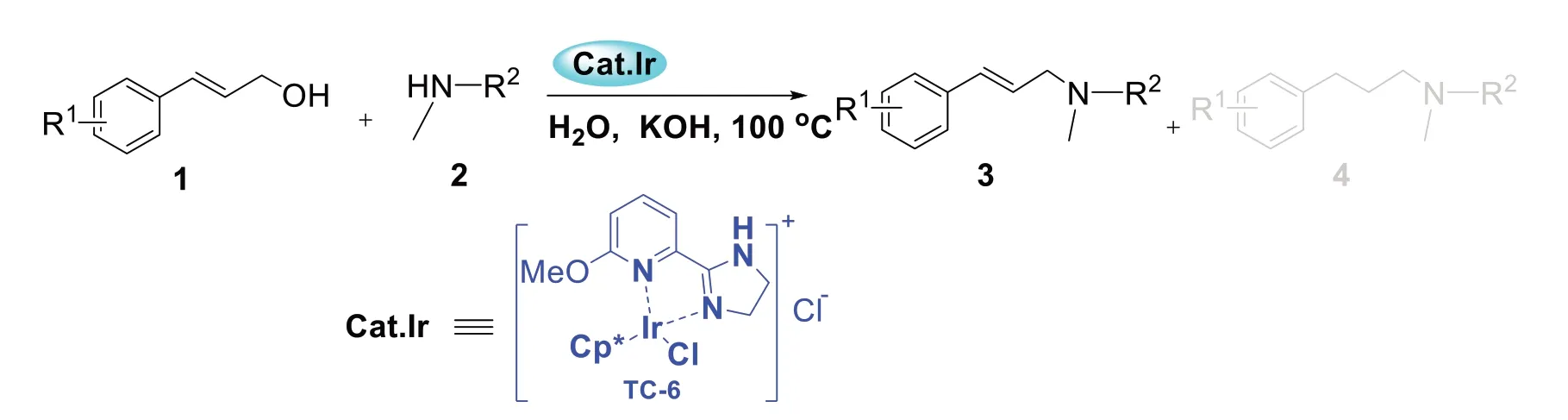
图1 铱催化肉桂醇和二级胺氢转移反应合成烯丙胺类化合物
1 材料与方法
1.1 仪器与试剂X-6精密显微熔点测定仪(北京亚力恩机电技术研究院);Bruker Avance 400核磁共振仪(德国Bruker公司,TMS为内标,CDCl3为溶剂);Agilent Techologies 5975C型质谱仪(美国安捷伦公司)。
如未经注明,溶剂为化学纯。肉桂醇、2-氯肉桂醇、3-氯肉桂醇、4-氯肉桂醇、N-甲基苯胺、1-萘胺、N-甲基-1-萘胺等购自阿拉丁试剂公司,纯度≥98%;石油醚(PE,60~90 ℃)、乙酸乙酯和CH2Cl2等试剂为分析纯;柱层析硅胶(200~300 目)购自青岛海洋化工有限公司。环金属铱催化剂的合成参考文献[21]。
1.2 合成与表征10 mL Schlenk 管中,依次加入肉桂醇1a(1.0 mmol)、N-甲基苯胺2a(1.1 mmol)、KOH(1.2 mmol),环金属铱TC-6(1.0 mmol%),水(2 mL)于100 ℃下反应8 h。反应结束后,反应混合物用乙酸乙酯(3×10 mL)萃取,然后合并有机层,无水硫酸镁干燥后,旋干溶剂得到粗产物,经柱层析[V(石油醚)/V(乙酸乙酯)=50/1]纯化,得纯产物3aa。
其他产物的合成参照3aa的步骤进行。
N-肉桂基-N-甲基苯胺(3aa):无色油状液体,产量:209.7 mg,产率:94%。1H NMR (400 MHz, CDCl3)δ 7.36 - 6.99(m, 8H), 6.68 - 6.54 (m, 3H),6.30 (d,J= 15.9 Hz, 1H), 3.90 (d,J= 5.8 Hz,2H), 2.11 (s, 3H);13C NMR (101 MHz, CDCl3) δ 146.12, 137.02, 131.71, 130.29, 128.76,127.72, 127.33, 126.53, 122.21, 117.36,110.24, 46.33, 17.74. ESI-MS,m/Z: [M+H]+C16H19N 计算值224.15; 测量值224.14 。
N-(2-氯肉桂基)-N-甲基苯胺(3ba):无色油状液体,产量:236.5 mg,产率:92%。1H NMR (400 MHz,CDCl3) δ 7.19 (s, 4H), 7.04 (dd,J= 18.6, 7.5 Hz,3H), 6.60 (dd,J= 15.0, 7.6 Hz, 2H), 6.48 (d,J= 15.9 Hz, 1H), 6.25 (dd,J= 13.6, 7.9 Hz,1H), 3.88 (dd,J= 5.6, 1.2 Hz, 2H), 2.10 (s,3H);13C NMR (101 MHz, CDCl3) δ 145.86,135.39, 133.09, 130.20, 128.72, 127.93,127.59, 127.22, 122.08, 117.30, 110.05,46.05, 17.59. ESI-MS,m/Z:[M+H]+C16H17ClN 计算值258.09;测量值258.10。
N-(3-氯肉桂基)-N-甲基苯胺(3ca):无色油状液体,产量:231.4 mg,产率:90%。1H NMR (400 MHz,CDCl3) δ 7.18 (dt,J= 13.0, 7.4 Hz, 4H), 7.10- 7.06 (m, 1H), 6.94 (dd,J= 8.7, 7.6 Hz,1H), 6.44 (dd,J= 18.1, 11.8 Hz, 2H), 6.33 (d,J= 6.3 Hz, 2H), 6.18 (dd,J= 13.7, 8.0 Hz,1H), 3.76 (dd,J= 5.8, 1.4 Hz, 2H), 2.14 (s,3H);13C NMR (101 MHz, CDCl3) δ 145.15,136.10, 133.96, 128.45, 126.23, 125.64,124.57, 124.22, 123.40, 115.65, 110.91,107.26, 43.30, 18.75. ESI-MS,m/Z:[M+H]+C16H17ClN 计算值 258.09; 测量值258.10。
N-(4-氯肉桂基)-N-甲基苯胺(3da):无色油状液体,产量:244.2 mg,产率:95%。1H NMR (400 MHz,CDCl3) δ 7.29 - 7.18 (m, 5H), 7.07 (d,J= 7.5 Hz,1H), 6.56 - 6.50 (m, 2H), 6.45 (d,J= 6.6 Hz,2H), 6.28 (dd,J= 13.6, 8.0 Hz, 1H), 3.89 (dd,J= 5.6, 1.3 Hz, 2H), 2.26 (s, 3H);13C NMR(101 MHz, CDCl3) δ 148.01, 139.13, 135.43,133.10, 130.12, 129.22, 128.74, 127.96,127.57, 118.72, 113.88, 110.20, 46.15, 21.71.ESI-MS,m/Z:[M+H]+C16H17ClN 计算值258.09; 测量值258.10。
1-(3-苯基氧肉桂基)- 4-苯基哌啶(3bb):无色油状液体,产量:336.9 mg,产率:91%。1H NMR(400 MHz, CDCl3) δ 7.49 (dd,J= 8.2, 1.5 Hz,2H), 7.38 - 7.16 (m, 8H), 6.99 (dt,J= 9.7,4.4 Hz, 3H), 6.88 (dd,J= 8.7, 0.9 Hz, 2H),6.82 (t,J= 7.3 Hz, 1H), 5.38 (t,J= 7.3 Hz,1H), 3.23 - 3.12 (m, 6H), 2.61 - 2.50 (m,4H);13C NMR (101 MHz, CDCl3) δ 156.60,154.55, 151.29, 134.30, 129.57, 129.05,128.76, 128.22, 122.81, 119.71, 118.70,116.08, 110.26, 55.34, 52.98, 49.17. ESI-MS,m/Z:[M+H]+C25H27N2O 计算值371.21; 测量值371.20317.20。
N-肉桂基1-萘胺(3ac):无色油状液体,产量:222.8 mg,产率:86%。1H NMR (400 MHz, CDCl3)δ 7.85 - 7.77(m, 2H), 7.45 - 7.23 (m, 9H),6.68 (dd,J= 11.4, 8.8 Hz, 2H), 6.44 (d,J=15.9 Hz, 1H), 4.10(dd,J= 5.8, 1.2 Hz, 2H);13C NMR (101 MHz, CDCl3) δ 143.27, 136.95,134.46, 132.14, 128.82, 127.79, 126.78,126.54, 125.91, 124.95, 123.65, 120.04,117.84, 105.03, 46.61. ESI-MS,m/Z:[M+H]+C19H18N 计算值260.14; 测量值260.14。
N-肉桂基-N-甲基-1-萘胺(3ad):无色油状液体,产量:254.0 mg,产率:93%。1H NMR (400 MHz,CDCl3) δ 8.26 (d,J= 8.4 Hz, 1H), 7.79 - 7.74(m, 1H), 7.69 (d,J= 8.0 Hz, 1H), 7.48 - 7.30(m, 6H), 7.18 (dd,J= 28.0, 7.5 Hz, 3H), 6.50(d,J= 15.9 Hz, 1H), 6.30 (dt,J= 15.9, 6.6 Hz,1H), 3.86 (s, 2H), 3.19 (dd,J= 6.6, 1.0 Hz,2H), 2.20 (s, 3H);13C NMR (101 MHz, CDCl3) δ 137.29, 135.06, 134.08, 132.76, 132.75,128.68, 128.67, 128.14, 127.88, 127.87,126.50, 126.07, 125.77, 125.30, 124.85,60.56, 60.31, 42.65. ESI-MS,m/Z:[M+H]+C20H20N 计算值274.15; 测量值274.16。
2 结果与讨论
2.1 条件筛选以肉桂醇1a 与N-甲基苯胺2a 的反应为模板,甲苯为溶剂,首先筛选了环金属铱催化剂,然后考察溶剂和碱对反应的影响,进而得到最优反应条件。
首先,考察环金属铱催化剂对反应的影响,见表1。结果表明,催化剂上取代基的电负性对反应有较大的影响。当催化剂连有给电子基团时,反应的选择性和收率更好(表1 行2,4,6),反之,当催化剂连有吸电子基团时,反应选择性和收率降低(表1行3,5),当催化剂为环金属铱TC-6 时,反应获得了最好的产率和选择性(表1 行6)。进一步考察了反应时间对反应的影响,发现随着时间减少,反应的基选择性和收率都下降(表1行7),而没有使用催化剂时,反应也能进行,但收率和选择性很差(表1行8)。
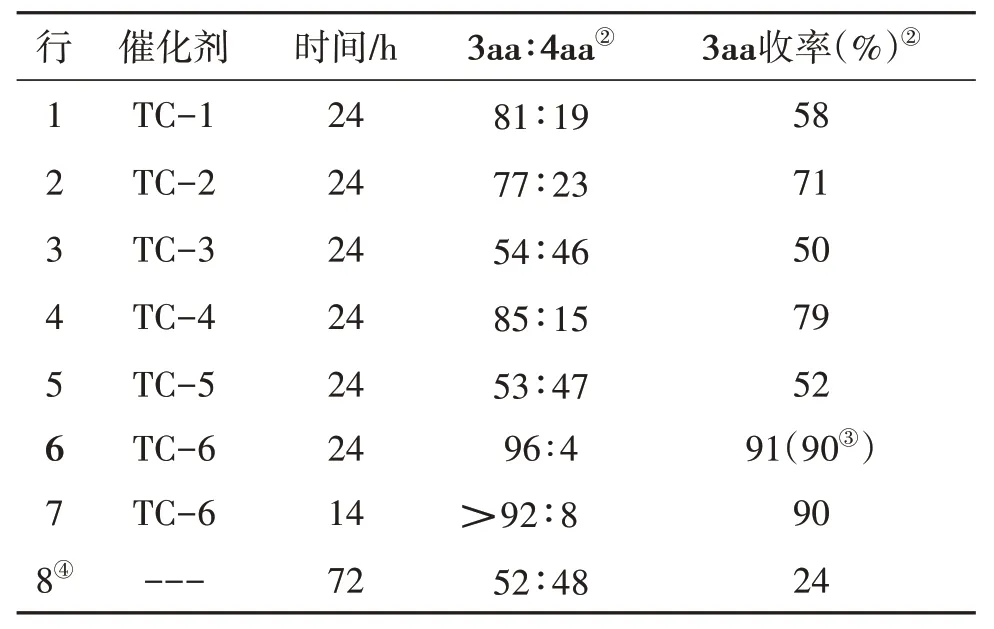
表1 催化剂的筛选①
以环金属铱TC-6 为催化剂,考察碱的种类和用量对反应的影响,见表2。结果表明,不同碱对反应的影响较大,一般钾盐比钠盐的反应结果更好(表2 行1~9)。以KOH 为碱,反应的选择性和收率最好(表2 行9)。随后研究了KOH 用量的影响,发现当使用1.2 mmol 的KOH 时,反应的选择性和收率最好(表2 行10);而减少KOH 的用量,反应的选择性和收率都下降(表2行11)。
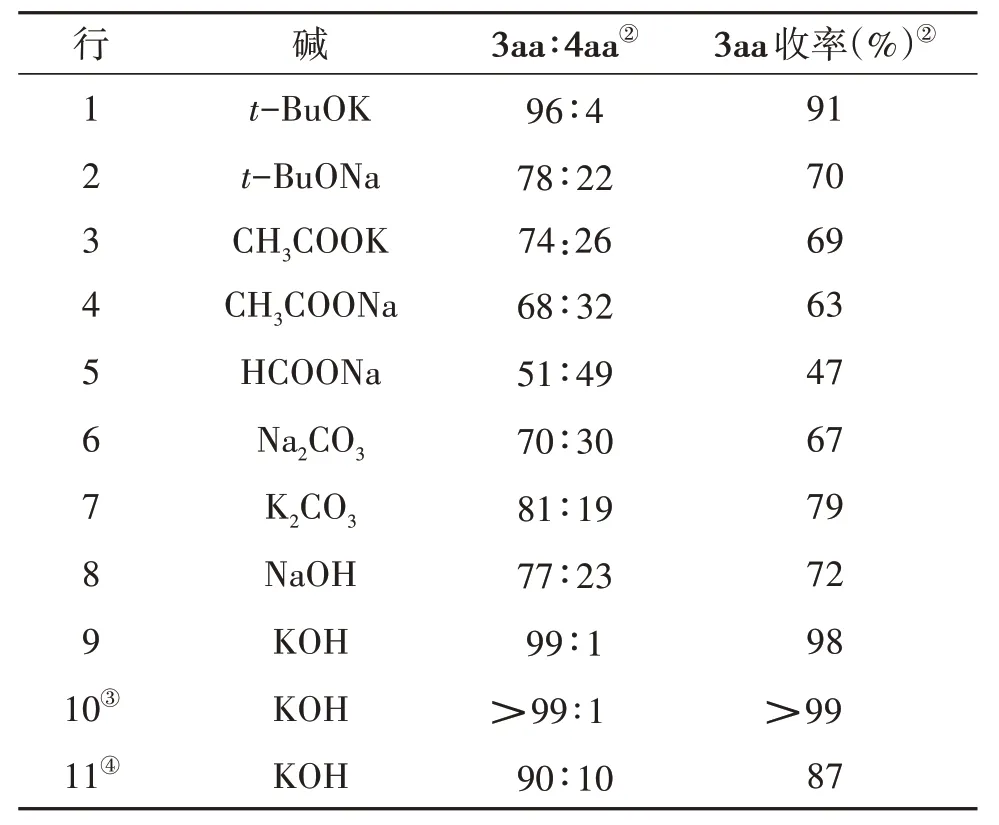
表2 碱的筛选①
以TC-6 为催化剂,KOH(1.2 mmol)为碱,考察了溶剂对反应的影响,见表3。结果表明,不同溶剂对反应的影响很大,有机溶剂的极性小对反应有利,如以甲苯作溶剂,反应的选择性和收率最好(表3 行1~5)。研究发现,水能有效促进肉桂醇1a 与N-甲基苯胺2a 的氢转移反应[16],且使反应时间明显缩短(表3 行6)。在水相中,进一步考察了温度对反应的影响,发现温度降低,反应的选择性和收率下降(表3 行7)。综上,最优的反应条件为:TC-6(1.0 mmol%)为催化剂,KOH(1.2 mmol)为碱,水为溶剂。

表3 溶剂的筛选①
在最优反应条件下,拓展了底物的适用范围,见表4。结果表明,底物苯环上取代基的电负性对反应的影响较显着,当取代基为吸电子基团时,反应获得了更好的收率和选择性(表4行2~7)。肉桂醇苯环上取代基的位置对反应也有影响,当取代在苯环间位时,反应的选择性和收率下降,而取代基在苯环邻位或对位时,反应获得了更好的选择性和收率(表4行2~7)。

表4 底物拓展①
在最优反应条件下,进一步验证了环金属铱TC-6 的催化性能性,考察了该反应的克级规模反应,以高收率(92%)和高选择性(99∶1)合成了抗真菌药萘替芬3ad(图2)。

图2 肉桂醇1a与N-甲基-1-萘胺2d的克级反应
3 结论
本实验研究了环金属铱催化取代肉桂醇与二级胺的氢转移反应。分别对环金属铱催化剂、碱和溶剂进行了筛选,发现TC-6 为最好的催化剂、水为最好的溶剂、KOH 为最好的碱。以环金属铱TC-6(1.0 mmol%)为催化剂,KOH(1.2 mmol)为碱,水(2 mL)为溶剂,反应以高达95%的收率和选择性(>99∶1)合成了一系列烯丙胺类化合物3。并且该反应可用于抗真菌药萘替芬的合成,且可达到克级规模,为萘替芬的工业化合成提供理论和技术支持。



