唐运莲,苏 琦,程爱兰,王丽江,张 杨,胡果宇,甘润良
(南华大学肿瘤研究所,湖南衡阳421001)
肿瘤的发生、发展与染色体基因的改变有密切的关系,高频率杂合性缺失(loss of heterozygosity,LOH)是人类恶性肿瘤的发生和发展密切相关的抑癌基因(TSG)存在的标志,而LOH是导致TSG失活的重要机制之一[1-2]。近年来,染色体7q LOH越来越受到研究者的关注,发现7q31.1区域LOH在多种人类肿瘤,如卵巢癌、胰腺癌、前列腺癌等中频繁出现[3-5],提示该区域可能存在与人类肿瘤发生、发展相关的TSG。本课题选择覆盖染色体7q31.1上的7个高密度微卫星位点,并结合PCR技术,检测胃癌染色体 7q31.1区域的 LOH,进一步研究胃癌的分子遗传学改变。
1 材料与方法
1.1 材料
1.1.1 胃癌配对标本 标本来自南华大学附属第一医院,收集2002年1月至2003年12月的胃癌及相应配对的正常胃黏膜石蜡包埋标本30例。所有胃癌病例均经病理学检查确诊。胃窦部12例,胃体部14例,胃底或贲门部4例;高分化腺癌5例,低分化腺癌15例,黏液癌6例,印戒细胞癌4例;早期胃癌2例,进展期胃癌28例;有淋巴结转移11例,无淋巴结转移19例。胃癌患者中,男 21例,女9例,<50岁 10例,≥50岁20例,平均年龄51.6岁。

表1 7q31.1区域微卫星位点引物序列
1.1.2 试剂 蛋白酶K购于Merck公司(上海生工代理);Chelex-100购于Bio-Rad Laboratory。
1.1.3 引物 选择设计在7q31.1区域的微卫星多态性位点引物7对,共覆盖染色体7q区域的遗传距离为9.3 cm。引物由大连宝生物工程公司合成(表1)。
1.2 实验方法
1.2.1 石蜡切片预处理 将石蜡标本做成10 μ m×10的连续切片。为避免交叉污染,切不同病例的蜡块时,用二甲苯擦洗刀片两遍。第1张与最后1张行HE染色作为对照片,中间其余切片经常规切片脱蜡后,快速伊红染色,室温晾干备用。
1.2.2 显微切割 参照对照片,用Olympus光学显微镜,在10倍物镜下持自制好的切割工具在癌细胞巢、不典型增生病灶周围刻化、切挖直至其与周围组织分离[6]。再将“细针”的尖端蘸一下中性树胶,使其具有黏性,然后将该“细针”渐渐接近被切割的细胞,小心让其表面的胶与被切割的细胞接触,一旦二者接触即抽回“细针”,针尖端黏取的细胞就随之与载玻片分离,紧接着将其移入洁净的1.5 mL EP管中,用于DNA提取。
1.2.3 DNA提取 EP管中,切割下来的细胞经二甲苯脱蜡2次,每次30 min,经无水乙醇然后水化2次,每次30 min。采用Chelex-100法7~8抽提石蜡组织DNA,测定OD值大于1.60符合实验要求。用 200 μ L的5%Chelex提取液[5%Chelex、0.2%SDS 、10 mM T ris(pH 8.0)、0.5 mM EDTA(pH 8.0)]悬浮沉淀,加入 5μL 20 mg/mL蛋白酶K消化,55℃水浴振摇至溶液变澄清。98℃加热10 min,离心取上清液,4℃储存备用。
1.2.4 胃癌染色体7q31.1等位基因LOH检测和分析
1.2.4.1 微卫星位点PCR扩增 PCR反应体系为25 μ L,10×PCR 反应缓 冲液 2.5 μ L,25 mmol/L MgCl21.5 μ L,10 mmol/L dNTP 0.5μ L,10μ mol/L 上、下游引物各 1 μ L,模板2 μ L,5 μ nit/μLTaq 聚合酶 0.25 μ L,余下由灭菌去离子水补足。反应参数为:94℃预变性5 min,94℃变性1 min,54~60.5℃退火45 s,72℃延伸30 s,40个循环,最后72℃延伸10 min。5%Chelex提取液作空白对照,新鲜胃癌组织提取DNA作阳性对照。
1.2.4.2 变性聚丙烯酰胺凝胶电泳 配制8%的变性聚丙烯酰胺凝胶(40%聚丙烯酰胺母液20 mL,尿素 48 g,5×TBE 20 mL,加水至100 mL),每次取10 mL,再加入10%过硫酸铵 50 μ L,TEMED 5 μ L,立即灌胶,1 h左右自然凝固,固定在垂直电泳槽上,冲洗清除加样孔中凝胶碎胶,电泳液1×TBE,120 V,预电泳15 min。取PCR产物10μL加2×甲酰胺上样缓冲液5 μ L,99℃变性 6 min,冰水骤冷,上样。电泳条件:120 V恒压,室温下电泳 2 h。
1.2.4.3 硝酸银染色 电泳完毕,取下聚丙烯酰胺凝胶用蒸馏水漂洗干净 →10%乙醇固定5 min→1%硝酸氧化5 min→0.012 mol/L AgNO3染色 30 min→0.28 mol/L Na2CO3(含0.019%甲醛)显色 →10%冰乙酸终止2 min→清水浸泡,照相。
1.2.4.4 LOH的判断 正常组织的等位基因PCR扩增产物为杂合子时,可提供信息进行LOH分析,肿瘤或癌前病变组织的一对等位基因PCR扩增产物缺少1条或其中1条的相对密度经凝胶图像分析系统测定减少50%者认为是LOH。所有阳性和可疑病例重复实验3次。
1.3 统计学方法 SPSS10.0统计软件进行分析。用四格表确切概率法判断等位基因缺失与肿瘤及癌前病变各临床病理特征的相关性,以P<0.05为差异有统计学意义。
2 结 果
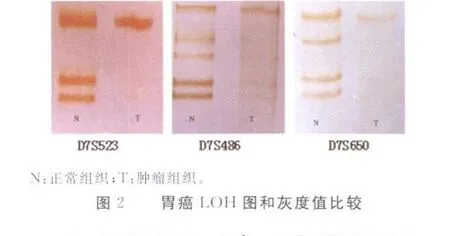
2.1 胃癌染色体7q31.1上 7个微卫星位点PCR扩增和LOH结果 用显微切割的方法从石蜡切片中挑取胃癌细胞行染色体LOH的分析,微卫星位点PCR扩增产物均经1.0%琼脂糖电泳检测(图1)。各位点PCR扩增产物行变性聚丙烯酰胺凝胶电泳和硝酸银染色检测LOH,肿瘤组织的一对等位基因PCR扩增产物缺少1条或其中1条的相对密度经凝胶图像分析系统测定减少50%,证明是LOH(彩插Ⅰ图2)。
2.2 胃癌染色体7q31.1 LOH频率与分布图谱 结果显示,30例胃癌病例中21例至少1个位点存在等位基因的缺失(70.0%)。各位点的等位基因缺失频率分别为:D7S2459 10.0%(3/30),D7S523 6.7%(2/30),D7S2502 23.3%(7/30),D7S486 43.3%(13/30),D7S480 26.7%(8/30),D7S650 26.7%(8/30),D7S2486 20.0%(6/30),其中缺失频率最高的微卫星位点是 D7S486。21 例 LOH 中,病例 3、7、8、10、13、17、19、20、22、27、29等 11例表现为连续性片段缺失,其中病例3在检测的7个位点中有6个位点存在缺失。病例3、8、19、22、29在D7S2502和D7S486两个相邻位点同时存在LOH,说明这两个位点为这些病例的共同缺失区域。病例 3、7、10、13、22、27在D7S486和D7S480两个相邻位点同时存在缺失,表明这两个位点则是这些病例的共同缺失区域。值得注意的是,病例3、22在位点D7S2502、D7S486和 D7S480等 3个相邻的位点均表现为连续性片段缺失(图3)。根据这3个位点都具有较高频率的等位基因缺失,推测胃癌染色体7q31.1区域附近常见最小缺失区域位于D7S2502~D7S480之间,大约3.4 cm遗传距离(图4)。
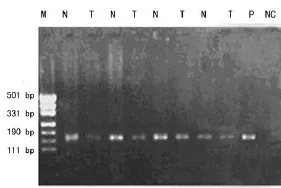
图1 7q31.1微卫星PCR扩增产物琼脂糖凝胶电泳图

图3 胃癌染色体7q31.1等位基因缺失图谱
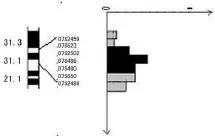
图4 染色体7q31.1区域核型图和各位点LOH频率
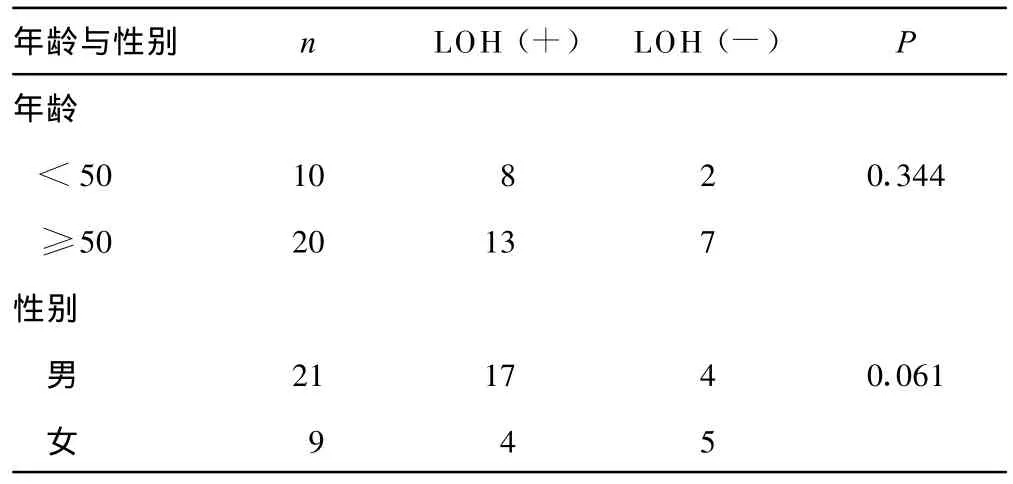
表2 不同年龄、性别胃癌患者7q31.1区域LOH的比较
2.3 胃癌染色体7q31.1 LOH与患者年龄、性别的相关性30例胃癌患者中,两年龄组7q31.1 LOH阳性率差异无统计学意义(P>0.05)。虽然男性阳性率较女性高,但差异无统计学意义(P>0.05),见表2。
2.4 胃癌7q31.1 LOH与部位、分化程度、病理分期及转移的关系 见表3。
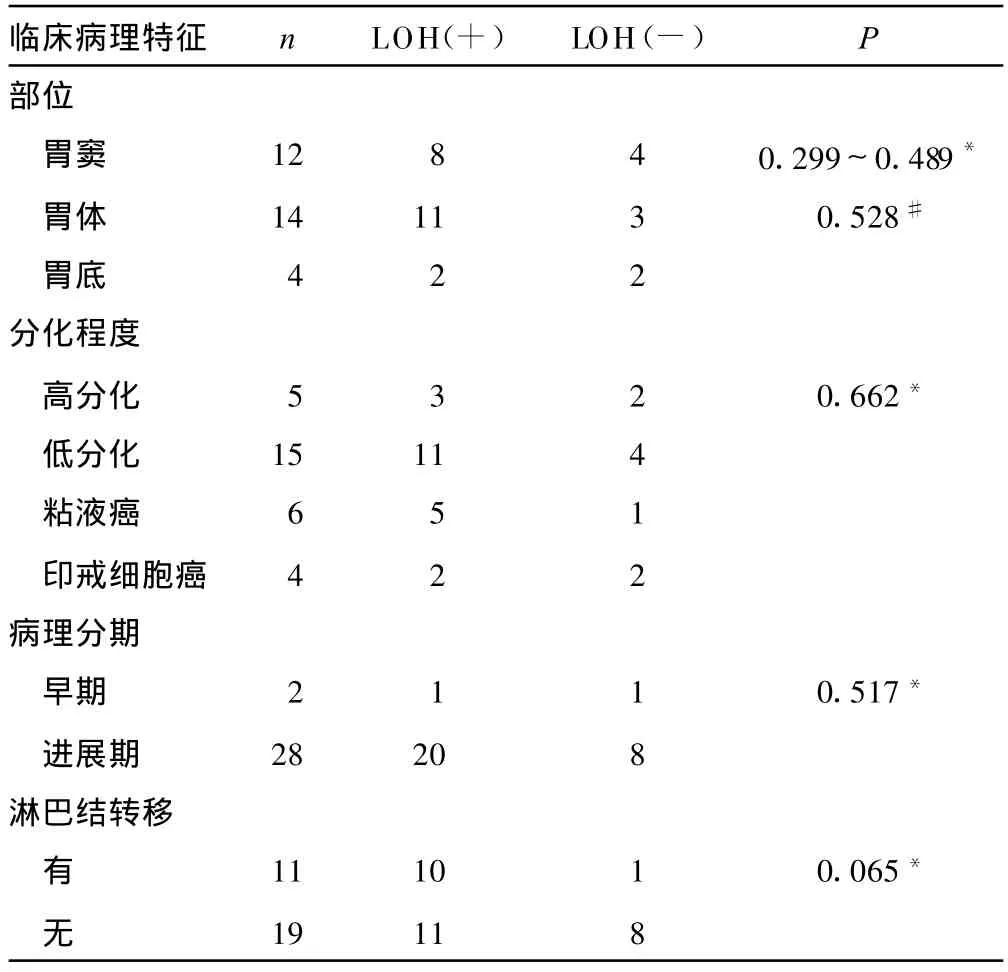
表3 胃癌 7q31.1区域LOH与部位、分化程度、病理分期和转移的关系
3 讨 论
现已证明,绝大多数人类肿瘤都存在非随机的染色体片段缺失,通过分析染色体某区域的微卫星位点LOH图谱,确定其常见最小缺失区域,用所获得的资料作为定位克隆的线索,进而获得目的基因的策略是一项较为成熟的TSG克隆和分析方法,利用该技术策略已成功地分离到 APC、p53、Rb、DCC等TSG。这些TSG活化与胃癌的发生、发展有关[7-9]。
在本研究中,分析了30例胃癌标本在7q31.1区域的等位基因缺失情况,发现至少有一个位点有LOH者占70.0%,常见最小缺失区域位于D7S2502~D7S480之间,本实验结果显示胃癌组织 LOH频率最高的位点是D7S486(43.3%,13/30)。经分析认为染色体7q31.1区域还存在一个与胃癌密切相关的TSG,定位于位点D7S486,它与位于位点 D7S522的肿瘤抑制基因caveolin-1[10-12]可能不是同一基因。这个结论与Zenklusen[13]的研究结果相符,认为染色体7q31.1区域存在阿非迪霉素诱导的脆性位点Fra7G,定位于该位点的基因就是与多种上皮来源的肿瘤相关的TSG,其最小共同缺失区域大约1.5 Mb大小,并且界定于微卫星位点 D7S486和D7S655之间,所以有理由推测位点D7S486上存在一个与胃癌相关的TSG[13]。这为寻找可能存在的TSG奠定了基础。
肿瘤的发生、发展是多基因和多步骤异常改变的结果。同一肿瘤的发生、发展可以有不同的遗传学改变;而同一遗传学改变亦可以对不同肿瘤的发生、发展起作用,其作用的重要性可以有所不同。在以往的研究中,发现原发性胃癌的发生、发展涉及众多染色体的增加或缺失。而随着人类基因组信息的不断获得,染色体7q,尤其是7q31.1区域已经成为众多类型肿瘤,包括头颈鳞癌、结肠癌、前列腺癌、乳腺癌、肾癌、胰腺癌、胃癌等研究LOH的热点[14]。
将胃癌染色体7q31.1 LOH结果与患者各临床病理特征进行统计学分析,表明7q31.1 LOH与患者年龄、性别、肿瘤原发灶部位、肿瘤细胞分化程度、肿瘤临床分期和淋巴结转移没有显着相关性(P>0.05),这与李锦添等[15]的报道不一致,可能因为样本数太少;其中,LOH与4种病理类型均无关,提示存在于位点D7S486上的TSG可能是一作用非常广谱的胃癌相关TSG,与胃癌各种组织类型的发生均有关联。
[1]于颖彦,计骏,陆云,等.胃癌5号染色体短臂杂合性缺失的精细作图及其相关基因探讨[J].中华肿瘤杂志,2006,28(2):84.
[2]郭涛,孙敬武.喉癌前病变及喉鳞状细胞癌微卫星杂合性缺失的变化及其意义[J].临床耳鼻咽喉头颈外科杂志,2007,21(18):831.
[3]Zenklusen JC,Weitzel JN,Ball HG,et al.Allelic loss at 7q31.1 in human primary ovarian carcinomas suggests the existence of a tumor suppressor gene[J].Oncogene,1995,11(2):359.
[4]Achille A,Biasi MO,ZamboniG,et al.Chromosome 7q allelic losses in pancreatic carcinoma[J].Cancer Res,1996,56(16):3808.
[5]Kawana Y,Ichikawa T,Suzuki H,et al.Loss of heterozygosity at 7q31.1 and 12p13-12 in advanced prostate cancer[J].Prostate,2002,53(1):60.
[6]王丽江,甘润良,黄幼生,等.应用自制显微切割工具切割石蜡组织行 PCR-银染[J].诊断病理学杂志,2004,11(5):360.
[7]Coombs NJ,Gough AC,Primrose JN.Optimisation of DNA and RNA extraction from archival formalin-fixed tissue[J].Nucleic Acids Res,1999,27(16):12.
[8]王丽江,甘润良,唐运莲,等.石蜡组织提取 DNA四种方法的比较[J].诊断病理学杂志,2004,11(1):57.
[9]房殿春.重视胃癌基因不稳的研究[J].重庆医学,2003,32(9):1121.
[10]葛相栓,吴正祥.抑癌基因PTEN在肿瘤发生发展中的作用[J].安徽医药,2007,11(11):963.
[11]Engelman JA,Zhang XL,Lisanti MP.Genes encoding human caveolin-1 and-2 are co-localized to the D7S522 locus(7q31.1),a known fragile site(FRA7G)that is frequently deleted in human cancers[J].FEBS Lett,1998,436(3):403.
[12]Shatz M,Liscovitch M.Caveolin-1:a tumor-promoting role in human cancer[J].Int J Radiat Biol,2008,84(3):177.
[13]Zenklusen JC,Hodges LC,LaCava M,et al.Definitive functional evidence for a tumor suppressor gene on human chromosome 7q31.1 neighboring the Fra7G site[J].Oncogene,2000,19(13):1729.
[14]Weng DS,Li JT,Mai SJ,et al.Identification of a new target region on the long arm of chromosome 7 in gastric carcinoma by loss of heterozygosity[J].World J Gastroenterol,2006,12(15):2437.
[15]李锦添,买世娟,冯炳健,等.胃癌7号染色体杂合性缺失[J].中国肿瘤临床,2004,31(1):4.