孙 奎,吴晓明,张鸿霞,许新华,王鹤鹏,杨景哲,李树松
(承德医学院附属医院烧伤整形外科,河北承德067000)
瘢痕疙瘩是皮肤损伤后伤口愈合过程中出现成纤维细胞过度增殖、胶原大量沉积,也是皮肤损伤后组织异常修复的结果。目前,对瘢痕发生的机制仍知之甚少,因而临床上亦远未找到切实有效的防治措施。瘢痕疙瘩多采用局部药物注射、压迫治疗、手术和激光治疗等进行综合治疗,但效果不是很理想,因而瘢痕疙瘩也成了当今整形外科领域的一个研究热点和难点[1]。现将丝裂霉素C(mitomycin C,MMC)对瘢痕疙瘩成纤维细胞(keloid fibroblast,KFB)转化生长因子β(transforming growth factor-β,TGF-β)/Smads通路作用及机制报道如下。
1 资料与方法
1.1 一般资料 选择2009年6月至2010年6月本院收治的瘢痕疙瘩进行整形手术的患者13例,其中,男9例,女4例;年龄12~46岁。取材部位:上肢5例,面部3例,躯干5例。入选标准为病程短且生长活跃的瘢痕疙瘩组织,未接受任何抑制瘢痕增生的治疗,均无系统性疾病史,且对所取组织均知情同意。
1.2 标本的制作 将手术切下的瘢痕疙瘩组织采用组织块贴壁培养法进行体外培养。在无菌条件下切除表皮及皮下脂肪,将标本制成1 mm3左右的组织块,置于培养瓶中,在95%空气、5%CO2、37℃、饱和湿度条件下培养8~12 h。然后加入含15%胎牛血清的达氏修正依氏培养基(Dulbecco′s modified eagle′s medium,DMEM)适量,继续培养,3~4 d换液1次。2~3周后,原代细胞生长成单层,用0.25%胰蛋白酶消化后,按1∶3的比例传代培养。常规培养KFB 24 h后,吸去培养液和未贴壁细胞,更换含不同药物浓度的培养液,实验分为对照组和MMC干预组,正常对照组用DMEM培养液;MMC干预组:MMC的终末浓度分别为2.50、12.50、50.00、100.00、200.00μg/L。
1.3 TGF-β1在mRNA水平的检测 将成纤维细胞按10 cm2/mL比例加入Trizol,用Trizol总RNA提取试剂盒提取细胞总RNA,经紫外分光光度计(日本导津UV2201型)测定总RNA浓度和纯度,重复测定3次,A260和A280之比值应在118~210,计算样品总RNA浓度。引物序列为TGF-β1cD-NA扩增的上游引物为5′-CTG CTT CAG CTC CAC AGA GAA GA-3′,下游引物为5′-AAG TTG GCG TGG TAG CCC TT-3′,产物片段长度为111 bp。取1μg总RNA,加入Oligo(d T)18 Primer,70℃温育5 min;迅速放入冰浴中,加入10 mmol/L d NTP,RNA酶抑制剂,5倍缓冲液,42℃温育5 min;冰浴中加入5 U/μL AMV逆转录酶,加入DEPC处理水至总体积20μL,42℃温育60 min,70℃10 min,立置冰上,-80℃冰箱保存备用。将反应管置于PCR仪上,95℃预变性10 min后,进入95℃变性1 min,50℃退火15 min,72℃延伸10 min的循环,共34次,最后72℃充分延伸10 min。反应完成后取10μL PCR反应液,经1%琼脂糖凝胶电泳,用PCR Marker作相对分子质量标准。电泳完毕后在紫外荧光数字成像仪下观察结果。以每例TGF-β1与β-actin扩增产物条带吸光度的比值作为TGF-β1mRNA的相对表达量。
1.4 Western Blot检测Smad2/3、Smad4、Smad7蛋白 取对数生长期的KFB,以5×105/mL接种于25 mL培养瓶内,CO2孵箱内,10%胎牛血清的DMEM培养液培养24 h,更换含不同药物的培养液培养24 h,彻底去除上清液,加入适量细胞裂解液并加入PMSF(使PMSF终浓度为0.174 mg/mL),冰上作用40 min,12 000 r/min,4℃离心20 min,取上清液,以考马斯亮蓝法测定蛋白浓度。按4∶1比例加入5×Loading Buffer,封好EP管口,置水浴箱中变性5 min,进行稳压电泳,以2 m A/cm2恒流 转 膜,β-actin 4℃转 膜2 h,Smad2/3、Smad4、Smad7 4℃转膜3 h。2.5%封闭液配制抗体稀释液,Smad2/3、Smad4及Smad7 1∶1 000稀释,β-actin 1∶1 000稀释。将聚偏二氟乙烯(PVDF)膜置于杂交袋中,加适量的抗体稀释液于PVDF膜上有蛋白的一面,压紧四角。4℃孵育过夜。TBST液洗膜后,加适量的抗体稀释液于PVDF膜上有蛋白的一面,室温作用2 h,TBST液洗PVDF膜后,暗室曝光,10 s~3 min,常规方法显影、定影,直至显影出电泳带,拍照的图像用灰度扫描软件BandScan 4.5进行扫描,取得目的条带灰度值,用该灰度值和内参β-actin灰度值相比,用相对灰度值在Excel中作图分析。
1.5 统计学处理 应用SPSS11.5统计学软件进行数据分析,计量资料以±s表示,进行方差分析,组间比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结 果
不同浓度的MMC对TGF-β1mRNA表达,对照组和2.50、12.50、50.00、100.00、200.00μg/L的MMC干预组的TGF-β1mRNA相对表达量分别为0.88±0.07、0.80±0.06、0.51±0.04、0.47±0.05、0.36±0.03和0.22±0.02。MMC干预组TGF-β1mRNA相对表达量明显低于正常对照组,见图1~2。两组Smad2/3、Smad4、Smad7蛋白的表达见表1。
表1 两组Smad2/3、Smad4、Smad7蛋白的表达(±s,n=13)
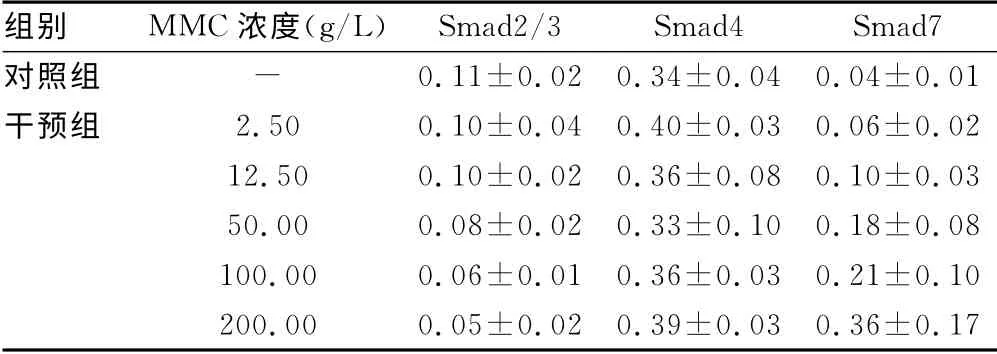
表1 两组Smad2/3、Smad4、Smad7蛋白的表达(±s,n=13)
-:表示无数据。
组别 MMC浓度(g/L)Smad2/3 Smad4 Smad7对照组-0.11±0.02 0.34±0.04 0.04±0.01干预组 2.50 0.10±0.04 0.40±0.03 0.06±0.02 12.50 0.10±0.02 0.36±0.08 0.10±0.03 50.00 0.08±0.02 0.33±0.10 0.18±0.08 100.00 0.06±0.01 0.36±0.03 0.21±0.10 200.00 0.05±0.02 0.39±0.03 0.36±0.17
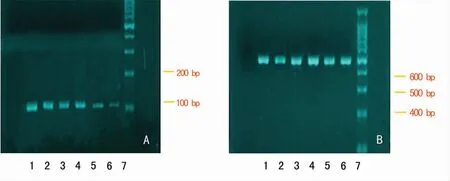
图1 TGF-β1mRNA对KFB的表达
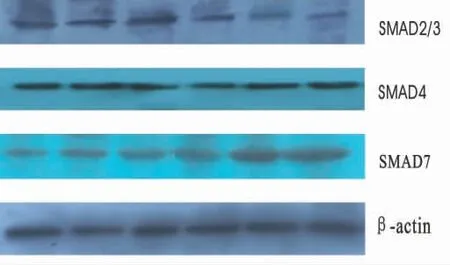
图2 MMC对Smad2/3、Smad 4、Smad7 β-actin蛋白的表达
3 讨 论
MMC是一种抗肿瘤药物,还是一种强有力的抑制成纤维细胞增殖的药物。MMC在耳鼻喉科、眼科、神经外科等领域中治疗组织粘连比较广泛,但在治疗瘢痕增生的临床及基础研究较少。研究表明,MMC对KFB增殖有抑制作用,使细胞周期停滞于G1/S期而实现[2],并有时间依从性,同时与剂量密切相关[3]。有研究表明,手术切除瘢痕疙瘩后,局部使用丝裂霉素取得了满意的临床效果[4]。于冬梅等[5]研究表明,MMC对体外培养KFB增殖的抑制作用与药物浓度、处理时间有关。刘莺等[6]通过MTT检测证实100μg/L MMC对KFB的增殖抑制效果为最佳,为该药物临床应用提供了有力的实验依据。
TGF-β1是目前公认的与瘢痕疙瘩形成最为密切的细胞因子[7]。TGF-β家族成员对表皮细胞的生长、分化、凋亡及肿瘤形成具有调控作用[8]。TGF-β细胞表面受体主要分为Ⅰ、Ⅱ、Ⅲ型。其中TGF-β1直接刺激血管生成,刺激FB增殖及细胞中葡萄糖与氨基酸的转运和糖酵解的进行,同时也抑制基质金属蛋白酶活性和促进基质金属蛋白酶组织抑制剂纤溶酶原激活物抑制剂-1基因的表达,进而抑制细胞外基质的降解;还介导血小板源性生长因子、结缔组织生长因子的致纤维化作用[9];促进纤维粘连蛋白和胶原基质的黏附,促进瘢痕的形成。陈伟等[10]研究发现,TGF-β1的存在会不断刺激KFB诱导基质产生,导致细胞基质的过度沉积。曹艳杰等[11]研究发现,丹参涂膜剂可改善增生期瘢痕微循环局部缺氧状态,进而抑制瘢痕组织内细胞因子TGF-β1的表达。本研究结果显示,干预组较对照组TGF-β1m RNA降低,随作用时间增加TGF-β1mRNA表达变化越为明显,在处理72 h后TGF-β1m RNA表达变化最为明显,不同浓度MMC作用下TGF-β1m RNA表达量差异有统计学意义。提示MMC可能通过减少TGF-β1表达,从而起到抑制瘢痕增生的作用。
TGF-β信号主要由Smad家族介导,其作为配体形成受体复合物,激活Smad,转移到细胞核内与TGF-β诱导基因的特定序列直接结合,共同激活或抑制其调节的靶基因转录[12]。Smad家族作为细胞质内TGF-β下游的信号转导因子,在瘢痕疙瘩的发生、发展过程中起关键作用。根据结构和功能,Smad蛋白分成R-Smad、Co-Smad和I-Smad 3个亚家族。受体激活型或通路特异性主要包括Smad1、Smad2、Smad3、Smad5、Smad8。共同通路型主要是Smad4,其不能与TGF-β受体相互作用,但它可以与磷酸化的R-Smads相互作用形成稳定的异源三聚体[13-14]。抑制型包括Smad6和Smad7,它们主要通过竞争性地与激活的Ⅰ型体结合抑制R-Smads的磷酸化作用,ISmads作为一种负反馈调节信号调节TGF-β的信号转导[15]。TGF-β/Smad信号通路是通过正、负反馈的调节通路自我调控的,一方面,Smad2/3发挥正反馈调节作用;另一方面,Smad7与激活的TGF-β1型受体结合,阻止R-Smad磷酸化,阻断信号的传导。已有研究表明,5-氟尿嘧啶(5-FU)有可能提高抑制型Smad(Smad6和Smad7)在胞质中的表达,使Smad3免受磷酸化,进而减少Smad3、Smad4杂络物的生成,最终阻碍信号进一步下传[16]。积雪草甙对增生性瘢痕内TGF-β1m RNA有明显的抑制作用,能提高抑制型Smad7蛋白在胞质中的表达[17]。
本研究显示,加入不同浓度的MMC能明显增加KFB中Smad7蛋白的表达,减弱KFB中Smad2/3蛋白的表达,并且对KFB中Smad7蛋白的增强效应强于对Smad2/3蛋白的减弱效应,对Smad4蛋白的表达无变化。这可能是由于MMC通过增加Smad7蛋白的表达,通过竞争性占据TGF-β1型受体而抑制受体蛋白激酶对R-Smad(Smad2/3)的磷酸化,抑制TGF-β的病理性作用,从而达到抑制瘢痕增生的作用。
MMC依靠其强大的抑制成纤维细胞的功能广泛应用于临床,但目前对于其治疗不同类型瘢痕的方法、剂量以及不良反应还没有大样本的临床统计学资料。对于TGF-β/Smad信号通路作用研究获得了迅猛发展,但仍有大量问题有待于深入研究。
[1]Kelly AP.Medical and surgical therapies for keloids[J].Dermatol Ther,2004,17(2):212-218.
[2]Fujiwara M,Muragaki Y,Ooshima A.Keloid-derived fibroblasts show increased secretion of factors involved in collagen turnover and depend on matrix metalloproteinase for migration[J].Br J Dermatol,2005,153(2):295-300.
[3]陈诗书,汤雪明.医学细胞与分子生物学[M].北京:科学出版社,2004:717-722.
[4]Stewart CE,Kim JY.Application of mitomycin-C for head and neck keloids[J].Otolaryngol Head Neck Surg,2006,135(6):946-950.
[5]于冬梅,郝立君,李颖,等.丝裂霉素C对瘢痕疙瘩成纤维细胞增殖及凋亡的影响[J].中国临床药理学与治疗学,2007,12(8):900-905.
[6]刘莺,于冬梅,郝立君,等.丝裂霉素C对瘢痕疙瘩成纤维细胞Cyclin D1、CD K4及p27基因表达的影响[J].中国组织化学与细胞化学杂志,2008,17(2):126-131.
[7]Liu W,Wang DR,Cao YL.TGF-β:a fibrotic factor in wound scarring and a potential target for anti-scarring gene therapy[J].Curr Gene Ther,2004,4(1):123-136.
[8]Lopez-Casiilas F,Payne HM,Andres JL,et al.Betaglycan can act as a dual modulator of TGF-βaccess to signaling receptors:mapping of ligand binding and GAG attachment site[J].J Cell Biol,1994,124(4):557-568.
[9]Murata H,Zhou L,Ochoa S,et al.TGF-beta3 stimulates and regulates collagen synthesis through TGF-betal-dependent and independent mechanisms[J].J Invest Dermat,1997,8(3):258-262.
[10]陈伟,付小兵,葛世丽,等.增生性瘢痕形成和成熟过程中TGF-β1、TGF-β3及其受体的基因表达变化[J].中华整形外科杂志,2004,7(20):308-309.
[11]曹艳杰,王福波.丹参涂膜剂对肥厚性瘢痕裸鼠模型血液流变学及细胞因子TGF-β1、bFGF的影响[J].细胞与分子免疫学杂志,2010,28(6):135-137.
[12]郭永红,罗金燕.TGF-β超家族与Smad信号转导研究进展[J].医学综述,2005,11(8):685-688.
[13]Heldin CH,Miyazono K,Dijke P.TGF-beta signalling from cell membrane to nucleus through SMAD proteins[J].Nature,1997,390(6659):465-471.
[14]Shi Y,Hata A,Lo RS,et al.A structural basis for mutational inactivation of the tumour suppressor Smad4[J].Nature,1997,388(6637):87-93.
[15]Attisano L,Wrana JL.Signal transduction by the TGFbeta superfamily[J].Science,2002,296(5573):1646-1664.
[16]Wendling J,Marchand A,Mauviel A,et al.5-fluo-rouracil blocks transforming growth factor-beta-inducedα2 typeⅠcollagen gene(COL1A2)expression in human fibroblasts via c-Jun NH2-terminal kinase/activator protein-1 activation[J].Mol Pharmacol,2003,64(3):707-713.
[17]Tateshita T,Ono I,Kaneko F,et al.Effect of collagen matrix containing transforming growth factor(TGF)-beta(I)on wound contraction[J].Dermatol Sci,2001,27(2):104-113.



