邢弟林,刘 娟,林家国
(重庆市奉节县人民医院麻醉科 404600)
麻醉诱导和气管插管是麻醉的重要环节,由于喉镜窥视和气管插管的强烈刺激,交感神经系统兴奋,导致血浆儿茶酚胺分泌增加,心率(HR)增快,血压上升等应激反应。丙泊酚具有起效快、清除快、苏醒快速完全、呕吐发生率低,但其镇痛效果弱,因此,提倡插管前加用一定量的麻醉性镇痛药,抑制神经内分泌的应激反应,稳定血流动力学。为了预防全身麻醉插管心血管反应,有学者做了一些有益探讨,例如环甲膜穿刺表面麻醉,喉头表面麻醉。较为经典的方法是芬太尼4~6μg/kg静脉注射。本研究观察了芬太尼、舒芬太尼、瑞芬太尼全身麻醉诱导对循环系统的影响,现报道如下。
1 资料与方法
1.1 一般资料 选择2012年1月至2013年7月本科ASA分级Ⅰ或Ⅱ级腹腔镜胆囊切除手术患者(LC)60例,年龄50~70岁、体质量46~80kg。其中男35例,女25例。分为3组:芬太尼组(F组)、舒芬太尼组(SF组)、瑞芬太尼组(RF组),每组20例。3组患者身高、体质量、性别无统计学差异(表1)。术前无肝肾功能障碍,亦无其他手术麻醉禁忌证。术前用药:苯巴比妥钠0.1g、654~210mg;入室平静10min后,用迈瑞9000多功能监护仪监测无创血压、心电、脉搏血氧饱和度(SPO2),并记录首次血压、脉搏为基础值。
表1 3组患者基本资料(±s)

表1 3组患者基本资料(±s)
组别 n 性别(男/女)年龄(岁) 体质量(kg)11 50.95±9.61 62.75±12.12 SF组 20 11/9 45.85±18.16 63.10±12.30 RF组 20 8/F组 20 9/12 46.30±13.48 61.20±13.14
1.2 方法 入室后均开放左上肢静脉输注乳酸林格氏液10~20mL/kg,总量输注250~500mL后开始麻醉诱导,各组均使用北京思路高TCI输注泵血浆靶控丙泊酚2.5μg/mL至入睡。F组:静脉注射芬太尼3.0μg/kg、咪达唑仑0.04mg/kg、氯化琥珀胆碱1.5mg/kg,完成气管插管,插管后开启血浆靶控芬太尼3.0ng/mL,间断注射阿曲库铵维持肌肉松弛,术中根据血压调整丙泊酚靶控量;SF组:静脉注射舒芬太尼0.4 μg/kg、咪达唑仑0.04mg/kg、氯化琥珀胆碱1.5mg/kg完成气管插管,插管后开启血浆靶控舒芬太尼0.4ng/mL,间断注射阿曲库铵维持肌肉松弛,术中根据血压调整丙泊酚靶控速度;RF 组:静 脉 注 射 瑞 芬 太 尼 2.0 μg/kg、咪 达 唑 仑0.04mg/kg、氯化琥珀胆碱1.5mg/kg完成气管插管,插管后同样开启血浆靶控瑞芬太尼3.0ng/mL,间断注射阿曲库铵维持肌肉松弛,术中根据血压调整丙泊酚靶控速度;3组患者均行机械通气VT 8~10mL/kg、F12~14次、I∶E为1.0∶1.5,维持动脉知二氧化碳分压(PaCO2)30~40mm Hg之间。记录3组麻醉诱导前基础值(T0),插管即刻(T1),插管后1min(T2),插管后3min(T3)的收缩压(SBP)、舒张压(DBP)和 HR变化,一旦发生血压低于基础值的30%,HR低于50次/分钟,分别静脉注射多巴胺1~2mg,阿托品0.5mg。自主呼吸时潮气量 大 于 4mL/kg,频 率 大 于 8 次/分 钟,且 PaCO2<50mm Hg时拔除气管导管,10和20min后进行视觉模拟疼痛(VAS)评分,1~<5分自主呼吸时为轻微疼痛,5~<7分为中度疼痛,7~10分为重度疼痛。VAS评分大于5分静脉注射曲马多1.5mg/kg,并观察生命指标,平稳后送回病房。
1.3 统计学处理 采用SPSS 13.0系统软件对数据进行统计学分析,计量资料采用±s表示,组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 3组血流动力学变化结果 HR各组间比较,差异无统计学意义(P>0.05)。F组T1与T2时刻SBP、DBP与T0时刻比较均下降,差异有统计学意义(P<0.05);SF组T1与T2时刻SBP、DBP与T0时刻比较均下降,差异有统计学意义(P<0.05);RF组在T1与T2SBP、DBP与T0比较均下降,差异有统计学意义(P<0.01),见表2。
2.2 拔管10、20min VSA评分结果 组间比较,RF组拔管10、20min后的VSA评分较其余两组高,差异有统计学意义(P<0.05),见表3。
表2 3组患者血流动力学变化(±s,n=20)
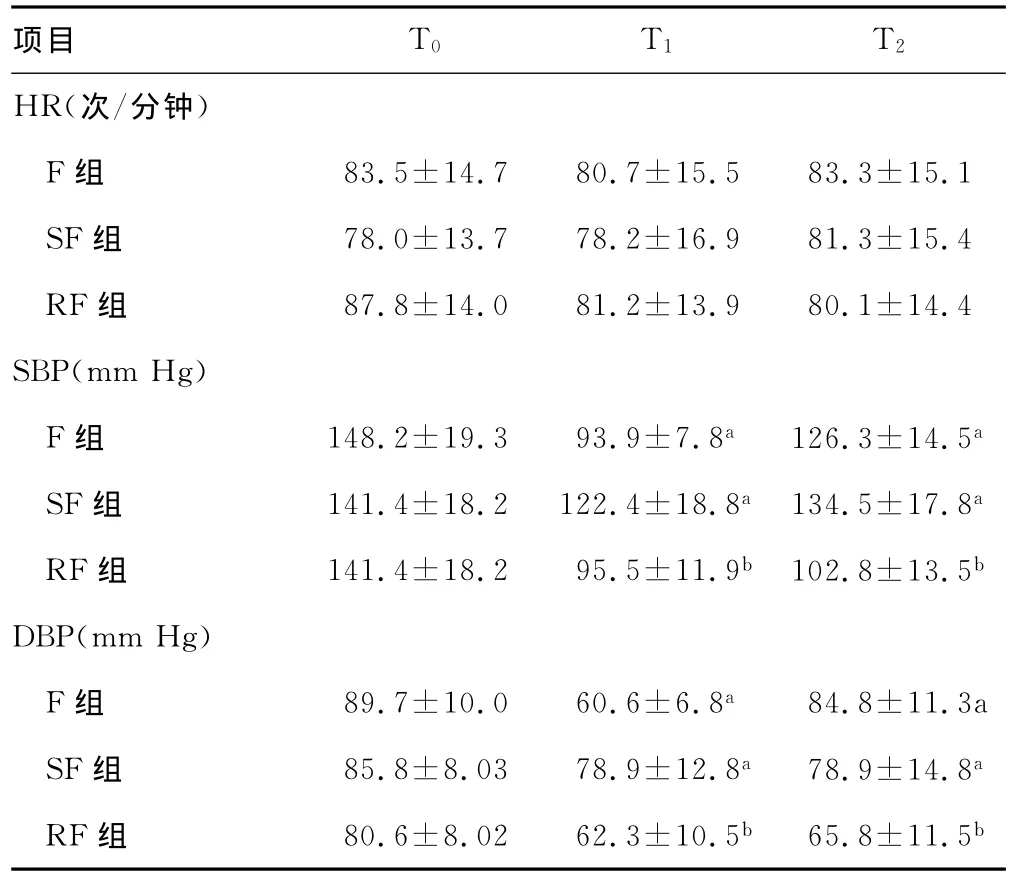
表2 3组患者血流动力学变化(±s,n=20)
a:P<0.05,b:P<0.01,与同组基础值比较。
项目 T0 T1 T2 HR(次/分钟)F组 83.5±14.7 80.7±15.5 83.3±15.1 SF组 78.0±13.7 78.2±16.9 81.3±15.4 RF组 87.8±14.0 81.2±13.9 80.1±14.4 SBP(mm Hg)F组 148.2±19.3 93.9±7.8a126.3±14.5a SF组 141.4±18.2 122.4±18.8a134.5±17.8a RF组 141.4±18.2 95.5±11.9b 102.8±13.5b DBP(mm Hg)F组 89.7±10.0 60.6±6.8a 84.8±11.3a SF组 85.8±8.03 78.9±12.8a78.9±14.8a RF组 80.6±8.02 62.3±10.5b 65.8±11.5b
表3 拔管10min、20min VSA评分(±s,分)

表3 拔管10min、20min VSA评分(±s,分)
a:P<0.05,与F、SF组比较。
组别 n 20 3.33±1.03 3.42±1.04 SF组 20 3.26±0.75 3.28±0.98 RF组 20 5.55±0.64a 6.32±0.96 10min 20min F组a
3 讨 论
气管插管引发的心血管应激反应是全身麻醉诱导的一个潜在危险因素,主要是由于操作时喉镜置入和气管插管对咽喉、会厌、气管黏膜等处机械刺激后,引起交感-肾上腺髓质系统过度兴奋、儿茶酚胺大量释放。表现为血压升高、HR增快,甚至发生心律失常等。以使用喉镜后30~45s时最为强烈,持续约3~5min后逐渐恢复至原水平[1]。术前合并有心、脑血管疾病的患者更易引起急性心肌缺血、严重心律失常、心肌梗死及脑血管意外等严重并发症[2]。研究表明,阿片类药物能缓解伤害性刺激,较完善地阻断神经冲动的传入及反射性交感神经反应,抑制去甲肾上腺素的增加并降低肾上腺素浓度,从而有效地缓解心血管反应[3]。
本研究显示,3组T1及T2HR无显着变化,F组、SF组T1及T2时刻SBP、DBP与T0时刻比较,差异有统计学意义(P<0.05),且SF组变化幅度更小,RF组T1及T2时刻SBP、DBP与T0时刻比较,差异有统计学意义(P<0.01),提示舒芬太尼在T1及T2时刻的血压比芬太尼、瑞芬太尼更平稳;3组拔管后10、20min后VAS评分比较,RF组有统计学意义(P<0.05)。芬太尼、舒芬太尼和瑞芬太尼均为u型受体激动剂。舒芬太尼合成于20世纪70年代中期,是芬太尼的N-4噻吩基衍生物,其脂溶性强,在肝内经生物转化,形成N-去烃基和0-去甲基的代谢物,然后随尿和胆汁排出[4],与芬太尼相比,其亲脂性约为芬太尼的2倍,更易透过血-脑屏障,对u1型受体具有更高的选择性,与血浆蛋白结合率较芬太尼高,虽然其消除半衰期较芬太尼短,但由于与阿片受体的亲和力较芬太尼强,故不仅镇痛强度更大,而且作用持续时间也更长,镇痛效价是芬太尼的5~10倍[5]。舒芬太尼代谢物去甲舒芬太尼有药理活性,效价约为舒芬太尼的1/10,亦即与芬太尼相当,这也是作用持续时间长的原因之一。瑞芬太尼通过血浆和组织液中的非特异酯酶代谢降解,具有起效快、清除快、无蓄积、安全可靠等优点,镇痛效价是芬太尼的7~10倍[5],并有起效快,心血管稳定,无组织胺释放等特点[6],稳定的消除速率适合于长时间输注而不必考虑药物的蓄积问题。异丙酚和阿片类药物存在协同作用,且静脉注射后易出现低血压[3]。因此,本研究采用血浆靶控小剂量异丙酚2.5μg/mL。
舒芬太尼麻醉效应和镇静效应较强,使麻醉程度较深,与其能更有效地抑制压力感受器的敏感性和交感神经的兴奋有关[7]。有的学者研究认为,瑞芬太尼和舒芬太尼较芬太尼能更好地抑制直接喉镜经口气管插管心血管反应,原因可能包括舒芬太尼、瑞芬太尼更有效地抑制机体对伤害性刺激反应,在降低外周血管阻力方面作用强于芬太尼[8-9]。周少丽等[10]使用靶控技术输注等效剂量舒芬太尼、瑞芬太尼进行全身麻醉诱导和麻醉维持,认为舒芬太尼在围诱导期及拔管期的血压、HR比瑞芬太尼更平稳,能更好地抑制插管和拔管期的血流动力学变化,这一点与本研究的结果相似。Al-Sayyad等[11]也有类似的报道,这可能与舒芬太尼的镇痛作用强,作用时间长有关。
综上所述,芬太尼、舒芬太尼、瑞芬太尼均能有效抑制插管所致机体应激反应,但舒芬太尼对循环的干扰更小,插管过程中更平稳,瑞芬太尼对循环的干扰明显,在使用它进行麻醉诱导、插管时要常规备好血管活性药,使用它进行麻醉维持时,在停药前要及早应用强效镇痛药,避免发生“爆发痛”。
[1] 张国楼.全麻插管期心血管副反应的防治[J].临床麻醉学杂志,2001,17(12):673.
[2] 张晓琴,蔡英敏,薛荣亮,等.舒芬太尼在老年患者全麻诱导中对血液动力学的影响[J].临床麻醉学杂志,2005,21(8):525-526.
[3] 于爱兰,傅志俭,张宗旺,等.舒芬太尼、瑞芬太尼、芬太尼对全麻诱导期机体应激反应的影响[J].山东大学学报:医学版,2006,44(10):1032-1035.
[4] 陈君,梁禹.靶控输注舒芬太尼和瑞芬太尼静脉麻醉用于神经外科手术的比较[J].天津医药,2008,36(12):939-941.
[5] 刘鲲鹏,廖旭,薛富善.舒芬太尼的药理学和临床应用[J].中国医药导刊,2005,7(6):454-457.
[6] Hentgen E,Houfani M,Billard V,et al.Propofol-sufentanil anesthesia for thyroid surgery:optimal concentrations for hemodynamic and electroencephalogram stability,and recovery features[J].Anesth Analg,2002,95(3):597-605.
[7] 丁耀茂,林红,丁伟.舒芬太尼、瑞芬太尼、芬太尼对全麻患者气管插管时心血管反应的影响[J].现代医院,2010,10(3):28-30.
[8] Albertin A,Casati A,Deni F,et al.Clinical comparison of either small doses of fentanyl or remifentanil for blunting cardiovascular changes induced by tracheal intubation[J].Minerva Anestesiol,2000,66(10):691-696.
[9] UnlügençH,Itegin M,Ocal I,et al.Remifentanil produces vasorelaxation in isolated rat thoracic aorta strips[J].Acta Anaesthesiol Scand,2003,47(1):65-69.
[10] 周少丽,蔡珺,黑子清,等.舒芬太尼和瑞芬太尼靶控输注静脉麻醉用于妇科腹腔镜手术[J].中国内镜杂志,2006,12(8):785-787,790.
[11] Al-Sayyad M,Crawford AH,Wolf RK.Video-assisted thoracoscopic surgery:the Cincinnati experience[J]Clin Orthop Relat Res,2005(434):61-70.



