王 浩,王晓鹏,郭 利,张政伟,王志勇
(承德医学院附属医院泌尿外科,河北承德067000)
膀胱肿瘤是国内泌尿生殖系统最常见的恶性肿瘤,其术后高复发率,以及需要长期的病情监测给患者和社会带来了严重的医疗负担。易复发是膀胱肿瘤特性之一,手术时肿瘤病变的残留被证明是重要因素之一,因此更加准确的临床干预至关重要。尽管膀胱肿瘤在放疗、化疗、生物免疫治疗方面取得了明显的进步,但经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TUR-BT)及开放切除至今仍然是治疗膀胱肿瘤的主要方式。TUR-BT被公认为非肌层浸润性膀胱尿路上皮癌的首选治疗手段,但对于手术中肿瘤边缘切除的范围说法不一,从0.5~3.0cm不等,且多为经验性切除,无病理统计意义[1-4]。BLCA-4是膀胱癌特异性核基质蛋白家族中的一员,通过对其多肽序列的检测,展现出此蛋白极强的组织和疾病特异性[5],是目前诊断膀胱肿瘤最敏感(89%~96%)且最特异(95%~100%)的标志物[6]。本研究通过观察膀胱肿瘤组织、瘤旁2cm外正常组织中膀胱癌特异性核基质蛋白(BLCA-4)的表达,从分子生物学角度探讨BLCA-4在评估膀胱肿瘤瘤旁2cm切除术的临床指导意义。
1 资料与方法
1.1 一般资料 收集本院泌尿外科2012年9月至2013年4月收治的早期非肌层浸润性膀胱肿瘤患者24例,其中5例由于广基、肿瘤较大(大于2cm)、位于顶壁原因行膀胱肿瘤部分切除术,其余19例行单纯经尿道电切手术,男16例,女8例,年龄44~80岁,平均年龄(60.9±10.5)岁。经术后病理确认所有患者均为非肌层浸润性尿路上皮癌,通过CT影像学和相关辅助检查,无一例患者有淋巴结和远处转移。
1.2 方法
1.2.1 手术方法 部分切除术均取下腹部正中切口,依次切开皮肤、筋膜、肌肉,划开膀胱壁一小口吸净提前灌入其中的蒸馏水,观察瘤体形状和部位,切除肿瘤和周边2cm正常组织,蒸馏水浸泡20min后缝合;TUR-BT术取截石位,首先置入膀胱镜观察肿瘤部位、大小形态,为防止电切组织挛缩提前在瘤周2cm处电凝作一标记,设定电切功率120W,电凝功率70 W,灌洗液为甘露醇溶液,然后用电切镜依次施行瘤体及瘤蒂切除,深度达肌层,切除范围包括肿瘤周围2cm的正常黏膜,彻底电凝止血,用冲洗器将组织块及血块冲出体外,电切术后即刻灌注吡柔比星予以辅助化疗。
1.2.2 组织处理 组织离体后固定于10%中性甲醛溶液中,固定液体积均至少10倍于组织,在常温条件下固定8~24h后将手术标本(不论开放或是电切)剪取不同位点肿瘤和瘤旁组织各2块,大小约3mm×3mm×3mm,放入预设置好程序的自动脱水透明机中,随后对组织进行包埋处理,连续5μm切片,进行常规苏木素-伊红(HE)染色,用中性树脂封片、晾干待病理医师观察。BLCA-4的免疫组织化学切片经过二甲苯彻底脱蜡和梯度乙醇脱水后应用PBS冲洗10min,以3%的过氧化氢甲醇在37℃温箱中孵育30min灭活内源性过氧化物酶,然后进行抗原修复,PBS冲洗3×5min后滴加山羊血清封闭,倾去封闭液直接加抗体置于湿盒中4℃过夜,第2天转放于37℃温箱中复温30min,然后顺序滴加生物素标记二抗及酶标记链亲和素各孵育30min,最后用现配的DAB液进行显色,利用纯水冲洗终止显色,苏木素复染脱水透明后封片观察。阴性对照采用PBS液替代BLCA-4抗体,其余染色步骤不变。
1.2.3 切片观察 全部常规HE染色的病理切片先后经过3个病理科医师反复观察确认,按照国际抗癌协会2009年第7版TNM分期法和2004年WHO分级法进行分析,经讨论后作出最终诊断。另外,免疫组织化学结果采用下述判定方式,在染色强度均匀的区域选取5个高倍(×400)视野,按阳性细胞百分率进行染色广度评分:0~5%为0分,>5%~20%为1分,>20%~50%为2分,>50%为3分;按染色的深浅进行强度评分:浅黄色为1分,深黄色为2分,棕褐色为3分。结合染色广度和强度的分值之和对染色结果综合判断:0~<3分为阴性,3分为阳性。
1.3 统计学处理 应用统计软件SPSS17.0对实验数据进行分析,计数资料采用Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结 果
2.1 HE染色 将24例肿瘤组织进行病理切片观察发现所有肿瘤均为非浸润性尿路上皮癌,其中83.3%(20/24)处于Ta期,另有4例肿瘤组织侵及黏膜下层,为T1期。根据WHO 2004分级法确定有6例为高级别癌,其余18例均为低级别癌。在瘤旁组织的病理确认中发现,3例组织切片检查有癌细胞浸润,均为高分级,其余21例瘤旁组织未发现异常,瘤旁浸润率较高,达12.5%。
2.2 免疫组织化学染色 BLCA-4的免疫组织化学切片可见,24例肿瘤组织染色均阳性,相应的癌旁组织有33.3%(8/24)染色阳性,包括病理鉴定为癌浸润的3例和病理正常的5例。通过对染色阳性的患者进行临床资料的对比发现(表1),病理正常而免疫组织化学染色阳性的5例癌旁组织中有2例为高级别,另外3例染色阳性组织虽然为低级别但肿瘤均较大,数据显示高级别BLCA-4的阳性表达率83.3%,高于低级别阳性率,黏膜下层浸润的T1期组织染色均为阳性表达,肿瘤大于2cm者BLCA-4阳性率85.7%(6/7),高于肿瘤较小者的阳性 率 11.8%(2/17),Fisher检验 有 统 计 学 差 异 (P<0.05),提示BLCA-4染色阳性与性别、年龄因素无关,分期或级别高、瘤体大是癌旁浸润广的危险因素。
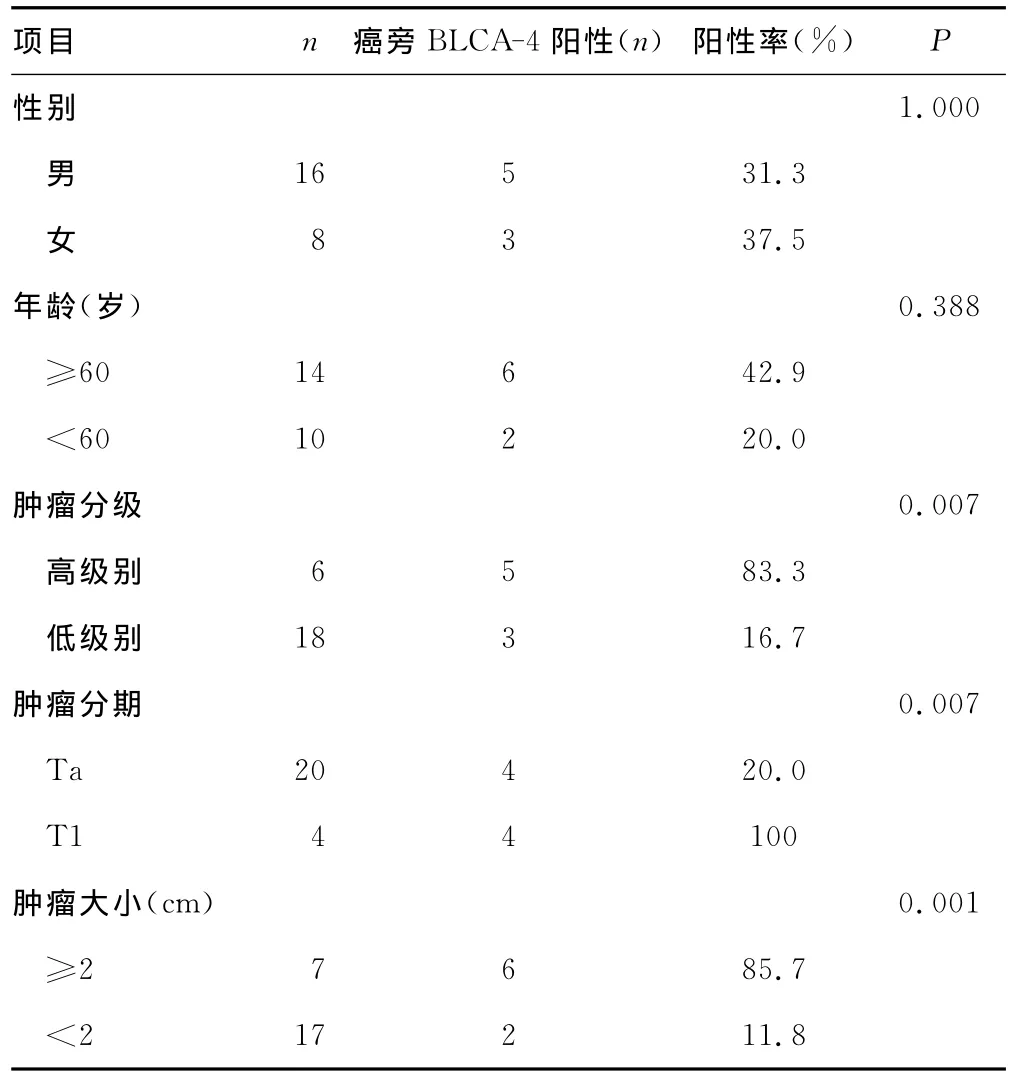
表1 癌旁组织BLCA-4阳性表达与临床病理资料的关系
3 讨 论
膀胱肿瘤是泌尿系最常见肿瘤,经尿道切除术(transurethral resection,TUR)是目前诊治膀胱肿瘤的主要方法,但TUR仍然有其不足。Divrik等[7]认为,中、高分级的T1期膀胱癌,首次电切术后肿瘤残余率可以达到33.8%~36.0%,原位残余的肿瘤是导致膀胱癌复发的重要因素,并且经膀胱灌注化疗也不能降低因切除不全导致的复发。Richterstetter等[8]在膀胱肿瘤患者初次TUR时即行扩大切除术,发现肿瘤周边组织样本中有38%显示有癌浸润,切除的完整性受肿瘤大小、浸润深度和分级的影响。根据欧洲泌尿外科学会(EAU)和美国泌尿外科学会(AUA)指南,对初次TUR的患者在术后2~6周进行常规的二次切除,可以降低术后肿瘤复发率和进展率,但增加了患者的经济负担,同时也增加了膀胱穿孔、出血、尿道感染等发病率,因此,初次手术时的有效切除或许能带来更大的益处。
细胞核基质蛋白(nuclear matrix proteins,NMPs)决定着细胞核的形态并且在细胞的众多功能中(包括DNA的复制、转录等基因表达调控)起重要的作用[9-10]。细胞癌变过程中,细胞、细胞核形态及基因的表达发生改变,这些变化可能是癌细胞中NMPs表达异常的原因或结果,BLCA-4即特异性表达于膀胱肿瘤组织中。2000年Konety等[11]利用蛋白印迹法检测膀胱癌患者肿瘤组织和瘤旁组织及正常人膀胱组织中的BLCA-4水平,结果75%的癌组织和100%的瘤旁组织BLCA-4染色阳性,正常组织中均阴性。2011年,上海Feng等[12]应用免疫组织化学发现正常膀胱组织中BLCA-4无表达,癌组织中阳性染色得分高,24份癌旁组织中有10份表达阳性。2012年,Zhao等[13]也通过免疫组织化学方法检测到78.2%的肿瘤组织表达阳性。
本实验检测了24例非浸润性膀胱肿瘤患者术中切除的组织标本,结果显示癌旁2cm正常组织中有3例病理确认为癌浸润,均为高级别肿瘤。BLCA-4免疫组织化学显示,全部肿瘤组织和3例病理异常的癌旁组织均为阳性,其余21例病理正常的癌旁组织中有5例BLCA-4染色阳性,同时对染色阳性的患者进行临床资料对比发现:肿瘤基底广、直径较大的高级别肿瘤浸润癌旁2cm的可能性更大。另外,病理正常的组织切片BLCA-4染色阳性说明组织在可见的肿瘤病理学变化之前已有蛋白分子学改变。本研究表明,应用免疫组织化学法检测膀胱肿瘤组织及癌旁组织中BLCA-4的表达,在预测术后原位肿瘤复发上优于病理检查。膀胱肿瘤瘤旁2cm切除术所切取的瘤旁组织中BLCA-4表达阳性,提示肿瘤级别高,复发概率增大,通过优化手术切除范围,从手术水平减少因原位肿瘤残留所致复发,是目前治疗膀胱肿瘤的重要方式。当然,对于高危患者是否应在此基础上行扩大性切除仍需要进一步基础和临床循证医学的研究。
[1] 杨明.膀胱肿瘤电切术治疗的疗效观察[J].临床合理用药杂志,2012,5(24):122.
[2] Carrion R,Seigne J.Surgical management of bladder carcinoma[J].Cancer Control,2002,9(4):284-292.
[3] 郭世华.膀胱肿瘤膀胱部分切除与经尿道单纯电切的比较[J].中国现代医生,2012,50(9):151-152.
[4] 易善红.我国膀胱癌诊治指南解读[J/CD].中华临床医师杂志:电子版,2013,7(3):924-925.
[5] Van Le TS,Myers J,Konety BR,et al.Functional characterization of the bladder cancer marker,BLCA-4[J].Clin Cancer Res,2004,10(4):1384-1391.
[6] Calistri D,Casadio V,Bravaccini S,et al.Urinary biomarkers of non-muscle-invasive bladder cancer:current status and future potential[J].Expert Rev Anticancer Ther,2012,12(6):743-752.
[7] Divrik RT,Yildirim U,Zorlu F,et al.The effect of repeat transurethral resection on recurrence and progression rates in patients with T1tumors of the bladder who received intravesical mitomycin:aprospective,randomized clinical trial[J].J Urol,2006,175(5):1641-1644.
[8] Richterstetter M,Wullich B,Amann K,et al.The value of extended transurethral resection of bladder tumour(TURBT)in the treatment of bladder cancer[J].BJU Int,2012,110(2Pt 2):E76-79.
[9] Wilson RH,Coverley D.Relationship between DNA replication and the nuclear matrix[J].Genes Cells,2013,18(1):17-31.
[10]Razin SV,Gavrilov AA,Pichugin A,et al.Transcription factories in the context of the nuclear and genome organization[J].Nucleic Acids Res,2011,39(21):9085-9092.
[11]Konety BR,Nguyen TS,Dhir R,et al.Detection of bladder cancer using a novel nuclear matrix protein,BLCA-4[J].Clin Cancer Res,2000,6(7):2618-2625.
[12]Feng CC,Wang PH,Guan M,et al.Urinary BLCA-4is highly specific for detection of bladder cancer in Chinese Han population and is related to tumour invasiveness[J].Folia Biol(Praha),2011,57(6):242-247.
[13]Zhao Q,Shen WH,Chen ZW,et al.High expression level of BLCA-4correlates with poor prognosis in human bladder cancer[J].Int J Clin Exp Pathol,2012,5(5):422-427.



