张栋栋,付亚杰,陈小芸,鲁永婷,范 维,郭钰珍
(1.兰州大学第二临床医学院妇产科学专业 730000;2.山东省桓台县人民医院重症医学科256400;3.兰州大学第二医院妇科 730000;4.山东省淄博市妇幼保健院 255000)
异甘草素 (isoliquiritigenin,ISL)是一种黄酮类化合物,是甘草中重要的活性成分之一,具有多种药理活性,诸如抗肿瘤、抗病毒、抗自由基、松弛血管、抑制脂质过氧化等。其中抗肿瘤作用是近年来的研究热点[1-3]。研究证明ISL对多种肿瘤细胞具有明显的体外抑制作用,但对卵巢癌细胞的影响尚未见报道。本试验初步观察ISL对人卵巢癌细胞株SKOV3增殖的影响,探讨其可能的抗肿瘤的作用机制,为ISL的临床应用提供试验依据。
1 材料与方法
1.1 材料 人卵巢癌细胞株SKOV3由兰州大学基础医学院惠赠;ISL为天津马克生物技术有限公司产品[高效液相色谱法(HPLC)≥98%,批号:GC-20120203];胎牛血清购自杭州四季青公司;DMEM培养基购自Gibco公司;二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)购自Sigma公司;Annexin V-FITC/PI凋亡检测试剂盒购于南京凯基;兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)抗体、兔抗人Bax抗体、兔抗人Bcl-2抗体、兔抗人Beclin1抗体、兔抗人LC3抗体均购自美国Cell Signaling Technology(CST)公司,HRP标记的山羊抗兔IgG购自美国Santa Cruz公司。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清、100U/mL青霉素、100μg/mL链霉素的DMEM培养液在37℃、5%CO2饱和湿度的培养箱中培养,胰酶消化传代,取对数生长期的细胞用于试验。
1.2.2 MTT法检测细胞生长情况 取对数生长期的SKOV3细胞,以1×104个/孔加入96孔板,待细胞过夜贴壁后,试验组分别加入不同浓度的ISL,使其终浓度分别为5、10、20 μg/mL,阴性对照组加入0.01%的DMSO,空白对照组加入等体积的DMEM培养液,每组设5个复孔,于37℃、5%CO2、饱和湿度条件下培养6、12、24、48h后,每孔加入20μL浓度为5 mg/mL的 MTT,继续培养4h,弃上清液,然后每孔再加入150μL DMSO,振荡3min,使结晶溶解,用酶标仪于490nm处检测吸光度A值,以A490nm值的大小反映活细胞的多少。细胞抑制率=(1-试验组A值/空白对照组A值)×100%。试验重复3次,取平均值。
1.2.3 形态学观察 倒置光学显微镜观察不同浓度ISL(0、5、10、20μg/mL)作用48h后,SKOV3形态学变化。吖啶橙/溴化乙锭双荧光染色后,再次观察细胞形态学变化,并拍照。
1.2.4 Annexin V FITC/PI双染色检测细胞凋亡率 收集不同浓度ISL(0、5、10、20μg/mL)作用48h后的细胞,用不含乙二胺四乙酸(EDTA)的胰酶消化,收集细胞,1 500r/min离心5min,弃上清液,PBS洗2遍(1 500r/min离心5min)。500 μL缓冲液重悬细胞,加入5μL Annexin V FITC和5μL PI,混匀后避光孵育5min,1h内上流式细胞仪(FCM)检测细胞凋亡率。
1.2.5 Western blot检测凋亡相关蛋白Bcl-2、Bax及自噬相关蛋白Beclin1、LC3的表达变化 取对数生长期的SKOV3细胞,以1×105个/孔接种于6孔板,24h细胞贴壁后换液,加入不同浓度的ISL,使其终浓度分别为0、5、10、20μg/mL,继续培养48h,弃上清液,PBS清洗3遍,用干净滤纸吸净PBS,RIPA(含cocktail)裂解液冰上裂解细胞提取蛋白,蛋白质定量试剂盒BCA法蛋白定量,蛋白变性,十二烷基酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜到聚偏氟乙烯(PVDF)膜上。转膜成功后,50g/L脱脂奶封闭2h,分别加入一抗Bcl-2、Bax、GAPDH、Beclin1、LC3[均为兔抗原,50g/L 牛血清清蛋白(BSA)1∶1 000稀释],4℃条件下孵育过夜,洗膜,二抗(1∶5 000稀释辣根过氧化物酶标记的羊抗兔)孵育1h,洗膜,滴加ECL超敏化学发光剂,暗盒曝光显影,采用ImageJ软件进行定量分析。
1.3 统计学处理 采用SPSS17.0统计软件进行统计分析,计量数据用±s表示,采用t检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 形态学观察 各加药组细胞经ISL分别作用6、12、24、48h后,光镜下均可见细胞皱缩变圆,体积缩小,细胞质内可见较多颗粒、空泡,胞核不清,细胞脱壁浮起并出现片状无细胞生长区。空白对照组细胞则贴壁生长,几乎无脱落,细胞完整,胞质饱满,胞核清晰圆润,相邻细胞生长融合成片,可见核分裂相。48hISL 20μg/mL组,吖啶橙/溴化乙啶双染后在荧光显微镜下观察,空白对照组活细胞,核染色质着绿色并呈正常结构;早期凋亡细胞,核染色质着绿色呈固缩状或圆珠状;晚期凋亡细胞,核染色质为橘红色并呈固缩状或圆珠状,如图1所示。

图1 吖啶橙/溴化乙啶双染后观察SKOV3细胞的形态改变(×200)
2.2 ISL对人卵巢癌SKOV3细胞体外增殖的抑制作用 5、10、20μg/mL的ISL对人卵巢癌SKOV3细胞均有明显抑制作用,且随着ISL浓度的增加和培养时间的延长,抑制作用明显增强。20μg/mL的ISL作用48h,对细胞的抑制率可达68.07%,见表1。阴性对照组和空白对照组的A490nm值差异无统计学意义,提示0.01%DMSO对SKOV3细胞无抑制作用。
表1 ISL对人卵巢癌SKOV3细胞增殖的抑制作用(±s,n=3)

表1 ISL对人卵巢癌SKOV3细胞增殖的抑制作用(±s,n=3)
a:P<0.05,与ISL 0μg/mL组比较。
抑制率(%)组别6h 12h 24h 48h ISL 0μg/mL组0.27±1.16-0.68±1.52 1.16±2.06 1.59±1.31 ISL 5μg/mL组 5.32±3.93a7.19±3.86a12.32±4.99a28.48±5.07a ISL 10μg/mL组 6.77±3.52a18.42±4.37a28.01±5.04a47.95±6.31a ISL 20μg/mL组 19.37±4.28a24.92±5.06a37.56±5.86a68.07±6.17a
2.3 Annexin V FITC/PI双标染色流式细胞仪分析ISL对SKOV3细胞凋亡的影响 Annexin V FITC/PI双标染色,流式细胞仪检测不同浓度ISL作用于SKOV3细胞48h后凋亡率变化,结果显示ISL(5、10、20μg/mL)作用于SKOV3细胞48h后,凋亡率明显高于ISL 0μg/mL组,差异有统计学意义(P<0.05),且随ISL浓度增加细胞凋亡率明显增高。
2.4 Western blot检测凋亡相关蛋白Bcl-2、Bax及自噬相关蛋白Beclin1、LC3的表达变化 ISL作用于SKOV3细胞48h后,提取蛋白,Western blot检测Bcl-2、Bax及Beclin1、LC3的表达,结果发现ISL处理细胞后,随着浓度的增加,Bax、Beclin1、LC3的表达增加,Bcl-2的表达下降,ISL 5、10、20μg/mL组分别与0μg/mL组比较差异均有统计学意义(P<0.05),见图2。
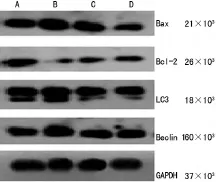
图2 ISL作用于SKOV3细胞株后Bax、Bcl-2、LC3、Beclin1蛋白水平变化
3 讨 论
卵巢癌是女性生殖系统三大恶性肿瘤之一。在美国,上皮性卵巢癌是妇科肿瘤中病死率最高的恶性肿瘤,每年大约有22 000例新发病例和16 000例死亡病例[4-6]。我国发病患者数逐年递增。由于卵巢位于盆腔深部,早期症状不明显,同时缺乏可靠的筛选方法,大多数患者在就诊时已到了晚期,治愈率很低[4-6]。目前对于卵巢癌主要的处理方法是外科手术,辅以铂类药物为基础的联合化疗。尽管临床常用化疗药物抗肿瘤的作用比较明确,但存在着不良反应大,长期应用产生耐药性等缺点。很多病例多因铂类化疗药耐药性的产生而导致治疗失败、癌症复发,故5年生存率仅30%~45%[4]。因此,寻找新的疗效好、不良反应小的化疗药物成为近年的研究热点。而中药因为具有不良反应小、不易产生耐药等优点受到人们的关注,其中黄酮类化合物的抗肿瘤作用成为近年的研究热点。国内外研究表明,黄酮类化合物能抑制多种肿瘤细胞的增殖。ISL作为一种黄酮类化合物,具有多种药理活性,其中抗肿瘤作用备受关注。本试验研究发现,ISL可使SKOV3细胞增殖受到明显抑制,具有明显的量效和时效关系。同时ISL可使SKOV3细胞凋亡率增加,随着药物浓度增高,细胞凋亡率增加更为显着。形态学观察结果也显示细胞发生凋亡改变,提示凋亡可能是ISL抑制人卵巢癌SKOV3细胞增殖的作用机制之一。
关于凋亡机制的研究,可以通过检测死亡受体通路的相关蛋白或基因(如:Fas)的表达[7],也可以通过检测线粒体凋亡途径的相关蛋白或基因(如:Bcl-2、Bax)的表达,亦可以检测内质网通路的相关基因或蛋白的表达,以进一步明确其促凋亡的机制[8-9]。本研究分析ISL处理后对常见的促凋亡基因Bax和抑制凋亡基因Bcl-2蛋白水平的影响,发现其可上调Bax的蛋白水平,降低Bcl-2的蛋白水平,表明ISL可激活SKOV3细胞的死亡受体途径。本研究结果显示ISL可以促进SKOV3的自噬相关蛋白Beclin1、LC3的表达,随着药物浓度的增加,其表达量呈上升趋势,同时SKOV3的凋亡率也增加。提示ISL可以促进SKOV3自噬活性,从而使其凋亡。自噬现象最初被认为是细胞的另外一种凋亡方式,目前研究表明,自噬可以维持细胞新陈代谢,但是当自噬过度活跃时则会促进细胞发生自噬性凋亡[10-11]。凋亡和自噬都可以诱发细胞的程序性死亡,但是二者的关系仍不明确,但二者在某些情况下可以相互拮抗或促进[12]。自噬对肿瘤细胞的作用不尽相同[13-14]。
动物实验表明,ISL具有毒性低、不良反应小的特点[3],为临床治人卵巢癌提供了更广阔的思路,有着更卓越的临床应用价值。本试验为今后进一步研究ISL的抑瘤机制和探索开发人卵巢癌新的药物治疗提供了初步的试验依据。
[1] 张晶,杨静,汤宏斌.异甘草素对人宫颈癌细胞增殖的抑制作用[J].中国药理学与毒理学杂志,2005,19(6):436-442.
[2] 陈朋,张娟,王振华,等.异甘草素对Hela细胞氧化还原状态的影响[J].时珍国医国药,2010,21(11):2726-2728.
[3] 金文伟,李涌健.甘草抗肿瘤活性成分研究近况[J].辽宁中医药大学学报,2011,13(4):163-166.
[4] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2006[J].CA Cancer J Clin,2006,56(2):106-130.
[5] Ozols RF,Bookman MA,Connolly DC,et al.Focus on epithelial ovarian cancer[J].Cancer Cell,2004,5(1):19-24.
[6] Cannistra SA.Cancer of the ovary[J].N Engl J Med,2004,351(24):2519-2529.
[7] 伍俊,易震南,胡成平.曲古抑素A激活FAS途径促使A549/CDDP细胞凋亡[J].重庆医学,2011,40(23):2294-2296,2393.
[8] 胡辉,荆绪斌,蔡先彬,等.姜黄素氧化损伤线粒体诱导肝癌SMMC-7721细胞凋亡的研究[J].重庆医学,2012,03(3):269-270,274.
[9] Brunelle JK,Letai A.Control of mitochondrial apoptosis by the Bcl-2family[J].J Cell Sci,2009,122(4):437-441.
[10] Kroemer G,Levine B.Autophagic cell death:the story of a misnomer[J].Nat Rev Mol Cell Biol,2008,9(12):1004-1010.
[11] Liang C.Negative regulation of autophagy[J].Cell Death Differ,2010,17(12):1807-1815.
[12] Xie M,Morales CR,Lavandero S,et al.Tuning flux:autophagy as a target of heart disease therapy[J].Curr Opin Cardiol,2011,26(3):216-222.
[13] Jin S,Dipaola RS,Mathew R,et al.Metabolic catastrophe as a means to cancer cell death[J].J Cell Sci,2007,120(Pt 3):379-383.
[14] Jin S,White E.Role of autophagy in cancer management of metabolic stress[J].Autophaay,2007,3(1):28-31.



