张林超,赵俊峰,孙继建
(河南省中医院泌尿外科,郑州 450002)
论着·基础研究
微小RNA204在人肾透明细胞癌中的表达及临床意义
张林超,赵俊峰,孙继建
(河南省中医院泌尿外科,郑州 450002)
目的 研究微小RNA204(miR-204)在人肾透明细胞癌(RCCC)中的表达及临床意义。方法收集泌尿外科行手术切除的RCCC及对应癌旁正常肾脏组织标本共65例,运用qRT-PCR技术检测miR-204在RCCC及癌旁组织中的表达水平,统计分析miR-204表达水平与患者临床病理资料间的相关性;采用人工合成的miR-204模拟物转染人RCCCCaki-1细胞,分别采用qRT-PCR及Western-Blot检测转染后miR-204下游潜在靶点Bcl-2及SIRT1 mRNA及蛋白的表达变化。结果miR-204在RCCC组织中表达水平显着低于对应癌旁正常肾组织(P<0.05);miR-204低表达与肿瘤体积增大(>3 cm,P<0.05)、肿瘤淋巴结转移(P<0.05)及高TNM分期(Ⅲ+Ⅳ期,P<0.05)显着相关;miR-204转染人RCCCCaki-1细胞后可显着降低细胞内Bcl-2及SIRT1 mRNA及蛋白的表达水平(P<0.05)。结论miR-204在RCCC组织中表达下调并与肿瘤恶性临床病理特征有关,miR-204可能通过下调Bcl-2及SIRT1的表达来抑制RCCC的发生、发展过程。
微小RNA204;肾透明细胞癌;基因,Bcl-2
肾透明细胞癌(renal clear cell carcinoma,RCCC)是泌尿系统最常见的恶性肿瘤之一,起源于肾小管上皮组织,约占全部恶性肿瘤的3%左右[1]。RCCC早期无明显症状,多数患者发现时已因发生远处转移而失去了进行根治手术的机会[2]。随着肿瘤分子生物学研究的进展,癌基因与抑癌基因的相互作用在肾癌发生、发展中的作用日益突出,但其具体分子机制仍有待进一步研究。
微小RNA(microRNAs,miRNA)是一类长约18~25 nt的非编码小RNA,它能够与靶基因的mRNA特异性结合进而抑制mRNA的翻译过程或降解mRNA单链[3]。miR-204已经被证实是一种重要的肿瘤调节基因,在多种人类恶性肿瘤中存在表达下调甚至缺失,并与肿瘤增殖、凋亡等多种生物学行为密切相关[4-8]。但是,miR-204在人RCCC中的临床病理意义及其具体分子机制尚不清楚。本研究通过检测miR-204在RCCC、对应癌旁组织中的表达情况及其对下游潜在靶点Bcl-2、SIRT1的调控作用,研究miR-204在RCCC发生、发展中的临床意义作用机制,为RCCC的诊断与治疗提供新的分子靶点。
1 材料与方法
1.1 临床标本 本课题经本院医学伦理委员会批准审核后开展。收集2012年1月至2014年3月于本院泌尿外科行手术切除的RCCC(观察组)及对应癌旁组织(距手术切缘大于2 cm,对照组)标本65例,其中男35例,女30例,年龄31~70岁,平均(47.2±2.1)岁,其中29例患者存在淋巴结转移,Fuhrman分级Ⅰ~Ⅱ级者44例,Ⅲ~Ⅳ级者21例,TNM分期Ⅰ~Ⅱ期者37例,Ⅲ~Ⅳ期者28例。所有入组患者术前均未接受放、化疗。标本于离体30 min内取材,分别置于液氮或4%多聚甲醛溶液中保存。
1.2 仪器与试剂 Trizol试剂及脂质体2000(lipofectamineTM2 000)购自美国Invitrogen公司;逆转录试剂盒购自美国Fermentas公司;real time PCR试剂盒购自宝生生物工程(大连)有限公司;miR-204特异性逆转录引物、RNU6B引物及人工合成的miR-204模拟物均购自广州锐博生物科技有限公司;Bcl-2引物(5′-CCT TTG TGT AAC TGT ACG GCC-3′;5′-CTT TGG CAG TAA ATA GCT GAT TCG AC-3′),SIRT1引物(5′-CAA AGG AGC AGA TTA GTA GGC G-3′;5′-CTC TGG CAT GTC CCA CTA T CA C-3′),β-actin引物(5′-CTC CAT CCT GGC CTC GCT GT-3′;5′-GCT GTC ACC TTC ACC GTT CC-3′)由北京奥科鼎盛生物科技有限公司合成;兔抗人Bcl-2多克隆抗体(#2876)、兔抗人SIRT1多克隆抗体(#2496)购自美国CST公司,鼠抗人β-actin单克隆抗体(sc-47778)购自美国Santa Cruz公司,BCA蛋白浓度测定试剂盒购自江苏碧云天生物技术研究所,ECL化学发光试剂盒购自美国Milipore公司。
1.3 方法
1.3.1 qRT-PCR 按RNA提取试剂说明书方法提取RCCC及癌旁组织中的miRNA及mRNA,按以下条件进行RNA逆转录反应:预变性70 ℃ 5 min,逆转录37 ℃ 1 h,酶灭活85 ℃ 5 min。以2 μL cDNA配制Real-time PCR体系,按如下条件进行PCR反应:预变性 95 ℃ 30 s,变性95 ℃ 5 s,退火延伸60 ℃ 30 s,扩增40个循环。以RNU6B基因或β-actin基因为内参,采用2-△△Ct法计算miR-204相对表达量。每个样本独立重复实验3次。
1.3.2 细胞培养 人RCCC Caki-1细胞株培养于含10%FBS的1×DMEM培养基中,置于37 ℃、5%CO2、饱和湿度下进行培养。每2~4日传代1次,稳定传代2~3代后,取对数生长期细胞进行实验。
1.3.3 细胞转染 Caki-1细胞接种于6孔板中,用含10%FBS的1×DMEM培养基培养细胞至融合度达50%左右,实验分组及处理如下:实验组每孔加入100 pmoL miR-204模拟物及5 μL转染试剂;对照组每孔加入100 pmoL 阴性对照(negative control,NC)模拟物及5 μL转染试剂。每孔加入不含血清的1×DMEM培养基调整终体积至2 mL,置于37 ℃、5%CO2、饱和湿度下培养6 h后,更换完全培养基继续培养。独立重复实验3次。
1.3.4 Western blot 取转染72 h后的Caki-1细胞,加入RIPA细胞裂解液置冰上裂解10 min,裂解液收集于1.5 mL EP管中,4 ℃、14 000 r/min离心10 min后取上清液。BCA法测定总蛋白浓度,每孔加入50 μg蛋白样品,10% SDS-PAGE凝胶电泳分离蛋白。采用BIO-RAD半干转印系统,20V转膜1 h,5% BSA室温封闭1.5 h后加入1∶1 000稀释的Bcl-2一抗、SIRT1一抗及β-actin一抗,4 ℃摇晃孵育过夜,0.01 M TBST漂洗5 min×3次后加入1∶5 000稀释的羊抗兔二抗,37 ℃孵育1 h。0.01 M TBST漂洗5 min×3次。于暗室内,在膜上滴加ECL溶液,并使胶片曝光,全自动洗片机洗片。每样本独立重复实验3次。

2 结 果
2.1 RCCC组织及对应癌旁组织中miR-204的相对表达量比较 经qRT-PCR技术检测,65例RCCC组织中miR-204的相对表达量显着低于癌旁正常肾脏组织(2.344±0.193vs. 8.617±0.482),差异有统计学意义(P<0.05)。
2.2 miR-204表达水平与RCCC患者临床病理特征间的相关性 为研究miR-204表达水平与肿瘤临床特征间的相关性,将65例肿瘤标本按表1所列项目分组,经student-t检验,RCCC组织中miR-204低表达与肿瘤淋巴结转移、肿瘤体积增大(>3 cm)和高TNM分期(Ⅲ+Ⅳ)间具有显着相关性(P<0.05)。

表1 miR-204表达与RCCC患者临床病理特征的关系
2.3 过表达miR-204对RCCC Caki-1细胞中Bcl-2及SIRT1表达的影响 向Caki-1细胞内转染入miR-204模拟物后可显着升高细胞内miR-204的表达水平(图1A,P<0.05)。qRT-PCR及Western blot检测发现,与对照组相比,过表达miR-204显着下调了Caki-1细胞内Bcl-2及SIRT-1 mRNA(图1B)和蛋白(图1C)的表达水平(P<0.05)。
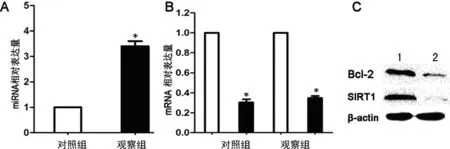
*:P<0.05,与对照组比较;1:对照组;2:观察组。
图1 过表达miR-204下调Caki-1细胞中Bcl-2及SIRT1的表达
3 讨 论
RCCC是最常见的肾脏恶性肿瘤之一。由于早期症状隐匿,约30%的患者就诊时就因已发生远处转移而失去根治手术机会,而在可手术切除的RCCC患者中,也仍有30%的患者会发生早期局部复发[9],这提示RCCC有着较高的复发、转移潜能,但其具体分子机制尚不完全清楚。
近年来研究发现,RCCC组织中存在大量miRNA异常表达,并在RCCC的生物学进展中发挥重要作用。如miR-210、miR-122、miR-34a、miR-21在RCCC组织中表达显着升高,而miR-135a、miR-1973的表达水平则较正常肾组织明显下调[10]。Chen等[11]检测了68例RCCC组织中miRNA的表达情况,发现有74种miRNA存在异常表达,其中 miR-141在92.6%的RCCC中呈现低表达状态并与患者不良预后有关,体外研究证实,过表达miR-141可显着抑制RCCC细胞的增殖、迁移及侵袭能力。本课题通过研究证实,miR-204在RCCC组织中的表达水平显着低于对应癌旁组织,并且其低表达状态与肿瘤体积增大、肿瘤淋巴结转移及高TNM分期等恶性临床病理特征密切相关。提示miR-204在RCCC进展中具有重要的调控作用。
作为一种重要的抑癌分子,miR-204可通过下调肿瘤中MEIS1、FOXC1、Mcl-1等多个癌基因的表达水平来发挥其抗肿瘤作用[12-14]。为进一步研究miR-204对RCCC的抑癌分子调控机制,通过体外转染方法,在RCCC细胞Caki-1中成功过表达miR-204,通过qRT-PCR及Western blot检测发现,过表达miR-204后,Caki-1细胞内Bcl-2及SIRT1 mRNA及蛋白质的表达水平出现显着下调。在临床实践中,以铂类药物为基础的化疗方案在RCCC的化疗中具有重要作用,新近研究证实,miR-204可通过下调Bcl-2的表达来增强胃癌及神经母细胞瘤对顺铂的化疗敏感性,本课题研究结果也表明miR-204可显着下调RCCC肿瘤细胞中Bcl-2的表达,结合miR-204在RCCC组织中的低表达状态,提示miR-204表达缺失可能是RCCC患者对铂类药物化疗耐药的重要机制之一。上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤发生淋巴结及远处转移的重要分子机制之一,在胃癌中的研究表明[15],miR-204能够通过下调胃癌细胞内SIRT1蛋白的表达进而调控E钙黏蛋白、N钙黏蛋白等多种EMT重要分子的表达水平,来最终实现抑制胃癌细胞的侵袭能力。本课题体外实验证实,过表达miR-204可显着下调RCCC细胞中SIRT1的表达水平,组织学研究表明,miR-204低表达与RCCC肿瘤淋巴结转移及高TNM分期密切相关,结合既往研究结果可以推测miR-204可能通过下调RCCC细胞中SIRT1的表达、抑制肿瘤EMT来发挥其抗肿瘤侵袭、转移作用。
综上所述,miR-204在RCCC组织表达显着下调,低表达miR-204与RCCC恶性临床病理特征密切相关。miR-204可能通过下调Bcl-2及SIRT1的表达水平从而发挥其肿瘤抑制作用。因此,miR-204在RCCC的诊断及生物分子治疗中可能具有一定的发展潜力。
[1]Buczek M,Escudier B,Bartnik E,et al.Resistance to tyrosine kinase inhibitors in clear cell renal cell carcinoma:from the patient′s bed to molecular mechanisms[J].Biochim Biophys Acta,2014,1845(1):31-41.
[2]Povoski SP,Hall NC,Murrey DA Jr,et al.Multimodal imaging and detection strategy with 124 I-labeled chimeric monoclonal antibody cG250 for accurate localization and confirmation of extent of disease during laparoscopic and open surgicalresection of clear cell renal cell carcinoma[J].Surg Innov,2013,20(1):59-69.
[3]Dvinge H,Git A,Graef S,et al.The shaping and functional consequences of the microRNA landscape in breast cancer[J].Nature,2013,497(7449):378-382.
[4]Zhao JJ,Chen PJ,Duan RQ,et al.Up-regulation of miR-630 in clear cell renal cell carcinoma is associated with lower overall survival[J].Int J Clin Exp Pathol,2014,7(6):3318-3323.
[5]Li XC,Xin SY,He ZZ,et al.MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor PDCD4 and promotes cell transformation,proliferation,and metastasis in renal cell carcinoma[J].Cell Physiol Biochem,2014,33(6):1631-1642.
[6]Ma L,Deng XB,Wu MH,et al.Down-regulation of miRNA-204 by LMP-1 enhances CDC42 activity and facilitates invasion of EBV-associated nasopharyngeal carcinoma cells[J].FEBS Lett,2014,588(9):1562-1570.
[7]Ryan J,Tivnan A,Fay J,et al.MicroRNA-204 increases sensitivity of neuroblastoma cells to cisplatin and is associated with a favourable clinical outcome[J].Br J Cancer,2012,107(6):967-976.
[8]Li W,Jin X,Zhang Q,et al.Decreased expression of miR-204 is associated with poor prognosis in patients with breast cancer[J].Int J Clin Exp Pathol,2014,7(6):3287-3292.
[9]Kroeger N,Xie W,Lee JL,et al.Metastatic non-clear cell renal cell carcinoma treated with targeted therapy agents:characterization of survival outcome and application of the International mRCC database consortium criteria[J].Cancer,2013,19(16):2999-3006.
[10]Munari E,Marchionni L,Chitre A,et al.Clear cell papillary renal cell carcinoma:micro-RNA expression profiling and comparison with clear cell renal cell carcinoma and papillary renal cell carcinoma[J].Hum Pathol,2014,45(6):1130-1138.
[11]Chen X,Wang X,Ruan A,et al.miR-141 is a key regulator of renal cell carcinoma proliferation and metastasis by controlling EphA2 expression[J].Clin Cancer Res,2014,20(10):2617-2630.
[12]Garzon R,Garofalo M,Martelli MP,et al.Distinctive microRNA signature of acute myeloid leukemia bearing cytoplasmic mutated nucleophosmin[J].Proc Natl Acad Sci USA,2008,105(10):3945-3950.
[13]Conte I,Carrella S,Avellino R,et al.miR-204 is required for lens and retinal development via Meis2 targeting[J].Proc Natl Acad Sci USA,2010,107(35):15491-15496.
[14]Huang J,Zhao L,Xing L,et al.MicroRNA-204 regulates Runx2 protein expression and mesenchymal progenitor cell differentiation[J].Stem Cells,2010,28(2):357-364.
[15]Zhang L,Wang X,Chen P.MiR-204 down regulates SIRT1 and reverts SIRT1-induced epithelial-mesenchymal transition,anoikis resistance and invasion in gastric cancer cells[J].BMC Cancer,2013,13:290.
Expression and clinical significance of microRNA-204 in human renal clear cell carcinoma
ZhangLinchao,ZhaoJunfeng,SunJijian
(DepartmentofUrology,HenanProvincialHospitalofTraditionalChineseMedicine,Zhengzhou,Henan450002,China)
Objective To inveatigate the expression and clinical significance of microRNA-204(miR-204) in human renal clear cell carcinoma(RCCC).Methods 65 cases of resected RCCC tissue and corresponding normal tumor-adjacent tissue were collected and detected the expression level of miR-204 by using qRT-PCR.The correlation between the miR-204 expression level and clilicalpathological features was statistically analyzed.The artificial miR-204 mimics were adopted to stranfect into Caki-1 cells,then the Western blot was used to detect the expression of Bcl-2 a as the downstream potential targets of miR-204 and SIRT1 mRNA and protein.Results The expression level of miR-204 in the RCCC tissue was significantly lowere than that in the normal tumor-adjacent tissues (P<0.05);the low expression of miR-204 was significantly associated with the tumor size(>3 cm,P<0.05),lymph node metastasis(P<0.05) and advanced TNM stage(Ⅲ+Ⅳ,P<0.05).Both the mRNA and protin expression in RCCC Caki-1 cells were down-regulated after transfection.Conclusion The expression of miR-204 is down-regulated in the RCCC tissue and is related to the malignant clinicopathological features,and miR-204 may suppress the RCCC genesis and development through down-regulating the expression of Bcl-2 and SIRT1.
mircoRNA-204;renal clear cell carcinoma;genes,Bcl-2
张林超(1972-),硕士,副主任医师,主要从事肾肿瘤临床与基础研究工作。
:10.3969/j.issn.1671-8348.2015.15.006
R737.11
A
1671-8348(2015)15-2034-03
2014-12-10
2015-02-15)



