陈 梅,郭晓云,姜海行,王家旭,卢东红,岑 瑜,陶 霖
(广西医科大学第一附属医院消化内科,广西南宁 530021)
·论 着·
Th17细胞在乙型肝炎病毒相关性肝病中的表达及意义*
陈 梅,郭晓云△,姜海行,王家旭,卢东红,岑 瑜,陶 霖
(广西医科大学第一附属医院消化内科,广西南宁 530021)
目的 探讨Th17细胞在乙型肝炎病毒(HBV)相关性肝病中的表达及相互关系。方法 收集慢性乙型肝炎(CHB)患者21例(CHB组)、HBV相关性肝硬化患者36例(LC组)及健康对照者20例(HC组)。应用流式细胞术检测外周血Th17细胞频率;酶联免疫吸附测定(ELISA)检测血浆白细胞介素17(IL-17)水平;实时荧光定量PCR法检测肝组织中IL-17mRNA的表达;免疫组织化学染色检测肝脏组织中α-平滑肌肌动蛋白(α-SMA)的表达和分布。结果 LC和CHB组外周血单个核细胞(PBMC)中Th17细胞频率、血浆IL-17水平均明显高于HC组(P<0.01),且外周血中Th17频率与对应血浆IL-17水平呈正相关(r=0.430、0.660,P=0.009、0.001);LC组患者肝组织中IL-17 mRNA水平、α-SMA表达量均明显高于HC组(P<0.01),且α-SMA的表达与肝脏炎症程度(r=0.602,P=0.014)和纤维化分期(r=0.506,P=0.045)呈正相关。结论 Th17细胞可能参与了HBV相关性肝硬化的发生和发展。
Th17细胞;白细胞介素17;肝硬化;肝炎,乙型,慢性
乙型肝炎为世界范围内的病毒感染性疾病,约10%的感染者疾病呈慢性状态,且可进展为肝硬化和肝细胞癌,严重危害人民健康。有研究表明,CD4+T细胞介导的获得性免疫应答在乙型肝炎病毒(hepatitis B virus,HBV)感染所致的肝细胞损伤和肝组织炎症的发病机制中起重要作用[1]。Th17细胞是近年来发现的一群独立于Th1、Th2细胞的效应性T细胞亚群,以产生大量白细胞介素17(IL-17)为特征[2-3],在自身免疫性疾病、感染及肿瘤中起重要作用。最新研究显示,Th17细胞参与肝脏疾病的发生、发展,包括酒精性肝病、急慢性乙型肝炎、慢加急性肝衰竭、肝癌等疾病[4-7],然而对其在HBV相关性肝硬化患者中的表达和作用,目前的报道很少,其具体作用机制也未完全阐明。本研究收集了健康者、慢性乙型肝炎(CHB)和HBV相关性肝硬化患者外周血和肝组织标本,通过检测外周血Th17细胞、血浆IL-17以及肝内α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、IL-17mRNA的表达情况,以探讨Th17细胞及其细胞因子与HBV相关性肝硬化的关系及可能的作用机制。
1 资料与方法
1.1 一般资料 收集本院2012年10月至2014年5月住院的CHB患者21例(CHB组),其中,男14例,女7例;年龄18~71岁,中位年龄34.00岁。HBV相关性肝硬化患者36例(LC组),其中,男28例,女8例;年龄27~71岁,中位年龄48.50岁。诊断符合2010年版CHB防治指南[8],所有患者入组前6个月内未接受抗病毒及免疫调节治疗;并排除合并HIV感染,其他病毒性肝炎,酒精性肝病,自身免疫性疾病及其他系统严重疾病的患者。另收集健康对照者20例(HC组),其中,男12名,女8名;年龄24~45岁,中位年龄35.50岁,均无肝炎病史,HBV血清学标志物均阴性,肝功能各项指标正常。研究经本院伦理委员会批准,所有入选对象均签署知情同意书。
1.2 方法
1.2.1 主要试剂与仪器 主要试剂:IFN-γ-AF488、IL-17-AF647、IL-22-PE、CD4-PerCP-Cy5.5抗体及同型对照抗体、固定破膜剂、莫能霉素、溶血素购自美国BD公司,佛波醇乙酯(PMA)、离子霉素购自美国Sigma公司,IL-17 ELISA试剂盒购自北京欣博盛生物科技有限公司。TRIZOL试剂购自美国Invitrogen公司,逆转录试剂盒、实时荧光定量PCR试剂盒购自美国Roche公司。主要仪器:流式细胞仪(美国BD公司),ABI 7500实时荧光定量PCR反应仪,7600型全自动生化分析仪(日本日立公司),SYM-Bio半自动免疫分析仪及DA-7600实时荧光定量扩增仪。
1.2.2 流式细胞术检测外周血Th17细胞频率 用肝素抗凝真空采血管采集静脉血3 mL,取300 μL全血,加入十四烷酸PMA 50 ng/mL、离子霉素1 μg/mL、莫能霉素0.7 μg/mL,放入含5%CO2培养箱孵育5 h。然后加入CD4-PerCP-Cy5.5抗体5 μL,室温避光孵育20 min。加入1×溶血素,混匀,室温避光孵育10 min。300×g离心5 min,弃上清液,加入250 μL固定破膜剂充分混匀,室温避光孵育25 min,500×g离心5 min,弃上清液,将其分两管,实验管加入IL-17-AF647抗体、IFN-γ-AF488抗体、IL-22-PE抗体,对照管加入同型对照抗体,室温避光孵育30 min后,用1%多聚甲醛300 μL固定,24 h内上机检测。所有制备好的样本均应用流式细胞仪进行检测,采用FlowJo7.6.1软件进行分析。CD4+IFNγ-IL17+IL-22-定义为Th17细胞。
1.2.3 ELISA检测血浆IL-17水平 将前述剩余的血离心取血浆,并保存于-80 ℃冰箱。血浆IL-17的表达水平通过ELISA来检测,严格按照说明书进行。
1.2.4 实时荧光定量PCR检测肝组织中IL-17mRNA的表达 肝组织取自20例LC组患者,为临床诊断肝硬化并同意行肝活检者;12例正常对照(HC组),为肝血管瘤、肝囊肿等良性病变患者外科手术中切除的正常肝组织。新鲜肝组织取材后立即放入液氮中转移,保存于-80 ℃冰箱备用。以TRIZOL试剂提取肝组织总RNA,应用逆转录试剂盒合成cDNA,产物迅速冰浴后-20 ℃冰箱保存备用。实时荧光定量PCR扩增IL-17 mRNA。以3-磷酸甘油醛脱氢酶(GAPDH)作为内参照基因。IL-17引物序列:F-CTC TGT GAT CTG GGA GGC AAA,R-CTC TTG CTG GAT GGG GAC A;GAPDH引物序列:F-GCA CCG TCA AGG CTG AGA AC,R-TGG TGA AGA CGC CAG TGG A。用2-△△Ct值表示mRNA的相对表达量。
1.2.5 肝组织HE和Masson染色 新鲜肝组织(来源同1.2.4)取材后立即固定于4%甲醛溶液中,24 h内制作成蜡块。蜡块连续切片,常规HE和Masson染色,光学显微镜下观察并行Scheuer评分[9]。炎症活动度分为G0~G4,纤维化程度分为S0~S4。
1.2.6 免疫组织化学染色检测肝脏组织中α-SMA的表达 肝组织(来源同1.2.4)石蜡包埋标本3 μm厚连续切片,采用SP法,切片、脱蜡、水化、抗原修复、第一抗体温育、第二抗体温育、二氨基联苯胺显色、苏木精复染、脱水、透明、封片后于显微镜下观察。以PBS代替第一抗体作为空白对照。胞浆呈棕黄色为阳性细胞。每个标本由两名独立观察员计算5个不同高倍视野(×400),使用Image proplus6.0图像分析系统半定量测定α-SMA的表达,计算平均光密度(average optical density,AOD)值。
1.2.7 血清学指标的检测 全自动生化仪检测ALT、TBIL等肝功能指标,SYM-Bio半自动免疫分析仪检测HBV血清学标志物及DA-7600实时荧光定量扩增仪检测HBV DNA载量。
2 结 果
2.1 3组对象外周血Th17细胞频率比较 采用流式细胞术多色荧光分析法检测外周血Th17细胞频率,LC组、CHB组和HC组外周血Th17细胞频率分别为(2.48±0.34)%、(2.17±0.39)%和(1.11±0.24)%,LC组、CHB组患者外周血Th17细胞频率均高于HC组(P<0.01),且LC组又高于CHB组患者(P<0.01),见图1。
2.2 3组对象血浆IL-17水平比较 LC组、CHB组患者血浆IL-17分别为(32.51±9.57)、(21.75±4.68)pg/mL,与HC组的(11.73±3.20)pg/mL比较,差异均有统计学意义(P<0.01),且LC组与CHB组比较,亦差异有统计学意义(P<0.01)。同时分析病例组患者中血浆IL-17和外周血Th17细胞频率的相关性,发现LC组和CHB组患者血浆IL-17和外周血Th17细胞频率均呈正相关,差异均有统计学意义(r=0.430、0.660,P=0.009、0.001)。
2.3 肝组织中IL-17mRNA的表达变化 IL-17 mRNA在对照组相对表达量设定为1.00,与对照组比较,LC组明显升高(3.32±2.80),差异有统计学意义(P<0.01)。
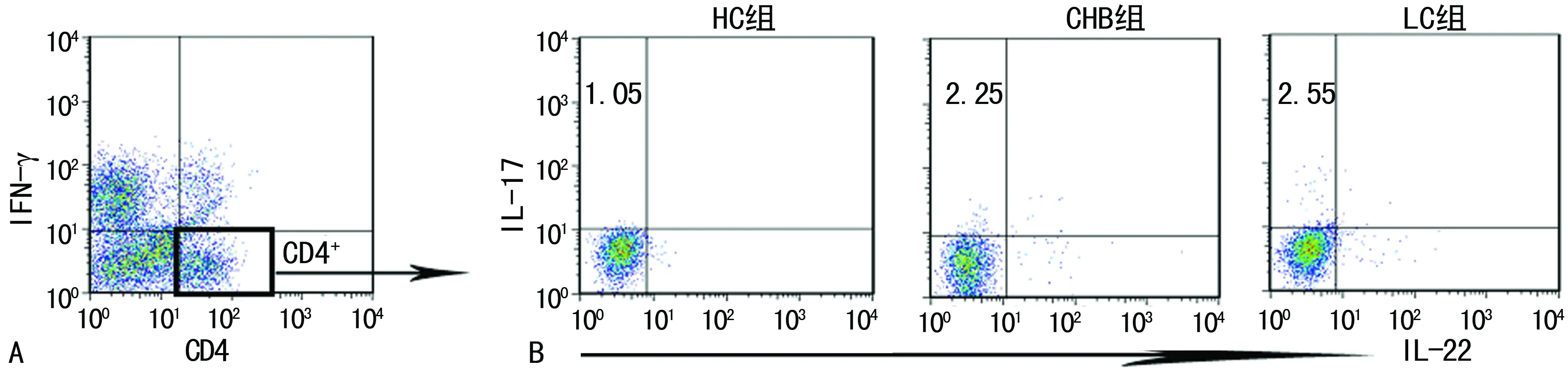
A:CD4+T细胞的设门;B:HC组、CHB组、LC组外周血Th17细胞频率的流式图。
图1 3组对象外周血Th17细胞的频率分布
2.4 肝组织中α-SMA的表达 对照组肝组织中α-SMA表达较少,主要分布于血管壁。LC组患者肝组织中α-SMA表达明显增多,主要集中在门静脉、汇管区及纤维间隔区域内,与肝脏炎症程度(r=0.602,P=0.014)和纤维化分期(r=0.506,P=0.045)呈正相关,且α-SMA表达与外周血Th17细胞频率呈正相关(r=0.789,P=0.000),见图2。
2.5 外周血Th17细胞频率与血清学指标的相关性 LC组患者外周血Th17细胞频率与血清ALT、TBIL水平及HBV DNA载量间均无明显相关性(r=-0.040、-0.153、0.177,P>0.05);CHB组患者外周血Th17细胞频率与血清ALT、TBIL水平及HBV DNA载量间也未发现明显相关性(r=0.264、0.195、-0.056,P>0.05)。

A:肝组织α-SMA免疫组化情况;B:对照组和LC组肝组织α-SMA表达的比较;C:LC组肝组织α-SMA的AOD与肝脏炎症程度和纤维化分期的相关性;D:LC组肝组织α-SMA的AOD与外周血Th17细胞频率的相关性;a:P<0.01,与HC组比较。
图2 LC组患者肝组织中α-SMA的表达情况
3 讨 论
HBV是一种嗜肝DNA病毒,感染人体后可转变为慢性感染,在中国,10%~20%的CHB患者在5年内发展为肝硬化[10]。肝硬化是临床常见的慢性进行性肝病,由一种或多种病因长期或反复作用形成的弥漫性肝损害,以细胞外基质(extracellular matrix,ECM)的形成和积聚及肝星状细胞(hepatic stellate cell,HSC)的激活为特征[11-12]。目前大多数学者认为HBV造成的肝脏损伤及转归与机体细胞免疫功能及免疫耐受密切相关[1]。CD4+T淋巴细胞是机体免疫应答中的重要部分,在机体免疫调节中发挥关键作用,Th17细胞是近来发现的一个新的CD4+T细胞亚群,以分泌大量IL-17为特征[3]。已有研究表明Th17细胞参与多种肝脏疾病的发生发展,但是对于其在HBV相关性肝硬化患者中的作用机制还未完全阐明。
Thl7细胞能分泌IL-17A(即IL-17)、IL-17F、IL-21、TNF-α等,这些细胞因子诱导其他炎症介质和白细胞(尤其是中性粒细胞)聚集在炎症部位,从而加重炎症[13-14],IL-17是其中最重要的效应因子,其受体在体内有广泛表达。IL-17不仅是一种重要的促炎细胞因子,它还可诱导其他促炎细胞因子(如IL-6、TNF)、趋化因子和金属蛋白酶表达,加重炎症细胞浸润和组织损伤[15]。本研究结果显示,LC组和CHB组患者外周血Th17细胞频率和血清IL-17水平高于HC组,LC组又明显高于CHB组,提示Th17细胞可能通过IL-17对HBV相关性肝病的发生、发展起到了一定的促进作用。
在肝组织中,本研究应用PCR的方法检测肝组织IL-17mRNA的表达情况,结果显示,LC组患者肝组织IL-17mRNA的相对表达量明显高于对照组,与上述外周血的结果一致。由于IL-17是由Th17细胞特异性分泌的细胞因子,因此肝内IL-17表达水平可反映Th17细胞的数量。故研究结果提示,LC组患者肝内Th17细胞数量高于对照组。
肝纤维化是肝脏对慢性损伤的修复反应,以ECM异常增生和过度沉积为特征,肝硬化是肝纤维化发展的晚期阶段。在肝纤维化进展过程中发挥中心作用的是HSC,其活化和增殖是肝纤维化形成的中心环节[16],而表达α-SMA是HSC活化的标志。本研究对LC组患者肝组织进行α-SMA的免疫组化染色,结果显示α-SMA的平均光密度在LC组明显升高,且与肝脏炎症和纤维化程度呈正相关,说明患者体内炎症反应较明显,肝损伤严重,提示在肝纤维化进展过程中,慢性炎症刺激使HSC处于激活状态,而激活的HSC不断分泌ECM,最终形成肝硬化。本研究进一步分析α-SMA与外周血Th17细胞频率之间有无关联,结果发现呈正相关关系,由此推测Th17细胞可能参与HSC的激活。
由于Th17细胞与肝损伤相关,本研究分析其与血清学指标的相关性,研究结果表明,患者外周血Th17细胞频率与肝损伤血清学指标ALT、TBIL及HBV DNA载量间均无明显相关性,与Liang等[6]对CHB相关参数的分析结果一致。但是Zhang等[5]的研究结果提示,在CHB患者中,外周血Th17细胞频率与血清ALT及HBV DNA载量均呈明显的正相关。对比后发现,其样本例数比较大,而本研究纳入的病例数与Liang等[6]的研究相近,增大样本量或许可以得出更加符合实际的结果。
综上所述,本研究认为Th17细胞在HBV相关性肝硬化中起到了重要作用,可能发挥了促进炎症、引起病理损伤的效应,导致肝脏炎症和免疫损伤,参与肝纤维化的发生、发展,但具体作用机制和途径尚未明了。Th17细胞的研究将来有可能为调节机体免疫、控制疾病进展提供新的治疗靶点。深入研究Th17细胞在HBV相关性肝硬化中的作用,可能为肝硬化患者的临床治疗提供新的策略。
[1]LiawYF,ChuCM.HepatitisBvirusinfection[J].Lancet,2009,373(9663):582-592.
[2]Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nature Immunol,2005,6(11):1123-1132.
[3]Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nature Immunol,2005,6(11):1133-1141.
[4]Lemmers A,Moreno C,Gustot T,et al.The interleukin-17 pathway is involved in human alcoholic liver disease[J].Hepatology,2009,49(2):646-657.
[5]Zhang JY,Zhang Z,Lin F,et al.Interleukin-17-producing CD4+T cells increase with severity of liver damage in patients with chronic hepatitis B[J].Hepatology,2010,51(1):81-91.
[6]Liang XS,Li CZ,Zhou Y,et al.Changes of Treg and Th17 cells balance in the development of acute and chronic hepatitis B virus infection[J].BMC Gastroenterol,2012,12(1):43.
[7]Zhang JP,Yan J,Xu J,et al.Increased intratumoral IL-17-producing cells correlate with poor survival in hepatocellular carcinoma patients[J].J Hepatology,2009,50(5):980-989.
[8]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中国肝脏病杂志,2011,3(1):40-56.
[9]Brunt EM.Grading and staging the histopathological lesions of chronic hepatitis:the Knodell histology activity index and beyond[J].Hepatology,2000,31(1):241-246.
[10]Liu J,Fan D.Hepatitis B in China[J].Lancet,2007,369(9573):1582-1583.
[11]Bataller R,Brenner DA.Liver fibrosis[J].J Clin Invest,2005,115(2):209-218.
[12]Friedman SL.Mechanisms of hepatic fibrogenesis[J].Gastroenterology,2008,134(6):1655-1669.
[13]Ouyang W,Kolls JK,Zheng Y.The biological functions of T helper 17 cell effector cytokines in inflammation[J].Immunity,2008,28(4):454-467.
[14]Dong C.Regulation and pro-inflammatory function of interleukin-17 family cytokines[J].Immunol Rev,2008,226(1):80-86.
[15]Kolls JK,Lindén A.Interleukin-17 Family Members and Inflammation[J].Immunity,2004,21(4):467-476.
[16]Sarem M,Znaidak R,Macías M,et al.Hepatic stellate cells:it′s role in normal and pathological conditions[J].Gastroentero Hepatol,2006,29(2):93-101.
Expression of Th17 cells in patients with hepatitis B virus-associated liver disease and its significance*
ChenMei,GuoXiaoyun△,JiangHaixing,WangJiaxu,LuDonghong,CenYu,TaoLin
(DepartmentofGastroenterology,FirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning,Guangxi530021,China)
Objective To explore the expression of Th17 cells in the patients with hepatitis B virus(HBV)-associated liver disease and its mutual relation.Methods 21 patients with chronic hepatitis B(CHB),36 patients with HBV-associated liver cirrhosis(LC) and 20 healthy controls(HC) were collected.The flow cytometry was employed to determine the Th17 frequency in peripheral blood;the plasma interleukin-17(IL-17) level was measured by the enzyme linked immunosorbent assay(ELISA);the real-time fluorescence quantitative PCR was used to determine the expression of IL-17 mRNA in liver tissue;the immunohistochemical method was used to measure the expression and distribution of α-smooth muscle actin(α-SMA) in liver tissue.Results The peripheral blood mononuclear cell Th17 frequencies and plasma levels of IL-17 in the LC and CHB groups were significantly higher than those in the HC group(P<0.01),moreover the peripheral blood Th17 cells frequency was positively correlated with corresponding plasma IL-17 level in the LC group(r=0.430,P=0.009) and the CHB group(r=0.660,P=0.001);the liver tissue IL-17mRNA and α-SMA expression levels in the LC group were significantly higher than those in the HC group(P<0.01),moreover the expression of α-SMA was positively correlated with the degree of hepatic inflammation(r=0.602,P=0.014) and the stage of hepatic fibrosis(r=0.506,P=0.045).Conclusion Th17 cells could be involved in the occurrence and development of HBV-associated liver disease.
Th17 cells;interleukin-17;liver cirrhosis;hepatitis,B type,chronic
10.3969/j.issn.1671-8348.2016.05.005
国家自然科学基金资助项目(81260083);广西自然科学基金资助项目(2014GXNSFAA118203);广西高校科学研究项目(KY2015YB069);广西卫生厅重点学科普通外科学实验室及中央财政支持地方高校发展专项资金(肝病外科重点学科)资助项目。 作者简介:陈梅(1988-),在读硕士研究生,主要从事免疫细胞对肝纤维化影响的研究。△
,Tel:13977121496;E-mail:withoutgloom@sohu.com。
R392.3;R575.1
A
1671-8348(2016)05-0592-03
2015-07-13
2015-10-25)



