类婷婷,唐国璋,李春梅,杜丽珍,李岩松,李 睿,韩彤亮
(青岛市市立医院,山东青岛 266071)
·经验交流·
声脉冲辐射力成像鉴别肝内小转移癌与血管瘤的应用价值
类婷婷,唐国璋,李春梅,杜丽珍,李岩松,李 睿,韩彤亮△
(青岛市市立医院,山东青岛 266071)
目的 探讨声脉冲辐射力成像技术(ARFI)在鉴别肝血管瘤与肝内小转移癌的应用价值。方法 采用ARFI对29个肝血管瘤及26个肝转移癌(直径小于或等于3 cm,肝内病灶小于或等于2个)进行声触诊组织成像(VTI)及声触诊组织定量(VTQ)检测,获取VTI弹性图和病灶及背景肝组织的剪切波速度(SWV)值,并对其进行分析。结果 VTI弹性图中,26个肝转移癌病灶边界清晰度优于常规超声13个(50.00%),肝血管瘤为5个(17.24%),差异有统计学意义(P=0.004);肝转移癌组病灶范围大于常规超声18个(69.23%),肝血管瘤组7个(24.14%),二者比较差异有统计学意义(P=0.001)。21个(80.77%)肝转移癌呈灰黑色,8个(27.59%)肝血管瘤呈灰黑色;肝转移癌SWV[(2.83±1.20)m/s]明显高于血管瘤SWV[(1.49±0.41)m/s],二者比较差异有统计学意义(P<0.01)。血管瘤组的肝组织SWV与肝转移癌组肝组织SWV比较差异无统计学意义(P=0.16)。结论 ARFI有望成为一种新的鉴别肝血管瘤与肝转移癌的无创性检查方法。
超声检查;弹性成像;声脉冲辐射力成像;肝肿瘤
肝脏血流异常丰富,接受肝动脉及门静脉双重供血,是恶性肿瘤最常转移的器官,病灶直径较大或者病灶小而多时诊断并不困难。但是有原发肿瘤病史的患者肝脏发现单发或个数较少、直径较小的结节,常规超声对其与血管瘤的鉴别诊断较困难。早期准确检出肝内转移灶在判断肿瘤分期、指导治疗和估计患者预后等方面具有重要意义。增强CT、MRI及超声造影对其鉴别有较高的应用价值,但费用较高。声脉冲辐射力成像技术(acoustic radiation force impulse,ARFI)是一项无创性且能定性、定量测得靶组织硬度信息的新兴弹性成像技术,包括声触诊组织成像技术(virtual touch tissue image,VTI)和声触诊组织量化技术(virtual touch tissue quantification,VTQ)。目前,已有临床资料报道声触诊技术应用于肝纤维化无创评价及肝脏局灶性病变良恶性的鉴别诊断[1-2],本研究旨在探讨ARFI对肝转移癌与血管瘤的鉴别诊断价值。
1 资料与方法
1.1 一般资料 对2012年6月至2014年6月在本院检查的25例(29个)肝血管瘤及22例(26个)肝转移癌进行ARFI检查,其中女18例,男29例;年龄27~76岁,平均(54.43±10.91)岁;病灶直径0.80~3.00 cm,平均(2.03±0.61)cm。22例(26个)肝转移癌的原发肿瘤分别为胃肠道肿瘤12例(15个),肺癌3例,胰头癌1例,乳腺癌3例(4个),宫颈癌2例,卵巢癌1例。原发肿瘤均由手术或穿刺病理证实。纳入标准:(1)肝内病灶个数小于或等于2个,直径小于或等于3.00 cm;(2)原发肿瘤均有明确的病理报告;(3)患者其他系统无危及生命或影响试验结果的严重疾患。最终结果26个病灶经手术或穿刺活检后病理证实,余由任意两种增强影像学(CT、MRI、超声造影)检查方法并经随访诊断。
1.2 方法 仪器使用Siemens Acuson S2000型彩色超声诊断仪,配有ARFI成像技术软件,探头4C1,频率4.0 MHz。检查时受检者取仰卧位或左侧卧位,将探头置于肋间或肋缘下,常规超声记录病灶大小、位置、数目、边界清晰度,ARFI检查时,感兴趣区(region of interest,ROI)避开肝内可见的管道结构,在二维超声模式下充分显示病灶,进行ARFI检测时嘱受检者屏气,以肝脏无明显运动伪像为有效检测,并在检查过程中始终保持探头与扫查部位垂直、固定。(1)VTI定性描述组织硬度:以灰阶图像表现,若病灶较周围肝组织软,病灶VTI弹性成像图呈灰白色;反之,呈灰黑色;病灶与周围组织硬度相似时呈等亮度。检查时,ROI应同时包括病灶与周围肝组织,启动update键后屏幕呈现双幅图,左侧为二维图像,右侧为VTI弹性成像图。(2)VTQ定量描述组织硬度:以剪切波速度(shear wave velocity,SWV)反映组织硬度。检查时,ROI分别位于病灶内及距离病灶至少2.00 cm的肝组织,ROI大小为10×6 mm,最深8.00 cm。启动update键后,机器自动算出SWV数值,并显示在屏幕右侧,同时还显示ROI深度(cm),分别测量5次有效数值并记录存图。所有检查均由一名有经验的超声医师完成,避免不同操作者对结果产生影响。VTI弹性成像图像分析则由两名有经验的医师共同分析,病灶边界的清晰度、明暗度、VTI /2D径线。

2 结 果
2.1 55个病灶的VTI弹性成像图边界特征 与常规二维图像比较,29个肝血管瘤中,VTI图像边界更清晰有5个,相似13个,不清晰11个;26个肝转移癌中,VTI图像边界更清晰有13个,相似10个,不清晰3个。肝转移癌VTI图像边界清晰度要明显好于肝血管瘤,差异有统计学意义(Z=-2.86,P=0.004)。与常规二维超声图像比较,VTI声像图病灶边界特征,见表1。
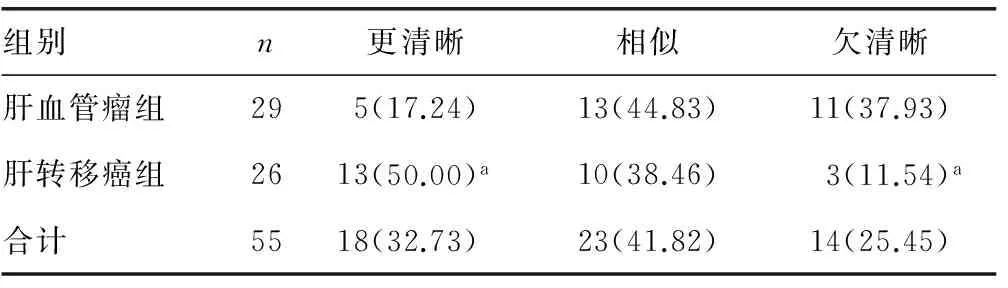
表1 病灶VTI弹性图像边界特征与常规二维超声图像 比较[n(%)]
a:P<0.01,与肝血管瘤比较。
2.2 55个病灶VTI弹性成像图大小特征 与常规二维图像相比,29个肝血管瘤中,7个病灶VTI/2D径线比值大于1,22个病灶VTI/2D径线比值约等于1;26个肝转移癌中,18个病灶VTI/2D径线比值大于1,8个病灶VTI/2D径线比值约等于1。肝转移癌组VTI图像范围大于常规二维图像多于肝血管瘤组,差异有统计学意义(χ2=11.24,P=0.001),见表2。

表2 两组患者VTI/2D径线比值比较[n(%)]
a:P<0.01,与肝血管瘤比较。
2.3 55个病灶VTI弹性成像图硬度特征 与病灶周围肝组织相比,29个肝血管瘤中,8呈灰黑色,12个与周围组织等亮度,9个呈灰白色;26个肝转移癌中,21个呈灰黑色,3个与周围肝组织等亮度,2个呈灰白色。肝转移癌与肝血管瘤VTI弹性成像图比较,差异有统计学意义(Z=-3.75,P=0.000)。见表3及图1、2。
2.4 VTQ检查病灶及背景肝组织的SWV值 所有病灶与背景肝组织SWV相比较,差异有统计学意义(t=5.31,P=0.000)。肝转移癌组和肝血管瘤病灶SWV分别为(2.83±1.20)m/s和(1.49±0.41)m/s,二者比较差异有统计学意义(t=-5.39,P=0.000)。但两组背景肝组织SWV比较,差异无统计学意义(t=-1.42,P=0.16),见表4及图3、4。

表3 两组病灶VTI弹性图像病灶硬度特征比较[n(%)]
a:P<0.01,与肝血管瘤比较。

图1 肝转移癌VTI弹性图呈灰黑色

图2 肝血管瘤VTI声像图呈灰白色

图3 典型肝转移癌病灶(SWV=2.42 m/s)

图4 典型肝血管瘤病灶(SWV=1.04 m/s)

组别n病灶SWV肝组织SWV肝血管瘤组291.49±0.411.27±0.24肝转移癌组262.83±1.20a1.37±0.27
a:P<0.01,与肝血管瘤比较。
3 讨 论
弹性是生物组织的重要特性,细胞成分及排列不同导致生物体组织具有不同的弹性指数,并以硬度的形式表现,硬度反映的是瘤体间质组织的阻抗、血管改变及肿瘤扩张导致的实体压力[3-4]。生物组织的硬度与其生物学特性紧密相关,与组织的分子构成及分子所构成组织的形式关联密切,并且病变时其与周围相邻组织情况也相关[5]。组织的硬度可以随着肿瘤的发生、发展、恶变而不同,超声弹性成像反映有关组织内部弹性特征的新信息,可以作为鉴别病变性质的重要参数。
ARFI是一种新的弹性成像技术,可以定性、定量测得组织硬度,其技术原理为利用短时程(<1 s)、高能量聚焦声脉冲作用于组织感兴趣区(ROI),使其产生瞬时、微米级位移(1~10 μm),同时发射声脉冲序列探测组织位移[6]。声脉冲波使组织产生纵向及横向位移,以纵向位移为基础进行弹性成像称为VTI,可直观反映组织弹性,灰阶的明暗反映组织硬度,横向振动以剪切波方式向周边传播,系统会记录并演算出剪切波传播的速度代表组织硬度,SWV值越高,VTI灰黑,组织硬度越大。VTI反映ROI内组织的相对硬度分布,可提供病灶的质地均质性、边界清晰度等特征,并指导VTQ测量,使SWV值更加准确、科学。VTI更加直观,VTQ更加精确。ARFI在成像的技术方法上克服了静态/准静态弹性成像对深部组织无法有效施压的局限性,使得弹性成像的应用领域从浅表器官扩展到较深的人体器官,对于腹部器官检查具有重要意义[7]。
不同组织结构及相同组织结构在不同病理状态下硬度不同。ARFI使组织产生的位移与组织类型有关,提示基于组织弹性特性的不同可应用ARFI技术来区分组织[8]。本研究对55个病灶进行ARFI检查并统计分析,结果显示所有病灶的SWV与背景肝组织SWV不同,说明病变组织的硬度与肝组织不同,利用这一特性ARFI可检出病灶。但是血管瘤组肝组织SWV[(1.27±0.24)m/s]与肝转移癌组肝组织SWV[(1.37±0.27)m/s]比较,差异无统计学意义(P>0.05),且二者多发生在非肝硬化基础上(SWV<1.94 m/s)[9]。肝硬化患者门静脉高压,血液自然分流使进入肝脏的肿瘤细胞减少,而且肝硬化患者的肝脏理化环境不适合恶性肿瘤细胞的生长,故肝转移性癌多发生在非肝硬化基础上。
本研究分别对55个病灶VTI弹性图像与常规二维超声弹性病灶清晰度进行对比分析,结果显示VTI图像病灶显像的清晰度优于常规二维超声,而且肝转移癌VTI弹性图像清晰度要优于肝血管瘤,ARFI能够提高肿瘤的可视性,与文献[10-11]研究结果相似。这可能因为肝转移癌与周围肝组织弹性系数的差值要远大于常规二维超声的声阻抗差值,而血管瘤与周围肝组织见弹性系数的差值与常规超声的声阻抗差值相差不大。本研究还对55个病灶VTI弹性图像病灶大小特征分析结果发现,相对于二维灰阶超声图像,肝转移癌组有69.23%要大于常规二维超声图,而血管瘤组为24.14%,二者比较差异有统计学意义(P<0.01)。此弹性图像特征表现可能与肿瘤的生长方式密切相关,血管瘤为良性肿瘤,呈膨胀性生长,周边无明显浸润,而肝转移癌为恶性肿瘤,呈浸润性生长,并牵拉周围间质成纤维反应使VTI/2D径线增大。
55个病灶中,80.77%肝转移癌呈灰黑色;41.38%血管瘤呈等亮度,31.03%血管瘤呈灰白色。VTQ检查,肝血管瘤病灶SWV平均值为(1.49±0.41)m/s,肝转移癌病灶SWV平均值为(2.83±1.20)m/s,二者比较差异有统计学意义(P<0.01),肝转移癌较肝血管瘤硬度大。与既往研究结果相似[2,12-13]。这可能与肝转移癌生长迅速,存在大量的毛细血管壁,而且肿瘤间质内大量纤维组织增生,肿瘤在纤维间质中浸润生长,其次转移瘤来自其他脏器,瘤细胞与肝细胞异型性较大,故肝转移癌硬度大。肝血管瘤是一种较为常见的肝脏良性肿瘤,以海绵状血管瘤最多见,瘤体柔软,内部间质结构疏松,血管相对较少,可见粗细不均、相互交通的血窦,状如海绵,此病理特征造成其硬度较小。但是海绵状血管瘤内合并血栓或纤维化时或者病理类型为硬化性血管瘤时,病灶硬度增加,VTI弹性图表现为灰黑色,SWV值增大,本研究中SWV值偏高者可能由此原因所致。本研究中4例肝脏转移癌SWV值偏低,其原发肿瘤分别为肺癌2例,贲门癌1例,小肠癌1例,不同组织来源可影响转移癌的硬度值,Venkatesh等[14]研究提出来源于消化道和神经内分泌的癌具有较低的硬度。
本研究发现,声辐射脉冲力成像技术也存在一定的局限性,由于ARFI发射的脉冲波在深部组织信号衰减比较严重,而且剪切波信号本身比较微弱,使得深部组织的剪切波信号常常难以被检测到。此外尚需要兼顾超声安全性的相关规定,ARFI应用受到深度的限制。目前在腹部ARFI技术中,VTI检测的最大深度为10 cm,VTQ为8 cm。过量的脂肪对脉冲波产生衰减作用,肥胖者常导致测量失败。病灶的顺应性是ARFI的限制因素,检查时要求患者屏气或尽量使所测组织保持静止状态,因为ARFI属于静态成像,对运动干扰很敏感,所以肝左叶靠近心脏较近的病灶测量较困难;对于肺脏病变、术后早期、身体条件差及年龄大者,VTI 成像质量及VTQ所测值的准确度较差。VTQ的测量存在测量上限,靶区组织过硬时,无法显示测值,以X.XX m/s表示。此外肝脏转移癌的硬度与原发病灶的相关性有待于进一步研究。
ARFI能使肿瘤的边界显示得更加清晰,能够定性、定量提供组织的硬度信息,作为一种对肿瘤进行检测的新的无创性影像诊断方法,有助于肝转移癌与血管瘤的鉴别诊断。
[1]Friedrich-Rust M,Wunder K,Kriener S,et al.Liver fibrosis in viral hepatitis:noninvasive assessment with acoustic radiation force impulse imaging versus transient elastography[J].Radiology,2009,252(2):595-604.
[2]Shuang-Ming T,Ping Z,Ying Q,et al.Usefulness of acoustic radiation force impulse imaging in the differential diagnosis of benign and malignant liver lesions[J].Acad Radiol,2011,18(7):810-815.
[3]Paszek MJ,Weaver VM.The tension mounts:mechanics meets morphogenesis and malignancy[J].J Mammary Gland Biol Neoplasia,2004,9(4):325-342.
[4]吴刚,王琦,杨龙,等.定量声辐射脉冲成像技术评价肝肿瘤特性的初步研究[J].中华超声影像学杂志,2011,20(3):226-229.
[5]Greenleaf JF,Fatemi M,Insana M.Selected methods for imagines elastic properties of biological tissues[J].Annu Rev Biomed Eng,2003,5(2):57-78.
[6]Fahey BJ,Nightingale KR,Nelson RC,et al.Acoustic radiation force impulse imaging of the abodomen:demonstrat ion of feasibility and utility[J].Ultrasoud Med Biol,2005,31(9):1185-1198.
[7]王彬,李发琪.声辐射力弹性成像:弹性成像的新发展[J].中国医学影像技术,2011,27(4):852-856.
[8]Nightingale K,Soo MS,Nightingale R,et al.Acoustic radiation force impulse imaging:in vivo demonstration of clinical feasibility[J].Ultrasound Med Biol,2002,28(2):227-235.
[9]Fierbinteanu-Braticevici C,Andronescu D,Usvat R,et al.Acoustic radiation force imaging sonoelastography for noninvasive staging of liver fibrosis[J].World J Gastroenterol,2009,15(44):5525-5532.
[10]Fahey BJ,Nelson RC,Bradway DP,et al.In vivo visualization of abdominal malignancies with acoustic radiation force elastography[J].Phys Med Biol,2008,53(1):279-293.
[11]Cho SH,Lee JY,Han JK,et al.Acoustic radiation force impulse elastography for the evaluation of focal solid hepatic lesions:preliminary findings[J].Ultrasound Med Biol,2010,36(2):202-208.
[12]Davies G,Mrc P,Koenen M,et al.Acoustic radiation force impulse elastography in distinguishing hepatic haemangiomata from metastases:preliminary observations[J].Brit J Radiol,2011,84(1006):939-943.
[13]孟洁,张凤娟,周华,等.声辐射力弹性成像技术对肝占位性病变的诊断价值[J].临床超声医学杂志,2012,14(9):613-615.
[14]Venkatesh SK,Yin M,Glockner JF,et al.MR elastography of liver tumors:preliminary results[J].Am J Roentgenol,2008,190(6):1534-1540.
10.3969/j.issn.1671-8348.2016.05.038
类婷婷(1985-),医师,硕士研究生,主要从事腹部超声研究。△
,Tel:18561728036;E-mail:hantongliang_qd@sina.com。
R445.1
B
1671-8348(2016)05-0687-04
2015-08-20
2015-10-19)



