刘璟洁,范清雨,任宏伟,杨新利,向 莉
(西安交通大学第二附属医院神经内科,西安 710004)
吉兰-巴雷综合征临床及系列神经电生理观察研究
刘璟洁,范清雨,任宏伟,杨新利,向 莉△
(西安交通大学第二附属医院神经内科,西安 710004)
目的 对吉兰-巴雷综合征(GBS)进行临床及系列神经电生理观察,以进一步指导临床应用。方法 纳入急性炎性脱髓鞘性多发性神经根神经病(AIDP)患者26例,急性运动轴索性神经病(AMAN)患者14例,在发病2、4、12周行神经电生理检查。收集患者的临床资料以及神经电生理参数。分析比较AIDP及AMAN患者临床、神经电生理特点。结果 AMAN组腹泻的发生率高于AIDP(P<0.05)。AMAN感觉异常出现率小于AIDP(P<0.05)。AIDP运动末梢潜伏期(DML)、运动传导速度(MCV)、远端复合肌肉动作电位(dCMAP)波幅异常均在4周左右达到高峰(P<0.05),到第12周仍未恢复正常;感觉神经动作电位(SNAP)波幅、感觉传导速度(SCV)异常出现晚于运动神经,下肢异常晚于上肢;F波在发病2周内出现率降低,潜伏期延长。而AMAN电生理异质性明显,部分患者dCMAP波幅持续性降低,部分患者dCMAP波幅恢复较快。结论 通过系统观察AIDP与AMAN临床和电生理特点,可以更好地了解疾病进程、评估预后。
吉兰-巴雷综合征;电生理学;神经传导;急性运动轴索性神经病
吉兰-巴雷综合征(GBS)是免疫介导的急性炎性周围神经病变,主要表现为急性起病、四肢对称性的神经根及周围神经损害;主要临床分型包括:急性炎性脱髓鞘性多发性神经根神经病(AIDP)、急性运动轴索性神经病(AMAN)、急性运动感觉轴索性神经病(AMSAN)、急性感觉神经病(ASN)、急性泛自主神经病以及Miller-Fisher 综合征(MFS)等,其中AIDP及AMAN为最常见亚型,其余亚型较少。AIDP及AMAN临床预后差异较大,而神经电生理检查是对GBS进行诊断、分型、观察疾病进展变化、判断预后的重要辅助检查。因此有必要对GBS患者进行系统的临床及神经电生理观察,以进一步指导应用。
1 资料与方法
1.1 一般资料 2013年1月至2015年6月在本院就诊的AIDP患者26例,AMAN患者14例。其中男21例,女19例,年龄19~63岁,平均41.2岁。符合2010年版中国GBS诊治指南中AIDP及AMAN的诊断标准[1],排除糖尿病性、中毒性、药物性、遗传性、代谢性等其他原因所致周围神经病,并除外GBS其余亚型。
1.2 研究方法 所有患者均详细登记临床资料,包括性别、年龄、临床症状、前驱感染史,均于发病达峰时、12周、24周行Hughes评分。Hughes评分标准如下:0分为无症状;1分为症状轻微,能跑;2分为能自行行走,但不能跑;3分为需借助工具或他人才能行走;4分为卧床或轮椅;5分为需要辅助人工呼吸;6分为死亡。达峰时Hughes≤2分为轻型GBS,Hughes>2分为重型GBS。24周时Hughes≤1分为预后良好,Hughes>1分为预后不良。所有患者均应用上海诺成NTS-2000肌电图诱发电位仪于发病2、4、12周完成运动及感觉神经传导速度测定,测定神经包括:双侧正中神经、尺神经、腓总神经、胫神经;测定指标包括:运动末梢潜伏期(DML)、远端复合肌肉动作电位波幅(dCMAP)、运动传导速度(MCV)、感觉神经动作电位波幅(SNAP)、感觉传导速度(SCV)、F波(正中神经、胫神经)出现率及F波潜伏期。根据发病2周时神经电生理检查结果进行临床分型。分析AIDP及AMAN患者临床、神经电生理特点。
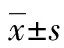
2 结 果
2.1 GBS患者的临床资料 AMAN组发病前腹泻的出现率明显高于AIDP组;AMAN组主观感觉异常出现率明显低于AIDP。AIDP及AMAN两组均无发生死亡的患者,两组在年龄、性别、上呼吸道感染、面瘫、延髓麻痹、心律失常、呼吸肌麻痹、重型患者比例及患者预后方面差异无统计学意义;两组在各时间段Hughes评分上差异无统计学意义,见表1。
2.2 对AIDP及AMAN患者进行系列神经电生理观察 以单侧正中神经、胫神经为例观察其变化趋势与规律,见表2、3。
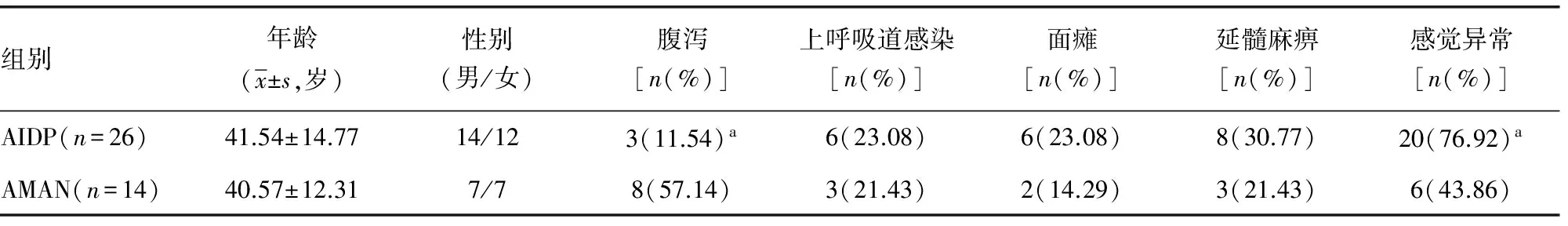
表1 AIDP及AMAN患者临床资料比较
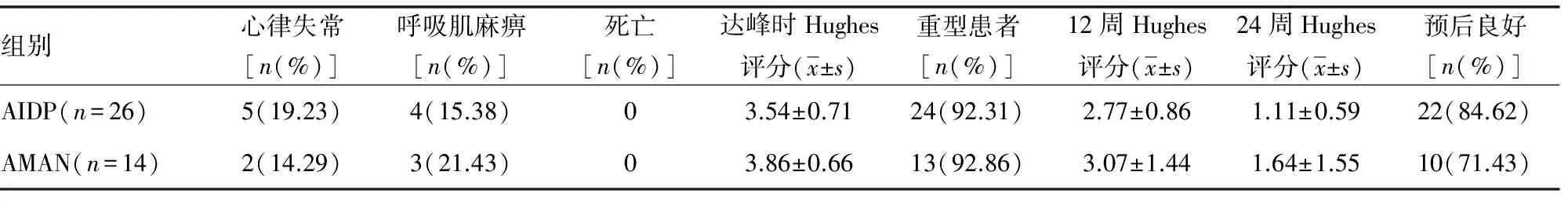
续表1 AIDP及AMAN患者临床资料比较
a:P<0.05,与AMAN组比较。
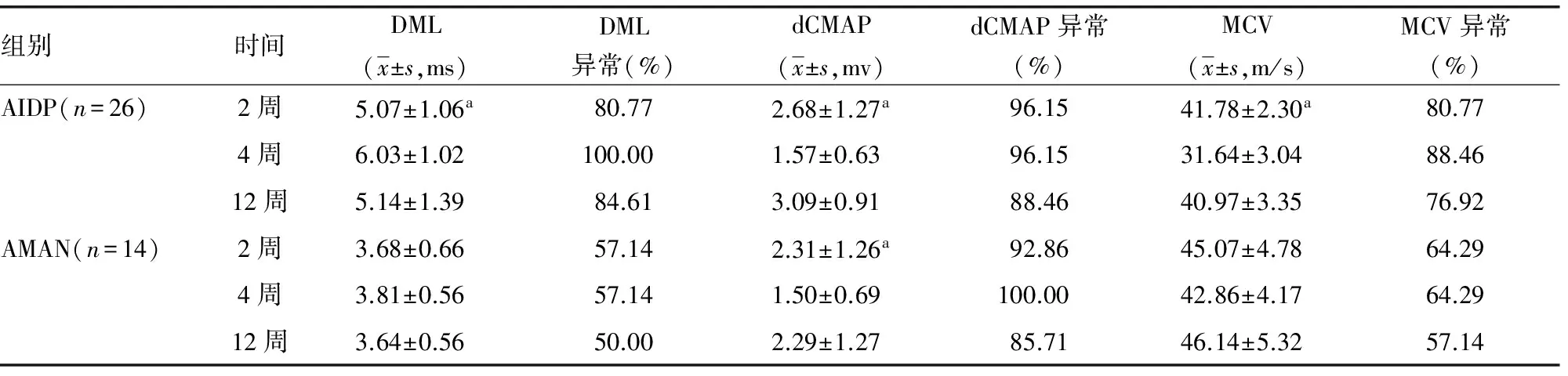
表2 AIDP及AMAN患者正中神经系列神经电生理观察
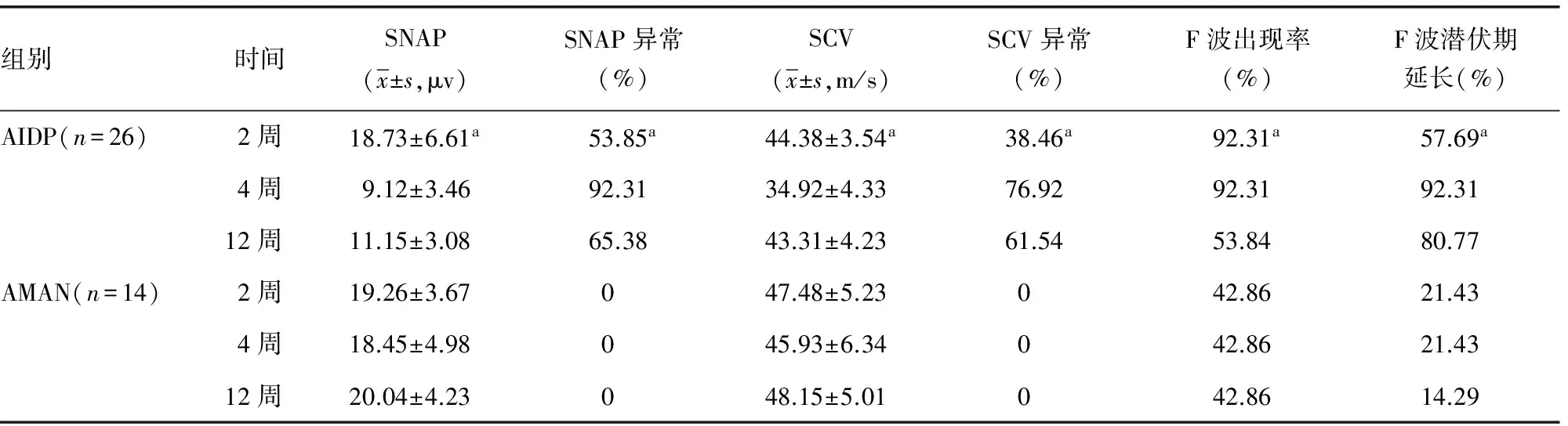
续表2 AIDP及AMAN患者正中神经系列神经电生理观察
a:P<0.05,与同组4、12周比较。

表3 AIDP及AMAN患者胫神经系列神经电生理观察
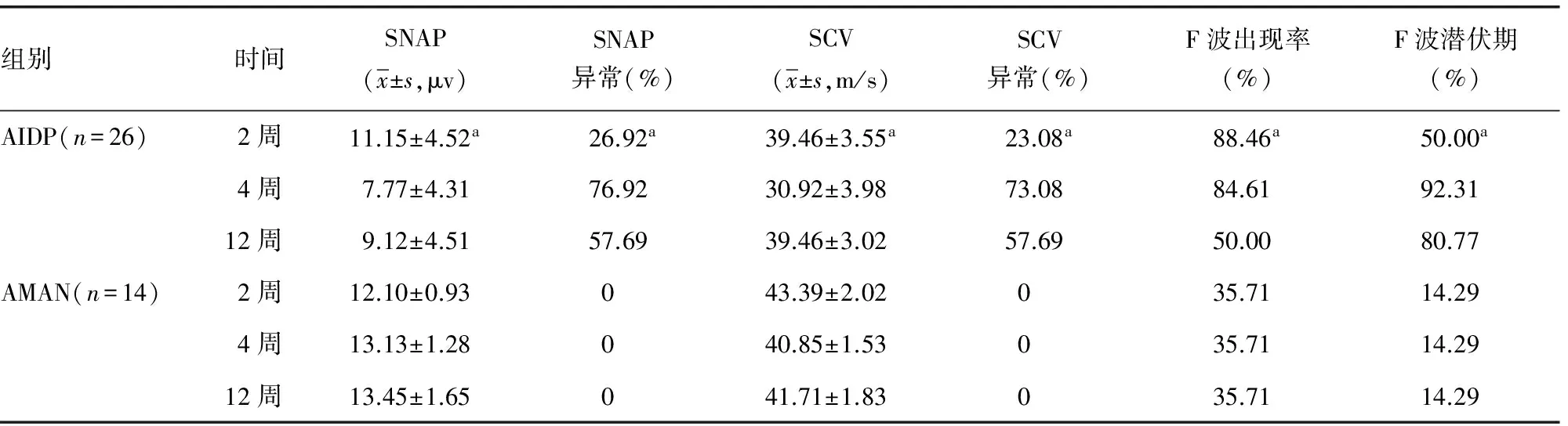
续表3 AIDP及AMAN患者胫神经系列神经电生理观察
a:P<0.05,与同组4、12周比较。
3 讨 论
AIDP及AMAN均为GBS的常见亚型,本研究发现其发病年龄为19~63岁,平均发病年龄为40岁左右,且两组在发病年龄上无明显差异。本研究男性患者稍多,男女比例为1.1∶1.0,但两组患者在男/女比例上差异无统计学意义。1986年Feasby等[2]指出空肠弯曲菌感染与轴索性GBS有关,认为空肠弯曲菌感染是AMAN最常见的前驱事件,并得到了之后众多试验证实[3-6];本研究亦发现AMAN组腹泻的发生率较AIDP高,与既往研究类似。既往研究发现AIDP颅神经麻痹、自主神经功能障碍的发生率高于AMAN组[7];而本研究两组患者在面瘫、延髓麻痹、心律失常的发生率上差异无统计学意义。本研究发现,AIDP组感觉异常的发生率高于AMAN组,AMAN组尽管神经电生理上无感觉神经受累的证据,但部分患者有主观感觉异常,与既往研究一致[7]。AMAN患者的预后差异很大,部分AMAN患者病情重、进展快、预后很差,1986年Feasby等[2]报道的5例AMAN患者有3例出现呼吸衰竭、1例死亡,4例存活患者有3例1年后才能行走;而部分AMAN患者则可在短期内恢复正常。本研究发现AIDP及AMAN两组患者在呼吸肌麻痹、疾病严重程度、预后上差异无统计学意义,但AMAN组整体预后两极分化较为明显,部分恢复快、预后良好,部分恢复缓慢、预后极差,提示AMAN具有明显的病因、病理及临床异质性。
既往研究发现,AIDP患者DML、dCMAP均于发病1~2周开始出现异常, 3周达到高峰[8]。本研究发现,AIDP上肢正中神经及下肢胫神经均于发病2周出现DML延长、dCMAP波幅降低、MCV减慢,且上下肢周围神经病损的程度基本一致;在第4周DML、dCMAP、MCV异常均达到高峰,与既往研究一致;在第12周上述指标均较前有所恢复,但绝大部分患者仍未恢复到正常范围。发病第2周,大部分患者F波出现率明显下降,第12周部分患者已恢复正常;而F波潜伏期延长主要发生于第4周,第12周有所改善但大部分患者仍未恢复正常。F波在发病2周以内主要以出现率下降为主,在2~4周出现率低伴潜伏期延长,在第12周出现率明显恢复,而潜伏期恢复不明显,与潘涛等[9]研究结果一致。在发病第2周部分患者SNAP波幅下降、SCV速度减慢,但大部分患者在正常范围,上肢感觉神经较下肢异常率高、程度重;在第4周上下肢感觉神经均明显受累,SNAP、SCV异常达到高峰;第12周SNAP、SCV有所恢复,但大部分仍未恢复正常。整体来看感觉神经较运动神经受累晚,受累程度轻;下肢感觉神经较上肢感觉神经受累晚,病损程度轻,考虑与下肢腓肠神经较为粗大、含有较多的髓鞘,对炎症的抵抗力较强有关[10]。
AMAN仅累及运动神经,以轴索变性为其主要病理改变,电生理上DML延长、MCV减慢等脱髓鞘改变轻微[11]。本研究发现,AMAN组发病2周DML轻度延长、 MCV轻度减慢,且随着发病时间延长无明显变化,与既往研究一致。而本研究中AMAN组的dCMAP呈以下3种改变形式:(1)发病后dCMAP迅速降低,2周左右达最低点,之后持续维持在低水平,这部分患者dCMAP往往很低甚至测不出来,预后很差;(2)发病后dCMAP逐渐降低,4周左右达最低点,之后逐渐上升,但12周左右仍未恢复正常,这部分患者dCMAP波幅变异很大,预后也有很大差异;(3)dCMAP波幅在2~4周后迅速恢复,12周内基本恢复到正常水平,这部分患者dCMAP波幅变异很大,预后良好。既往研究亦发现AMAN患者存在dCMAP迅速恢复[12-13],考虑原因如下:(1)远端神经末梢存在传导阻滞[14-15],造成dCMAP波幅明显下降;但传导阻滞可较快恢复,使得dCMAP迅速恢复到正常,临床无力症状迅速缓解,预后良好;(2)病变主要累及远端神经末梢[16],轴索的再生和肌肉再支配可以在短期内完成,故dCMAP可较快的恢复,临床恢复也较好。AMAN部分患者F波出现率明显降低,考虑为弥漫性运动神经轴索变性、神经根受累造成;而部分患者出现率正常,考虑这部分患者病变部位主要在神经远端及末梢,神经根未受明显累及,因而F波正常。
总之,AIDP及AMAN各自有其临床及神经电生理特点,其电生理变化具有一定的规律性。通过系统的观察神经电生理变化,可以更好地了解疾病发展的过程并评估预后,进一步提高临床诊疗水平。
[1]中华医学会神经病学分会神经肌肉病学组, 中华医学会神经病学分会肌电图及神经电生理学组,中华医学会神经病学分会神经免疫学组.中国吉兰-巴雷综合征诊治指南[J].中华神经科杂志,2010,43(8):583-586.
[2]Feasby TE,Gilbert JJ,Brown WF,et al.An acute axonal form of Guillain-Barré polyneuropathy[J].Brain,1986,109(pt 6):1115-1126.
[3] 殷香宇,杨珊珊,申龙健,等.吉兰巴雷综合征与空肠弯曲菌感染[J].现代生物医学进展,2015,15(9):1788-1790.
[4]Phongsisay V.The immunobiology of Campylobacter jejuni:Innate immunity and autoimmune diseases[J].Immunobiology,2016,221(4):535-543.
[5]Koga M.Clinical Phenotypes in Guillain-Barré Syndrome[J].Brain Nerve,2015,67(11):1313-1320.
[6]HeikemaAP,IslamZ,Horst-KreftD,etal.Campylobacterjejunicapsulargenotypesarerelatedto Guillain-Barré syndrome[J].Clin Microbiol Infect,2015,21(9):851-859.
[7]Ye Y,Wang K,Deng F,et al.Electrophysiological subtypes and prognosis of Guillain-Barré syndrome in northeastern China[J].Muscle Nerve,2013,47(1):68-71.
[8]Albers JW,Donofrio PD,Mcgonagle TK.Sequential electrodiagnostic abnormalities in acute inflammatory demyelinating polyradiculoneuropathy[J].Muscle Nerve,2006,8(6):528-539.
[9] 潘涛,贾志荣,王亭亭,等.早期吉兰-巴雷综合征的神经电生理特点分析[J].中华神经科杂志,2011,44(11):735-738.
[10]宋聪敏,王英,解旭东,等.吉兰巴雷综合征肌电图的感觉分离现象[J].中华全科医学,2014,12(3):391-392.
[11]张刚,秦新月.急性运动轴索性神经病的研究进展[J/CD].中华临床医师杂志(电子版),2014,8(10):1925-1928.
[12]Ho TW,Li CY,Cornblath DR,et al.Patterns of recovery in the Guillain-Barre syndromes[J].Neurology,1997,48(3):695-700.
[13]王雨晨,冯国栋,王静,等.吉兰巴雷综合征中的传导阻滞与电生理分型变化[J].中华神经精神疾病杂志,2014,40(5):293-297.
[14]孙青,邹漳钮,崔丽英.急性运动轴索性神经病与传导阻滞[J].中华神经科杂志,2011,44(11):774-776.
[15]Kokubun N,Nishibayashi M,Uncini A,et al.Conduction block in acute motor axonal neuropathy[J].Brain,2010,133(10):2897-2908.
[16]Ho TW,Hsieh ST,Nachamkin I,et al.Motor nerve terminal degeneration provides a potential mechanism for rapid recovery in acute motor axonal neuropathy after Campylobacter infection[J].Neurology,1997,48(3):717-724.
Clinical observation and serial electrophysiological study of Guillain-Barre syndrome
LiuJingjie,FanQingyu,RenHongwei,YanXinli,XiangLi△
(DepartmentofNeurology,theSecondAffiliatedHospitalofXi′anJiaotongUniversity,Xi′an,Shanxi710004,China)
Objective To investigate clinical manifestations and serial electrophysiological changes of acute inflammatory demyelinating polyneuropathy(AIDP) and acute motor axonal neuropathy(AMAN).Methods Collect 26 AIDP cases and 14 AMAN cases.Electrophysiological tests were performed at the 2nd,4th and 12th weeks after disease onset.Clinical and electrophysiological characteristics of AIDP and AMAN groups were analyzed.Results There were statistically significant differences in preceding gastroenteritis and sensory symptoms between AIDP and AMAN groups (P<0.05).In AIDP group,DML prolongation,MCV slowing and dCMAP decrease were prominent at 4th week(P<0.05).Until 12th week,they were not recovered completely.In AIDP group,sensory nerves were involved later than motor nerves,and sensory nerves of lower limbs were involved later than upper limbs.F wave frequency was decreased and F wave lantency was prolonged in the first 2 weeks in AIDP group.Electrophysiology of AMAN cases differed significantly:someone with persistent lower amplitude of dCMAP and someone with rapid recovery of dCMAP.Conclusion Clinical diagnosis and prognosis can be evaluated by clinical manifestations and serial changes of electrophysiology.
guillain-barre syndrome;electrophysiology;neural conduction;acute motor axonal neuropathy
刘璟洁(1980-),主治医师,博士在读,主要从事神经电生理的研究。△
,E-mail:601146083@qq.com。
10.3969/j.issn.1671-8348.2016.34.015
R745.4
A
1671-8348(2016)34-4798-03
2016-06-20
2016-09-05)



