方美玲,寇继光,万远太△
(1.武汉科技大学附属天佑医院消化内科,武汉 430000;2.武汉科技大学附属孝感市中心医院消化内科,湖北孝感 432000)
胃癌发病率居消化道恶性肿瘤首位,但胃癌早期病变多呈隐匿性经过,缺乏特异性,当临床症状明显时,多已进展到中晚期[1]。 一直以来,人们对肿瘤标志物进行不断的研究,寻找一种新的简单、快捷、灵敏、便于动态监测的肿瘤标志物,对协助早期诊断及预后判断具有临床指导意义。同源盒基因(homeoboxgene,HOX)A13异常表达及表达产物在多种肿瘤性疾病中可能具有诊断和判断疾病预后的重要意义[2]。文献报道,HOXA13与肝癌、胰腺癌、食管鳞癌、卵巢癌等恶性肿瘤均具有较好的相关性[3-7], 但与胃癌之间的关系甚少涉及。本研究采用免疫组织化学(IHC)染色法检测HOXA13在胃腺癌中的表达情况,旨在通过分析HOXA13蛋白与胃腺癌各临床病理因素及预后之间的关系。为判断 HOXA13基因能否作为一种具有价值的肿瘤分子标记物提供证据。
1 资料与方法
1.1一般资料 收集武汉科技大学附属孝感市中心医院普外科2011年12月至2017年6月经手术治疗的胃癌患者的临床病例资料,选择病检结果为胃腺癌的66份石蜡包埋组织标本(胃癌组),所有患者术前均行胃镜检查且未接受放化疗及其他辅助治疗,术后病检结果符合美国癌症联合会(AJCC)与国际抗癌联盟(UICC)临床分期标准。另选择胃内镜黏膜下剥离术(ESD)术后病检为胃癌癌前病变组织(上皮内瘤变)20份(癌前组)、胃镜下活检为正常胃黏膜组织20份(对照组)的石蜡包埋组织标本。临床病例资料及随访资料完整。行胃镜检查且未接受放化疗及其他辅助治疗,术后病检结果符合美国癌症联合会(AJCC)与国际抗癌联盟(UICC)临床分期标准。另选择胃内镜黏膜下剥离术(ESD)术后病检为胃癌癌前病变组织(上皮内瘤变)20份(癌前组)、胃镜下活检为正常胃黏膜组织20份(对照组)的石蜡包埋组织标本。临床病例资料及随访资料完整。
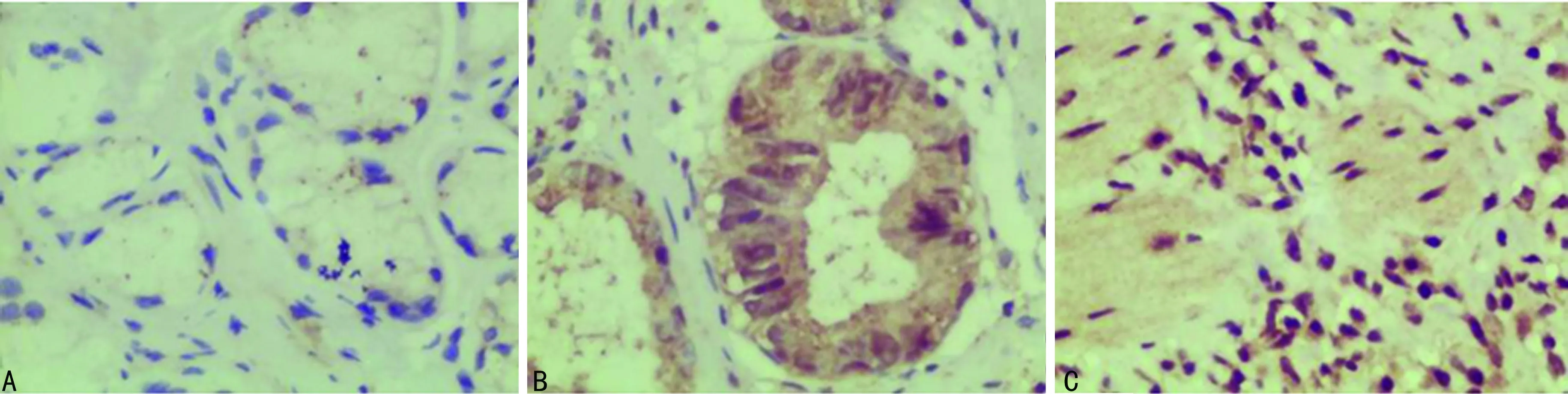
A:对照组;B:癌前组;C:胃癌组
1.2方法
1.2.1IHC染色 石蜡切片脱蜡至水;3%H2O2孵化10 min,磷酸缓冲盐溶液(PBS)缓冲液冲洗5 min,共3次;乙二酸四乙酸(EDTA)抗原修复液(pH8.0)经高压锅加热至沸腾并将标本修复,用5%牛血清清蛋白(BSA)封闭液常温下孵育2 h;一抗[兔抗人HOXA13多克隆抗体(稀释浓度为1∶200),购自美国Abcam公司;Ki-67购自北京中杉金桥公司]4 ℃孵育过夜,PBS缓冲液冲洗10 min,共3次,二抗[生物素标记山羊兔IgG(购自博士德生物工程有限公司)]室温下孵化30 min,PBS缓冲液冲洗10 min,共3次。二氨基联苯胺(DAB)染色8 min,自来水充分冲洗,苏木素复染、水洗,稀盐酸分色、反蓝、脱水、透明、封片,显微镜观察。
1.2.2结果判定 IHC染色后切片由两位不了解研究内容及标本信息的病理科诊断医生进行结果判断。IHC染色等级评分:0分为阴性,1分为弱阳性,2分为中等阳性,3分为强阳性;染色范围等级评分:0~<1%为0分,1%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%~100%为4分;根据以上两个评分总和再分为3组: 0~1分判定为阴性表达,>1~4分判定为弱阳性表达,>4~7分判定为强阳性表达。 其中阳性包括弱阳性及强阳性。
1.3统计学处理 采用SPSS13.0软件进行统计学分析,计数资料以率表示,组间比较采取χ2检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1各组标本组织中HOXA13蛋白表达比较 HOXA13蛋白在胃腺癌中的表达部位主要在癌细胞的细胞核,亦有少部分细胞质表达。HOXA13蛋白在对照组、癌前组、胃癌组的阳性表达率分别为5.00%(1/20)、30.00%(6/20)、74.24%(49/66),3组比较差异均有统计学意义(P<0.01)。各组标本组织中HOXA13蛋白表达,见图1。
2.2HOXA13蛋白表达与胃腺癌患者不同临床病理特征的关系 HOXA13蛋白表达与患者性别、年龄、肿瘤大小及分化程度无明显相关性(P>0.05);与胃腺癌的T、N分期及UICC分期明显相关(P<0.05),见表1。
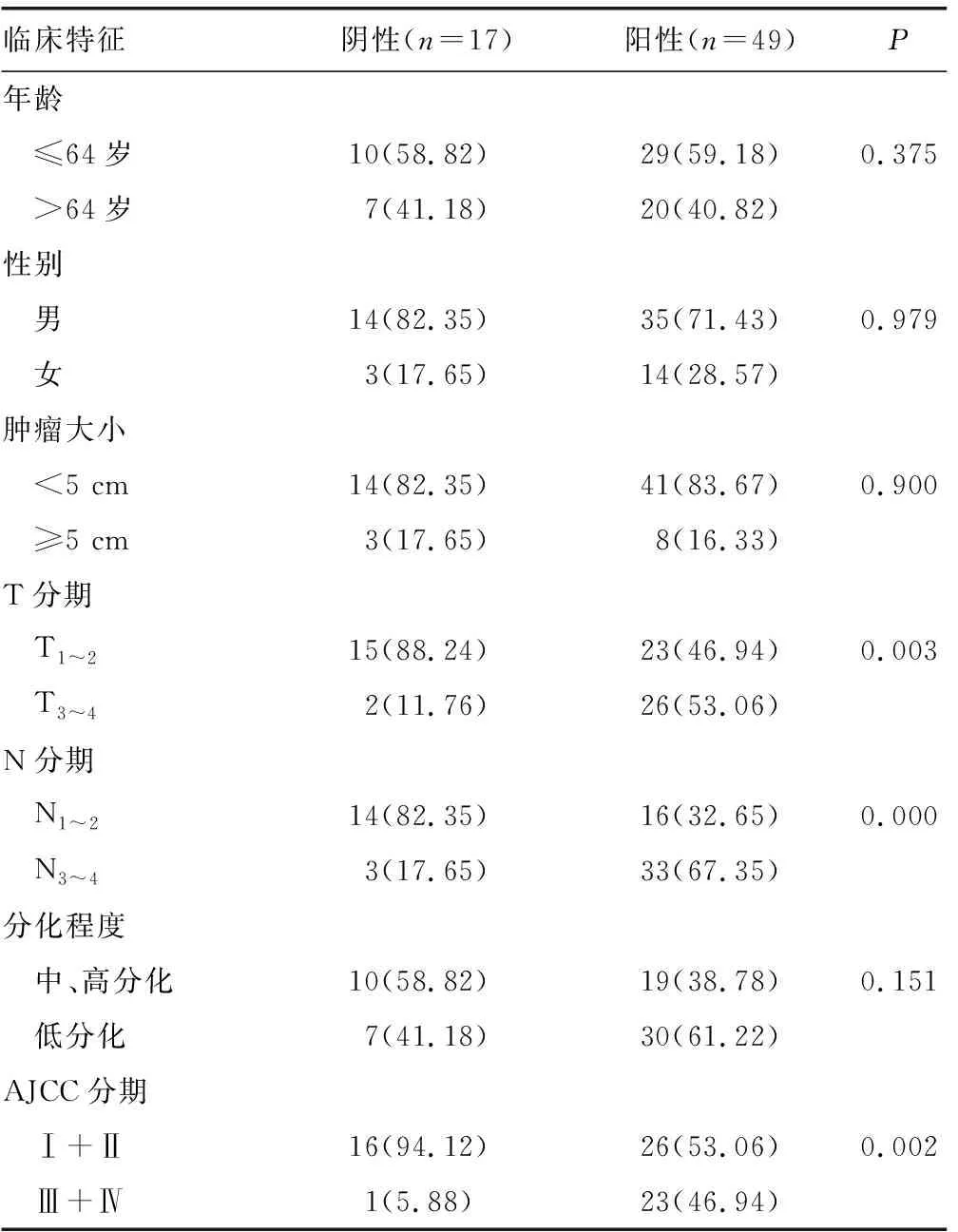
表1 HOXA13表达与患者临床特征间的关系[n(%)]
2.3胃腺癌患者HOXA13与Ki-67蛋白表达的相关性分析 胃腺癌患者中HOXA13与Ki-67蛋白表达,具有明显相关性(r=0.472,P<0.05),见表2。
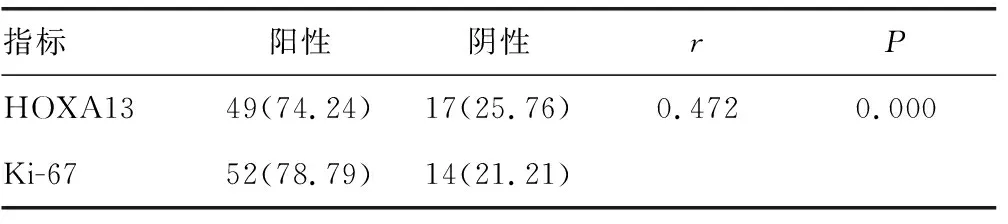
表2 患者HOXA13与Ki-67表达的相关性分析[n(%),n=66]
3 讨 论
HOX首先在果蝇体内发现,在包括人在内的动物的胚胎发育和细胞分化中发挥重要作用的一类基因,该基因序列中含180~183个碱基组成的保守序列,该序列编码的60~61个氨基酸所构成的保守序列,成为同源结构域或同源盒。HOX属于Ⅰ类同源异型盒基因,具有高度保护性,根据序列的相似性及在染色体上的位置,可以将COX分为A、B、C、D四族。分别位于7(HOXA)、17(HOXB)、12(HOXC)、2(HOXD)号染色体上,根据族间序列的相似性及基因在染色体上的位置又可分为13组,目前已鉴定的哺乳类动物的HOX共有39个基因[8-12]。
HOXA13基因属于HOXA家族中的一员,位于7号染色体的5′末端,正常情况下,其对胚胎时期四肢的发育、生殖系统的形成和组织血管的形成具有重要作用。HOXA末端的转录物(HOTTIP)是一段非编码的RNA,也是多种肿瘤疾病的癌基因,HOTTIP沉默在体内外通过降低Bcl-2和加强Bax表达抑制细胞存活通路,HOTTIP抑制cycling D1的表达和促使细胞周期阻滞在G0/G1期。向下调节HOTTIP可导致HOXA13的表达降低[4-5,13-14]。目前对于HOXA13引起胃癌发生、发展的机制也有其他相关的研究,HOXA13通过转化因子β信号通路(TGF-β)增加胃癌细胞入侵和上皮-间叶细胞之间的转化(EMT)[15];HOXA13通过HOXA联合靶点反式激活胰岛素样生长因子结合蛋白3(IGFBP-3),从而提高胃癌细胞的致癌性和侵袭性;HOXA13通过调节钙黏蛋白-17(CDH17)激活Wnt-βcatenin信号通路上调DKK1、cmyc、cyclinD1的表达促进胃癌细胞的增殖等[16-17]。HOXA13可能成为新的胃腺癌早期诊断血清学分子标记物[18]。
本研究结果显示,HOXA13蛋白在胃腺癌中的表达明显高于胃癌癌前病变组织,差异有统计学意义(P<0.05),而在正常胃黏膜组织中,HOXA13蛋白几乎不表达;HOXA13蛋白过表达与胃腺癌T、N分期及UICC分期具有相关性,病理分期越高,HOXA13表达逐步增强,表明HOXA13在肿瘤扩散过程中可能有重要影响。
Ki-67基因位于第10号染色体上,与细胞增殖有明显相关性,其表达产物为细胞核内的对蛋白酶极其敏感的大分子蛋白质分子,该基因在除G0期以外的细胞各增殖周期中都有表达,包括G1、S、G2、M期。有研究发现随着细胞增殖周期的逐渐发展,Ki-67的表达不断增加,于M期达高峰,有丝分裂后期Ki-67表达量则快速下降,该研究认为Ki-67通过与染色体相连参与细胞有丝分裂,Ki-67抗原在M期后的细胞中迅速消失。由此可见,Ki-67可以作为评价细胞增殖的一个敏感指标[19]。本研究显示,HOXA13蛋白表达与Ki-67蛋白表达存在相关性(r=0.472,P<0.01),HOXA13蛋白增加可能在评价胃腺癌细胞增殖分化有临床意义的说服力。
在人体其他系统肿瘤中,HOXA13基因的研究也不少,如前列腺癌[20]、卵巢癌[7]、T细胞急性淋巴细胞白血病[21]等,HOX基因家族与肿瘤发病机制的研究日益受到重视,特别是HOXA13/HOTTIP,但其与肿瘤发病机制和信号调节通路仍不清楚,需要进一步研究,HOXA13/HOTTIP可能为以后肿瘤性疾病的早期诊断提供分子生物学标志物及预测肿瘤预后的标志物之一。同时,HOXA13作为促进肿瘤增殖、侵袭转移的一个独立影响因子,提示其可能作为肿瘤基因靶向治疗的一个有效靶点。
目前对HOXA13在消化道及其他系统肿瘤的研究缺乏具体的机制研究,阐明HOXA13与肿瘤的发生、发展及预后仍需进一步的研究和探讨,随着研究的不断深入,HOXA13有待成为肿瘤诊断和治疗提供新的基因靶点。



