张灵俐,王 婷,刘文慧,杜 静,王 浩△
(1.广东药科大学附属第一医院妇产科,广州 510310;2.广东药科大学公共卫生学院,广州 510310)
女性卵巢早衰(premature ovarian failure,POF)一直无十分有效的治疗手段,但间充质干细胞(mesenchymal stem cells,MSC)的快速发展为治疗POF开拓了新方向[1]。MSC主要来源为骨髓、脂肪和脐带,骨髓MSC存在人来源水平极低、病毒感染率高、增殖分化潜能随年龄增大下降等风险[2]。人脐带MSC(hUCMSCs)取材方便,免疫原性低,对不同程度受损组织有修复作用,可作为目前理想种子源细胞[3]。国内外已有相关研究,但确证性实验证据不足,且改善卵巢储备、生育功能作用机制尚不清楚,临床进展缓慢[4-5]。本实验旨在观察hUCMSCs治疗环磷酰胺(CTX)建立POF模型大鼠的卵巢结构功能变化,验证此种疗法的可行性及其可能的治疗机制,为hUCMSCs临床应用提供参考依据。
1 材料与方法
1.1材料 SPF级SD雌性大鼠62只,体质量(200±11)g,购自广东省医学实验动物中心。检疫4 d合格后进入实验,饲养温度与湿度:20~26 ℃,40%~70%,10 h∶14 h昼夜间断照明,自由进食饮水。CTX购自德国Barter Oncology Gmbh。血清检测ELISA试剂盒购于南京建成生物。选择预产期前1个月内母血检测传染性病毒阴性者足月分娩胎儿的脐带作样本,与产妇签订知情同意书。组织贴壁法分离培养源细胞,后续试验均采用第5代hUCMSCs。
1.2方法
1.2.1大鼠POF模型建立 雌性SD大鼠(n=62)随机数字表法分成阴性对照(A组,n=18)、模型对照(B组,n=22)和hUCMSCs移植组(C组,n=22)。参照文献[6-7]实验,避免一次性大剂量注射CTX大鼠有致死风险,剂量不足可致造模失败,改进方案:B、C组第1天、第2~15天分别注射CTX 10.00、3.20 mg/mL(5 mL/kg,1次/天,腹腔注射)[8]。A组注射等体积灭菌水。B、C组建模成功后各取18只大鼠用于后期实验。建模前及完成后1 d尾静脉采血测卵泡刺激素(FSH)、雌二醇(E2)水平。建模完成后2 d尾静脉移植生长良好的第5代hUCMSCs单细胞悬液1 mL(1×106/mL)至C组。A、B均注射等量灭菌水。移植后1、17 d分组取血和卵巢组织测量各项指标。
1.2.2观察指标
1.2.2.1血清检测指标 CTX建模前后检测血清中E2和FSH水平综合评估POF模型构建是否成功。hUCMSCs移植后1、17 d取3组大鼠每组6只,腹主动脉采血,ELISA检测血清中FSH、黄体生成素(LH)、抑制素B(INHB)和抗苗勒管激素(AMH),对比FSH/LH值。
1.2.2.2HE染色 hUCMSCs移植后1、17 d取大鼠(每组6只)卵巢HE染色切片观察组织形态,计算卵巢中生长卵泡、闭锁卵泡与黄体数。
1.2.2.3荧光标记原位杂交技术(FISH)检测ALU基因表达 hUCMSCs移植后17 d用FISH检测大鼠(每组6只)卵巢中是否表达人的特异性基因序列ALU,通过设计ALU特异性探针,如果阳性则代表卵巢中存在人的细胞,证明移植的hUCMSCs存在于大鼠卵巢,取乳腺癌组织为阳性对照。
1.2.2.4免疫组织化学(IHC)检测天冬氨酸蛋白水解酶3(caspase-3) 移植后17 d取大鼠卵巢组织切片,IHC染色法处理,显微镜下随机选取3个200倍放大视野使用IPP6.0对含半胱氨酸的caspase-3信号进行光密度值半定量分析。组织学观察正常情况下只在闭锁卵泡的颗粒细胞和黄体中的黄体细胞和膜细胞阳性表达caspase-3信号,POF患者除了在前3种细胞中表达外,生长卵泡和成熟卵泡的颗粒细胞中也呈阳性表达。

2 结 果
2.1各组大鼠血清E2、FSH水平比较 建模前1 d A、B、C 3组大鼠血清E2、FSH水平比较,差异均无统计学意义(P>0.05)。建模后1 d,B、C组E2水平均低于A组,FSH水平均高于A组,差异均有统计意义(P<0.05),而B、C组间E2、FSH水平比较,差异均无统计学意义(P>0.05),见表1。
a:P<0.05,与A组比较
2.2各组大鼠卵巢储备功能比较 3组大鼠移植后1、17 d,FSH/LH比值比较,差异均无统计学意义(P>0.05)。移植后1 d,B、C组INHB、AMH水平均低于A组(P<0.05);B、C组间差异无统计学意义(P>0.05)。移植后17 d,C组相较B组INHB水平增加(P<0.05),但仍低于A组(P<0.05);AMH水平较B组增加,与A组比较差异无统计学意义(P>0.05),见表2。
2.3各组大鼠卵巢组织HE染色结果比较 各组大鼠卵巢组织结构完好,可见各级卵泡及黄体。A组大鼠卵巢组织结构未见异常,闭锁卵泡数量较少;B组大鼠较A组卵巢体积减小、生长卵泡减少、闭锁卵泡增加,差异均有统计学意义(P<0.05);C组大鼠较B组生长卵泡增多、闭锁卵泡减少,差异均有统计学意义(P<0.05)。各组大鼠两个时间点黄体数量均未见明显变化(P>0.05)。各组大鼠移植后1、17 d卵巢组织HE染色结果,见图1、表3。
2.4hUCMSCs移植后17 d卵巢中人ALU基因表达情况 DAPI染色阳性对照细胞核呈蓝色,图中被染成红色的即为人ALU基因序列探针。取A组卵巢组织为阴性对照,观察发现被染成蓝色的细胞核,并无红色斑点存在。移植hUCMSCs后1、17 d卵巢组织中均能观察到被染成红色的人ALU基因,且能在少量的颗粒细胞及卵子细胞中观察到被染成红色的人ALU基因,见图2。
2.5各组大鼠caspase-3水平比较 光密度值半定量分析,移植后1、17 d caspase-3免疫组织化学结果均显示C组信号表达量高于B组,B组信号表达量高于A组,差异均有统计学意义(P<0.05)。组织学观察,发现caspase-3信号在A、C组中表达在闭锁卵泡的颗粒细胞和黄体中的黄体细胞和膜细胞,生长卵泡和成熟卵泡的颗粒细胞不表达;caspase-3信号在B组的闭锁卵泡的颗粒细胞、黄体中的黄体细胞和膜细胞,以及生长卵泡和成熟卵泡的颗粒细胞中均表达,见图3、表4。

图1 3组大鼠移植后卵巢HE染色结果(HE,×40)

A:阳性对照;B:阴性对照;C:hUCMSCs移植1 d;D:hUCMSCs移植17 d

图3 caspase-3信号在3组大鼠卵巢组织中表达情况(HE,×200)
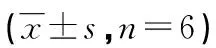
表2 3组大鼠移植后卵巢储备功能评价指标比较
a:P<0.05,与A组比较;b:P<0.05,与B组比较
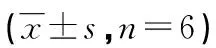
表3 3组大鼠移植后卵泡计数比较
a:P<0.05,与A组比较;b:P<0.05,与B组比较

表4 caspase-3 IHC分析结果
a:P<0.05,与A组比较;b:P<0.05,与B组比较
3 讨 论
MSC起源于中胚层,具有自我复制和多向分化潜能。近年来,大量研究表明,MSC具备机体损伤及免疫调节的功能,被广泛地应用于心血管、血液和神经系统等多方面疾病的临床前研究中。来源于新生儿组织(脐带血)的多功能MSC是再生医学中极有潜力的干细胞群体[9],本研究结果表明,hUCMSCs移植治疗后大鼠与未治疗大鼠相比,颗粒细胞细胞核膜逐渐修复,核仁出现,内质网与线粒体少量存在,说明hUCMSCs对卵巢颗粒细胞有修复作用。同时,光密度值半定量分析法检测到,C组治疗后大鼠卵泡中caspase-3的信号表达低于B组,且在生长卵泡和成熟卵泡中检测不到caspase-3信号,说明hUCMSCs可以减少生长卵泡凋亡。因此,本实验为hUCMSCs治疗POF提供了实验室依据,运用hUCMSCs治疗POF大鼠具有可行性,其可改善卵巢储备功能。
CTX会造成颗粒细胞的损伤[10],颗粒细胞是包绕在卵母细胞周围的一层菱形或扁平细胞,在卵母细胞发育成熟过程中起信号传导与营养支撑作用,对维持卵泡正常功能极为重要。研究发现B组大鼠颗粒细胞核溶解、核膜消失、线粒体空泡化,线粒体与内质网数量逐渐减少,对比hUCMSCs移植治疗后大鼠,证明了hUCMSCs对卵巢颗粒细胞的修复作用。可以推测hUCMSCs是通过修复卵巢颗粒细胞、减少生长卵泡凋亡而达到修复受损卵巢的作用。人鼠之间存在较大种族差异,但人与人之间不存在此种隔阂,使用人胚胎来源的hUCMSCs来治疗人类POF,临床实施可行性大大提高[11]。
朱少芳[12]将hUCMSCs移植进POF小鼠体内,在卵巢中发现了供体来源的卵母细胞,小鼠生殖能力得到改善,认为MSC有向受损部位浓集并分化成卵母细胞进行卵巢修复的特性[13]。本研究用FISH检测法观察到卵巢间质、颗粒和卵子细胞中均存在少量人ALU基因,证明hUCMSCs在卵巢间质中有分布,且有少量分化成了颗粒和卵子细胞。这说明通过尾静脉注射hUCMSCs可成功到达卵巢,与李彩霞等[14]发现BMSCs定向卵巢部位归巢能力的结果一致,其且与BMSCs有相同特性,可改善大鼠生殖能力,论证了静脉注射移植hUCMSCs的可行性。此外,静脉注射创伤性远小于卵巢原位注射,操作可行性高,也为hUCMSCs运用于临床治疗POF奠定了基础。
本实验选用FSH/LH、INHB、AMH 3个临床上较优的评价指标[15]。结果发现POF大鼠移植hUCMSCs后17 d,血清中AMH、INHB水平均上升,足以说明hUCMSCs可以有效地改善卵巢储备功能。这对改善临床上POF患者不孕状况,具有十分重要的意义。hUCMSCs治疗POF有两个可能的途径:(1)通过修复颗粒细胞等功能型细胞来修复受损卵巢;(2)直接分化成卵巢内颗粒细胞和卵子细胞对卵巢进行修复。hUCMSCs在POF相关疾病中的研究成果大多局限于动物模型,实际应用于临床仍需继续探索。此外,POF产生机制尚不完全清楚,今后应开展更多、更全面的深入研究,为POF的治疗提供一个新的可行途径。



