李明珂,陈徐佳,武绍梅,文孟良,董向前,艾 黎,边 莉,朱云珍,罗 娟,马岚青△
(1.昆明医科大学第一附属医院消化内科/云南省消化疾病研究所,昆明 650032;2.云南大学生命科学学院,昆明 650091;3.昆明医科大学第一附属医院病理科,昆明 650032)
随着乙醇在全世界范围内的广泛消费,其已逐渐成为引起肝脏疾病的主要原因[1]。近年来,人参皂苷抗慢性肝病的研究正成为热点。人参皂苷含20多种单体成分,如人参皂苷Rg1、Rg3、Rb1、Rh1、Rh2等。研究表明,人参皂苷能明显降低酒精性损伤小鼠的肝脏系数、血清三酰甘油(TG)水平及丙氨酸转氨酶(ALT)、天冬氨酸氨基转移酶(AST)活力,可在一定程度上降低肝脏组织中丙二醛水平,减少组织病理损伤[2]。作为人参皂苷单体代谢产物,人参皂苷Rh1及CK在酒精性肝损伤过程中有着怎样的作用,本文通过诱导大鼠酒精性肝病(alcoholic liver disease,ALD)模型,对经不同处理后各组大鼠的肝酶水平、肝组织病理及线粒体体视学变化进行对比、分析,希望能为今后提取人参皂苷有效成分治疗ALD提供理论依据。
1 材料与方法
1.1材料
1.1.1药物与试剂 人参皂苷Rh1、人参皂苷CK、人参皂苷Rh1∶CK=1∶1混合物、三七总皂苷(PNS)由云南与诺生物工程有限责任公司参照文献[3]报道的方法从人参或三七药材中提取、酶转化、分离和纯化;含量:高效液相色谱(HPLC)≥99%;红星二锅头(北京红星股份有限责任公司生产)购于沃尔玛超市;金龙鱼玉米油(西班牙生产)购于沃尔玛超市;吡唑、10%甲醛、2%戊二醛、0.9%生理盐水购于昆明医科大学第一附属医院。
1.1.2动物 健康SD大鼠100只,体质量(180±20)g,雄鼠,购自昆明医科大学动物科,动物合格证号:SCXK(滇)2015-0004。室温喂养,自由饮食饮水。
1.2方法
1.2.1实验分组及ALD大鼠模型的制备 将100只健康雄性SD大鼠分为对照组、模型组、Rh1组、CK组、Rh1-CK组及PNS组6组,模型组和对照组每组10只,其余每组20只。除对照组外,每天清晨给予其余各组大鼠56度红星二锅头-吡唑-玉米油混合液灌胃,其中玉米油的摄入量为(2 g·kg-1·d-1),吡唑的摄入量为(24 mg·kg-1·d-1),白酒量及营养液灌胃量根据大鼠体质量变化、毛色、活跃程度及死亡情况进行调整。按上述方法喂养大鼠共16周后,抽取每组大鼠各2只,进行眼眶静脉采血检测肝功能,采血后取肝脏组织做石蜡切片行HE染色,观察肝脂肪变性程度及肝细胞形态变化情况,检验大鼠ALD模型的制备情况。
1.2.2药物干预 ALD模型制备成功后,大鼠每天清晨称质量,每组大鼠除继续同1.2.1项下喂养以外,将(60 mg·kg-1·d-1)的人参皂苷Rh1、CK、Rh1∶CK=1∶1混合物及PNS溶于56度红星二锅头-吡唑-玉米油混合液分别灌胃Rh1组、CK组、Rh1-CK组、PNS组大鼠,同时模型组和对照组给予等容量0.9%生理盐水,治疗时间为3周。
1.2.3动物处理 治疗3周结束后,大鼠禁食不禁水1 h后,称体质量,于眼眶静脉采血,用超速离心机离心血液,分离出血清,同时剖腹取肝脏组织,固定于2.5%戊二醛溶液。
1.2.4检测指标 观察大鼠肝脏:用肉眼对所有大鼠肝脏的质地和色泽等进行观察,并行肝脏HE染色,检验大鼠ALD模型的制备情况,比较各组大鼠肝脏脂肪变程度。用全自动生物化学分析仪检测大鼠血清生物化学指标:大鼠血清ALT、AST、碱性磷酸酶(ALP)、总胆红素(TB)、直接胆红素(DB)及谷氨酰转肽酶(GGT)。
1.2.5肝细胞电镜标本制作及读片 由病理专业医师制作电镜标本,将制作好的标本编号登记后打乱,在JEM-1011型透射电镜下对肝细胞、细胞间质、肝细胞胞质及线粒体进行详细观察,选择反差好、无污染及制片过程无损坏的部位进行拍照,在低倍下拍摄肝细胞及间质,高倍下拍摄肝细胞胞质及线粒体,电镜摄片由病理专业医师读片。对线粒体的体视学分析要求高倍(30 000倍)下每组拍摄不少于30张照片[4]。体视学定量分析主要针对超微形态下线粒体进行研究,选择肝细胞质为参照系。采用的体视学指标有:体积密度(Vvm),为某一结构的体积与其所在的参照系体积之比;比表面(Qm),为结构成分的表面积与体积之比;面积密度(Svm),为某一膜结构的面积与其所在的参照系体积之比;面数密度(Nam),为单位面积参照系界面中包含的某种颗粒的截面数。将所摄拍的电镜照片在HPIAS-1000高清晰度彩色病理图文报告分析系统new下测得以下二维图像上的线粒体初级参数:(1)截面积;(2)截面曲线长;(3)线粒体(截面)数。由以上二维参数计算出肝细胞线粒体的Vvm、Svm、Nam、Qm。
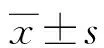
2 结 果
2.1各组大鼠血清生化指标检测水平比较 模型组大鼠的ALT、AST水平明显高于对照组和各加药组,差异均有统计学意义(P<0.05);与模型组比较,Rh1-CK组大鼠ALP水平明显下降(P<0.05)。各组大鼠胆红素水平比较,差异无统计学意义(P>0.05),见表1。
2.2各组大鼠肝组织HE染色观察结果 肝脏HE染色显示,对照组可见肝细胞排列整齐,以中央静脉为中心,向周围呈放射状排列;模型组可见肝细胞排列紊乱,肿大变圆,细胞间隙变大,肝细胞含大量脂滴,中央静脉缺如,可见大量胶原沉积于细胞间质,大量炎性细胞浸润;PNS组可见中央静脉及肝细胞间质受累,一定数量炎性细胞浸润,肝细胞肿胀,含大量脂滴,一定量胶原沉积;Rh1组、CK组、Rh1-CK组大鼠肝脏HE染色改变介于对照组与模型组之间,肝细胞大致以中央静脉为中心,向周围呈放射状排列,可见少量脂滴,细胞间质可见少量炎性细胞浸润,见图1。
2.3各组大鼠肝组织的电镜观察结果 对照组大鼠肝细胞电镜下观察,见细胞核圆,核仁大,核膜清晰,核染色质分布均匀,核仁明显;肝细胞内有丰富的细胞器,可见大量核糖体、内质网和线粒体,分布正常,脂滴少见,线粒体形态多为圆形或椭圆形,内可见基质颗粒,粗面内质网呈层状排列;Disse间隙内有丰富的微绒毛;毛细胆管内无淤胆;Disse间隙内无胶原纤维增生;肝细胞间隙稀疏,胞间偶见少量胶原纤维,肝细胞超微结构正常。模型组大鼠肝脏电镜下见肝细胞内大量大小不等的脂质空泡变性,部分肝细胞质水肿,线粒体可见增生肥大、肿胀,少数可见固缩,部分细胞内线粒体残体增多,基质颗粒减少,甚至出现致密、边界不清的絮状物,内质网成囊状扩张,并有脱颗粒;肝血窦可见淤血、扩张,Disse间隙变窄。PNS组大鼠肝脏电镜下见与模型组相似,肝细胞内见一定数量脂肪空泡变性,部分线粒体肿胀,内质网呈囊状扩张;可见肝血窦淤血、扩张;Disse间隙明显增宽,微绒毛较多,胶原沉积减少;较模型组对ALD无明显改善作用。Rh1组、CK组、Rh1-CK组各组内大鼠肝脏电镜观察基本改变介于对照组与PNS组之间,见图2。
2.4肝细胞线粒体体视学分析 以下照片数均为38张。Rh1组、Rh1-CK组及模型组Vvm较对照组明显增高(P<0.05);CK组、PNS组较对照组有所增高,但差异无统计学意义(P>0.05)。Rh1组、Rh1-CK组、PNS组及模型组Svm较对照组明显增高(P<0.05);CK组、Rh1组、Rh1-CK组、PNS组Svm较模型组明显降低(P<0.01)。Rh1组、PNS组、模型组Nam较对照组明显增高(P<0.01);CK组、Rh1组、Rh1-CK组Nam较模型组明显降低(P<0.05)。对照组大鼠Qm高于其他组,但差异无统计学意义(P>0.05),见表2。
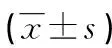
表1 各组大鼠肝功能检测结果比较
a:P<0.05,与模型组比较;b:P<0.05,与对照组比较
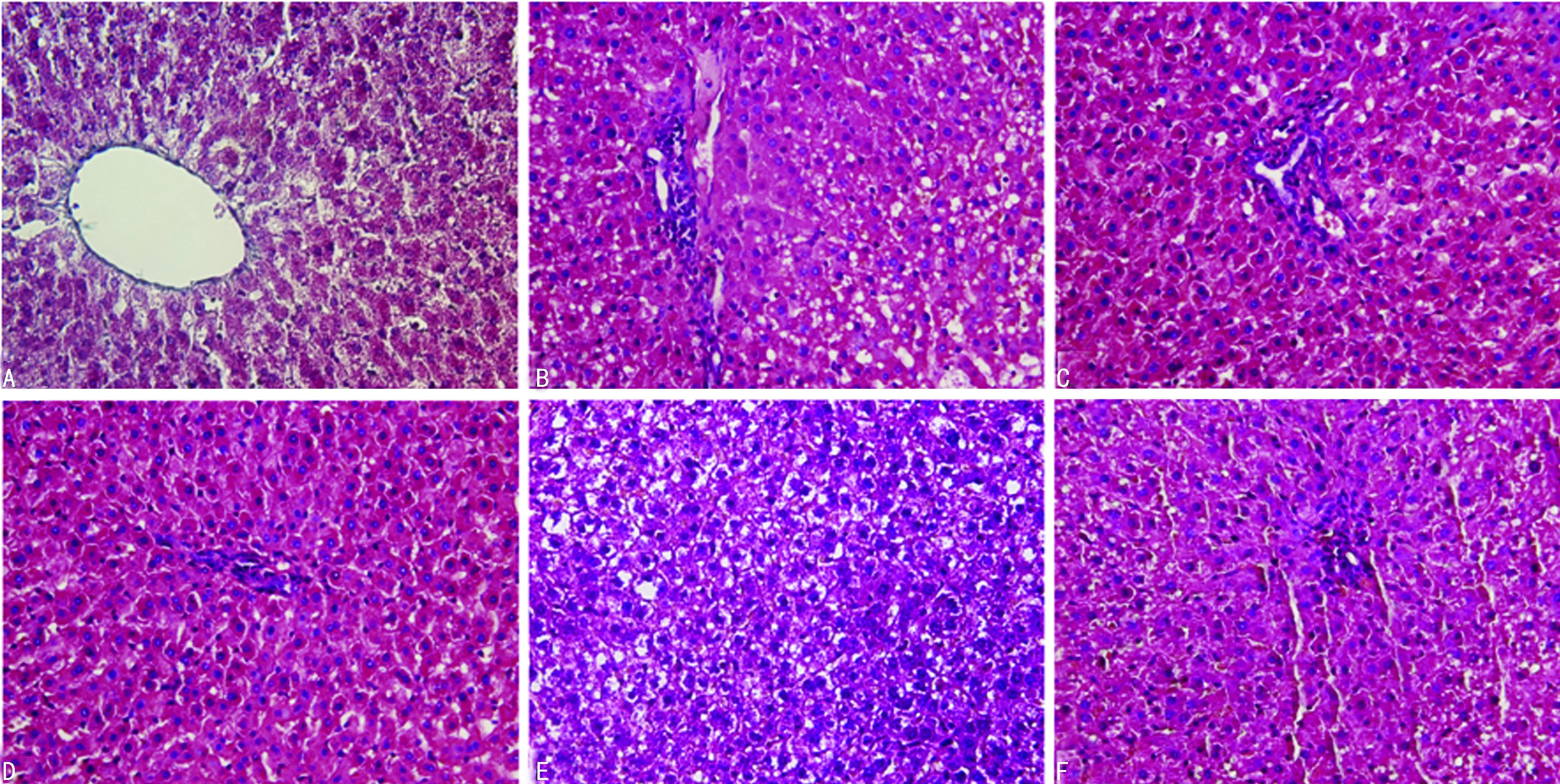
A:对照组;B:模型组;C:Rh1组;D:CK组;E:Rh1-CK组;F:PNS组
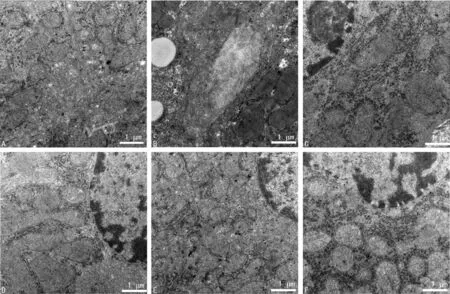
A:对照组;B:模型组;C:Rh1组;D:CK组;E:Rh1-CK组;F:PNS组
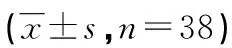
表2 细胞线粒体体视学计量结果
a:P<0.05;b:P<0.01,与对照组比较;c:P<0.05;d:P<0.01,与模型组比较
3 讨 论
ALD是我国最主要的慢性肝病之一,其主要由于长期大量饮酒所致。初期表现为脂肪肝,进而可发展为酒精性肝炎、肝纤维化和肝硬化[5]。来自世界卫生组织(WHO)的报道称,全球范围内约330万的死亡由乙醇引起[6]。肝脏为乙醇代谢的主要场所,90%的乙醇在肝内代谢,通过乙醇脱氢酶、微粒体氧化系统和过氧化氢酶等不同途径而氧化为乙醛,乙醛又经乙醛脱氢酶作用氧化成为毒性较低的乙酸盐[7],最终生成二氧化碳和水。乙醇及乙醛对肝细胞存在直接毒性作用,亦可诱导肝内其他细胞、炎症介质等参与疾病的发生、发展过程,乙醛也被视为导致ALD进展的直接毒物中的关键组分[8]。在肝细胞受到内外因素干扰时,线粒体反应最早、变化最敏感、也最明显,是决定细胞由可逆到不可逆改变的关键细胞器;多个研究表明,乙醇及其代谢产物对肝脏线粒体结构、线粒体DNA的破坏及对其功能的影响,在脂肪肝发生机制中起到重要作用[9-10]。人参皂苷Rh1为人参皂苷Rg1、Re经肠内菌群代谢后产生的代谢产物[11],经研究证实,人参皂苷Rg1具有抗氧化和抗肝纤维化作用[12],可有效地降低异常升高的血清生化指标,减轻线粒体嵴断裂膜破坏,缓解肝脏损伤等病理改变[13]。人参皂苷CK为人参皂苷Rb1经肠道菌群转化作用的结果,其具有抗炎、抗肿瘤、抗衰老的作用。本研究采用线粒体作为观察指标,并猜测对线粒体结构与功能有作用的药物对ALD所致的肝损伤可能有改善作用。本研究通过建立一个与人类酒精性肝损伤发展病变过程相似的动物模型以探索人参皂苷单体成分对改善酒精性肝损伤的作用机制。
通过实验发现,人参皂苷Rh1、CK及Rh1∶CK混合物可降低ALD肝酶水平。ALT和AST是存在于肝细胞质内的可溶性酶,肝细胞损伤后,细胞膜的通透性增加,导致ALT、AST释放入血,故血清ALT、AST水平高低可以反映肝细胞的损伤程度[14-15]。研究提示人参皂苷可能通过下调肝酶水平从而改善ALD的肝损伤,延缓ALD的进展。人参皂苷Rh1∶CK还能降低大鼠ALP水平,但Rh1、CK对大鼠ALP无显着作用,因此,可推测人参皂苷Rh1∶CK混合物保肝作用较强。此外,本研究中观察到人参皂苷Rh1、CK及Rh1∶CK混合物明显改善ALD中肝脏组织的病理改变。本研究结果显示,经加药处理后肝脏中脂肪沉积及炎性反应较前缓解,以此延缓ALD进展。最后,人参皂苷Rh1、CK及Rh1∶CK混合物可改善受损线粒体形态及结构。在长期乙醇暴露过程中,肝细胞内多种细胞器活性均可受其影响,包括多重水平线粒体损伤、内质网应激产生、蛋白酶体活性减低、微管功能破坏等多个方面综合作用。这其中,线粒体被视为乙醇毒性作用的关键靶点之一[7]。线粒体受损后其病理表现多样,例如:细胞形态异常,水肿,嵴的数量减少、排列紊乱,以及晶体样杂质形成,内膜的破坏和溶解,脂滴在周边沉积等[16]。本实验中,模型组小鼠肝脏线粒体形态各异,肿胀明显,线粒体膜融合,基质电子密度下降,嵴断裂或消失,与上述报道相符。模型组Vvm、Svm、Nam均较对照组增高,提示线粒体结构变化以肿胀或增生为主,此与电镜下观察结果一致。而加药处理后各组中上述指标较模型组降低,且数值介于模型组和对照组之间。由此证实,当发生ALD时,肝细胞线粒体形态及结构发生改变、功能受损,而人参皂苷相关成分可改善上述变化,恢复线粒体功能,从而起到减轻酒精性肝损伤的作用。
因以上两种人参皂苷成分在天然人参中含量极少甚至不存在,批量制备成本较高,且工程化生产工艺不成熟,导致其在临床应用方面受到限制,对其药理、毒副作用方面的研究尚欠缺。由对人参皂苷其他单体成分的研究可知,其对神经系统、内分泌系统、消化系统、肿瘤等各方面均有影响[17],在改善肝细胞损伤、抗肝纤维化方面亦有特殊作用。考虑其可能的作用机制:(1)减少机体脂肪酸合成,抑制肿瘤坏死因子-α(TNF-α)、IL-6等的产生;(2)抑制过氧化物酶体增殖物激活受体γ(PPARγ)的表达,从而减轻肝脏炎症反应;(3)通过下调血小板衍生生长因子(PDGF)及转化生长因子-β1(TGF-β1)的表达抑制肝星状细胞的活化与增殖延缓肝纤维化的发展等[18-19]。通过本研究进一步证实人参皂苷Rh1及CK可降低肝酶水平、延缓肝细胞病理改变、减轻肝细胞脂肪变性程度及改善线粒体结构与功能 ,其中又以人参皂苷CK作用最为明显,其次为Rh1-CK,再次为人参皂苷Rh1。此结果可能为今后提取人参皂苷单体成分改善ALD患者酒精性肝损伤及临床药物研发提供理论依据。



