酉鹏华,王军伟,何晓敏
(1.陕西省人民医院心血管内科,西安 710068;2.西安理工大学医院,西安 710068)
随着年龄的增加,心房颤动发病率明显增加[1-2]。年龄是心房颤动发生、发展的独立危险因素。心房肌电生理异常是心房颤动的发病及维持机制,其中电重构起着极其非常重要的作用。心房颤动电重构是指快速不规则的心房激动造成的心房肌电生理特性改变,表现为心房有效不应期及动作电位时程的缩短,心房内传导速度减慢等[3]。大量的证据显示电重构对维持心房颤动起着非常重要的作用,心房电重构主要表现和机制是离子通道重构,离子通道相应基因的改变及电流密度的改变与心房颤动发生相关。瞬时外向钾电流(Ito)属于钙依赖性的外向钾电流,心房肌复极1期主要是瞬时外向钾电流内流的结果。Kv1.4钾通道和Kv4钾通道(包括Kv4.2钾通道和Kv4.3钾通道)构成Ito的α亚基,Kv4.3钾通道在心房比较丰富,Kv4.2钾通道在心室比较丰富,一般多将Kv4.3钾通道作为Ito的编码基因。Ito是心房肌细胞复极的主要电流,参与动作电位1期的复极,与0期去极化电流共同形成动作电位的峰电位,决定动作电位平台期起始的高度。老年人心房颤动高发病率是否与钾通道增龄性改变有关尚不明确。本研究就增龄对家兔心房组织Kv4.3钾通道基因表达的变化进行研究,为增龄是心房颤动发生的危险因素提供实验依据,现报道如下。
1 材料与方法
1.1实验动物 健康实验家兔24只,雌雄不限,按月龄分为3组:幼年组8只,日龄14~21 d,平均(18.6±2.1)d,平均体质量(240.0±30.0)g;成年组8只,月龄8~10个月,平均(9.0±0.9)个月,平均体质量(2.0±0.3)kg;老年组8只,月龄30~35个月,平均(32.8±1.8)个月,平均体质量(4.0±0.5)kg。幼年组和成年组购于西安交通大学动物实验中心,老年组购于四川省医学科学院动物实验中心。
1.2方法
1.2.1标本获取 取出家兔,称体质量,成年组、老年组使用20%乌拉坦以6 mL/kg的剂量经耳缘静脉注射麻醉,幼年组以3%戊巴比妥30 mg/kg剂量腹腔内注射麻醉。将家兔仰卧位于实验手术台上,开胸将心脏暴露,取下心脏,分离心脏纤维膜及结缔组织,使用磷酸盐缓冲液(PBS)反复冲洗血迹,沿冠状沟分离心房和心室,并分离左右心房,分别保存于冻存管中,置于液氮中急冷,存于-80 ℃冰箱中保存以备用。
1.2.2心房组织Kv4.3钾通道实时荧光定量PCR测定基因表达的变化 兔心房组织总RNA提取采用Trizol RNA提取方法。检测RNA浓度及纯度:NanoDropDN-100全波长紫外分光度计测定方法测定总RNA浓度和OD260/OD280比值,OD值在1.8~2.0为纯度较高,可以进行下一步反转录操作。使用TaKaRa公司反转录试剂盒进行反转录。具体条件:37 ℃ 15 min(反转录反应),85 ℃ 5 s(反转录酶失活反应),合成cDNA。以NCBI GenBank提供的甘油醛-3-磷酸脱氢酶(GAPDH)及KCND3引物序列,由北京奥科鼎盛生物科技有限公司合成,引物序列如下,GAPDH:上游-3′-GCT TTT AAC TCT GGC AAA GTG-5′,下游-3′-GAT GAT GAC CCT TTT GGC TC-5′;KCND3:上游-3′-GCC GCA GTA AGA AGA CCA CAC-5′,下游-3′-TTG GTC TCA GTC CGT CGT CTG-5′;按照TaKaRa实时荧光定量PCR试剂盒操作说明书进行反应,采用3步法PCR扩增程序:第1步95 ℃ 30 s;第2步95 ℃ 30 s,62 ℃(GAPDH、KCND3)、62.5 ℃(KCND3)30 s 72 ℃ 30 s,40个循环;第3步59.5 ℃变性1 min,然后冷却至55 ℃。从55 ℃开始每一步增加0.5 ℃,持续30 s,直至95 ℃,总共81步,读取吸光值,进行溶解曲线分析,记录CT值。以溶解曲线为单峰示引物特异性较强,反应特异性较高。使用20 g/L的琼脂糖凝胶电泳检验PCR产物是否特异,见单一的扩增条带,无引物二聚体等其他非特异性条带,表明扩增反应特异。
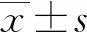
2 结 果
2.1不同年龄组Kv4.3钾通道KCND3相对表达水平比较 幼年组KCND3基因相对表达水平为6.14,成年组为12.29,老年组为14.57,3组比较差异有统计学意义(P<0.05)。
2.2不同年龄组间Kv4.3钾通道KCND3表达水平多重比较 幼年组KCND3基因表达水平为(1.23±0.64),成年组为(3.12±1.80),老年组为(4.78±2.67)。与幼年组比较,成年组及老年组表达差异有统计学意义(P<0.05),而成年组与老年组之间比较,差异无统计学意义(P>0.05),见图1。
a:P<0.05,与幼年组比较
图1不同年龄组家兔心房组织Kv4.3钾通道(KCND3)多重表达水平比较
2.3Kv4.3钾通道KCND3及GAPDH mRNA的转录 Kv4.3钾通道KCND3 mRNA转录图见图2,Kv4.3钾通道基因及GAPDH的PCR产物电泳带位置与理论值相符。
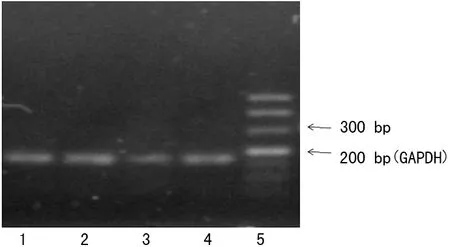
1~4:KCND3;5:Marker;KCND3:165 bp
图2Kv4.3钾通道KCND3mRNA转录图
3 讨 论
国内外众多流行病学研究均显示年龄与心房颤动发生密切相关[4]。美国弗莱明翰心脏中心关于心房颤动的回顾性调查显示:众多危险因素中老龄居首位,是心房颤动发病的独立危险因素[5]。促使心房颤动发生和维持的重要因素是心房结构重构和电重构,而结构重构与电重构相互影响并相互作用,结构重构可促发电重构,使老龄患者心房颤动发病率增加[6-7];心房电重构的电生理机制是离子通道重构,目前大量研究均证实离子通道重构是发生心房颤动发病因素之一[8-10],增龄可使心房离子通道基因、蛋白及电流水平均发生变化,是引起老龄心房电重构的电生理基础。心房肌Kv4.3钾通道(Ito电流)参与心房复极1期及0期去极化过程,二者共同形成动作电位峰电位,影响动作电位形状、时程及有效不应期变化。老年人心房颤动高发病率是否与钾通道增龄性改变相关目前研究尚不明确。
产生Ito电流的Kv钾通道主要有Kv4.2钾通道和Kv4.3钾通道,Kv4.3钾通道在心房分布较丰富,Kv4.3钾通道主要产生Ito电流[11]。编码Kv4.3钾通道的基因是KCND3,Ito电流是动作电位早期复极1期的主要离子流,与0期去极化共同形成动作电位峰电位,其大小对动作电位形态和时程有较大的影响。Ito电流的升高,将会加快1期复极,缩短动作电位时程和有效不应期,参与心房颤动电重构。目前的研究中,大部分发现心房颤动时Ito电流改变,而且Kv4.3钾通道基因和蛋白水平均同步改变,与Ito电流密度改变一致,并认为Kv4.3钾通道mRNA改变是Ito电流改变的分子机制。而YUE等[12-13]在心房颤动犬模型中发现电流密度及其主要编码基因Kv4.3钾通道mRNA表达水平改变,并与心房电重构有关。
随着年龄的增加,心脏在解剖结构和电生理功能等方面也将发生变化,这些改变将参与心房颤动发生和发展。LIU等[14]研究提示Ito电流密度随年龄增长增高。DUN等[15]研究了心房组织Ca2+通道及Ito、Isus电流的增龄性变化,也发现Ito电流随年龄增长而增高。本研究选择了编码Kv4.3钾通道的基因KCND3作为目的基因,结果显示KCND3表达存在增龄性上调,与DUN等[15]细胞电生理Ito研究结论相一致;其中,幼年组与中年组和老年组分别比较,差异均有统计学意义(P<0.05)。通道基因表达是通道电流的改变的分子机制,电流水平与基因水平一致。因此笔者推测Kv4.3基因表达的升高,可能将促使Ito电流升高,使复极1、2期加速,从而缩短动作电位时程和有效不应期及降低2期平台期高度,可能是心房颤动电重构的一个环节。
本研究显示成年组与老年组KCND3基因表达比较,差异无统计学意义(P<0.05),但老年组有不断上升的趋势,分析原因如下:心房颤动发病率随年龄增加而增加,60岁发病率开始增高,>80岁发病率为10%,老年组发病率更高,本实验老年组家兔为30~35个月龄,而家兔正常生命周期为6~8年,从家兔的生理年龄来看,30~35个月龄家兔属于老龄下限,因受实验动物饲养时间的限制,目前国内外关于老龄家兔研究中,把大于30月龄的家兔定为老龄,若研究对象的年龄进一步增大,可能会出现不同的结果。



