杜 菲,杨玉香,强 丽,孙长峰,吴 刚,3△
(西南医科大学附属医院:1.感染科;2.结核科;3.感染与免疫实验室,四川泸州 646000)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是指在慢性肝病基础上发生的短期内出现急性肝功能失代偿的一种综合征。ACLF患者的短期病死率高,30%~70%的患者在接受肝移植之前死亡[1]。乙型肝炎病毒(hepatitis B Virus,HBV)感染是我国ACLF最主要的病因[2],鉴于乙型肝炎相关慢加急性肝衰竭(hepatitis B virus-related acute-on-chronic liver failure,HBV-ACLF)患者生存率极低(早期病死率为30%~70%)[3],早期诊断、采取合理的治疗方法(人工肝、肝移植等)、早期准确预测HBV-ACLF患者预后,对于降低HBV-ACLF病死率尤为重要。终末期肝病模型(model for end-stage liver disease,MELD)、肝功能Child-Turotte-Pugh(CTP)评分是国内外判断患者预后较为常用的方法[4-5],但以上评分系统均存在不足,如未将全身炎症反应考虑在内。而近年来研究发现,过度的全身炎症反应与ACLF疾病进展和临床预后密切相关[6-7]。因此,本研究拟在MELD及CTP评分基础上增加单核/淋巴细胞比值(monocyte-lymphocyte ratio,MLR),联合3种指标共同评价影响HBV-ACLF患者短期预后的危险因素,寻找可靠的炎症标记物,建立新的预测短期预后的评分模型。
1 资料与方法
1.1 一般资料
收集本院感染科2019年5月至2020年12月住院并行人工肝治疗的HBV-ACLF患者一般资料及相关实验室指标检测结果。所有患者纳入标准均参照《肝衰竭诊治指南》(2018年版)[8]。排除标准:(1)合并其他肝炎病毒重叠感染及自身免疫性肝病、酒精性肝病患者;(2)合并严重心、脑、肺、消化道疾病患者;(3)随访资料不全的患者。最终纳入101例患者,男86例,女15例,平均年龄(49.66±1.11)岁;共行人工肝治疗281次,最少1次,最多6次,平均(2.78±1.09)次。以入院当天为起点,根据电话随访患者90 d内的预后情况分为存活组和死亡组。本研究经本院伦理委员会审核且获得批准。
1.2 方法
1.2.1治疗方法
所有患者均给予保肝、对症支持、防治并发症及抗乙型肝炎病毒等常规治疗。所有患者在内科常规治疗基础上进行人工肝支持治疗:以颈内静脉或股静脉穿刺置管,建立体外循环通路,每次治疗血浆置换1 400 mL,血浆灌流2~3 h,总灌流量约4 000 mL,每次人工肝治疗间隔1~3 d。
1.2.2观察指标
采集患者的一般信息和主要临床特征,收集患者入院时相关血常规、生化、凝血、电解质等指标。计算入院时基线MELD、CTP评分、MLR。MELD分值[9]=9.6×In(Crea mg/dL)+3.8×ln(TBil mg/dL)+11.2×In(INR)+6.4,Crea为肌酐,TBil为总胆红素,INR为国际标准化比值;CTP评分系统包括肝性脑病、腹水、清蛋白、TBil及凝血酶原时间(prothrombin time,PT)5个指标[10];MLR=单核细胞数/淋巴细胞数。
1.3 统计学处理
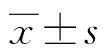
2 结 果
2.1 生存组与死亡组间一般资料比较
101例患者入院之日起至随访的90 d,共死亡34例,存活67例,死亡率为33.7%。生存组年龄、感染率、MLR、PT、INR、血清Crea水平、MELD评分、CTP评分及年龄-TBil-INR-Crea评分均明显低于死亡组(P<0.05),两组其余指标无明显差异(P>0.05),见表1。
2.2 影响经人工肝治疗HBV-ACLF患者90 d预后的单因素和多因素分析
首先对可能影响经人工肝治疗HBV-ACLF患者90 d预后的各因素进行单因素logistic分析,结果显示:感染、MLR、PT、INR、年龄-TBil-INR-Crea评分、MELD评分、CTP评分是经人工肝治疗HBV-ACLF患者90 d死亡的独立影响因素。进一步对单因素分析有统计学意义的因素进行二元logistic回归分析,结果显示:高MELD、CTP评分和MLR是影响经人工肝治疗HBV-ACLF患者90 d死亡的独立危险因素(P<0.05),见表2。
2.3 建立模型评估患者预后价值
结合MLR、MELD及CTP指标建立预后预测模型并绘制ROC曲线,利用Medcalc比较MELD评分、CTP评分、MELD-CTP-MLR 3个模型的AUC、灵敏度及特异度,结果显示3个模型AUC分别为0.820、0.821和0.896,见表3。MELD-CTP-MLR模型AUC大于MELD评分(Z=2.129 0,P=0.033 3)和CTP评分(Z=2.601 0,P=0.009 3),见表4、图1。
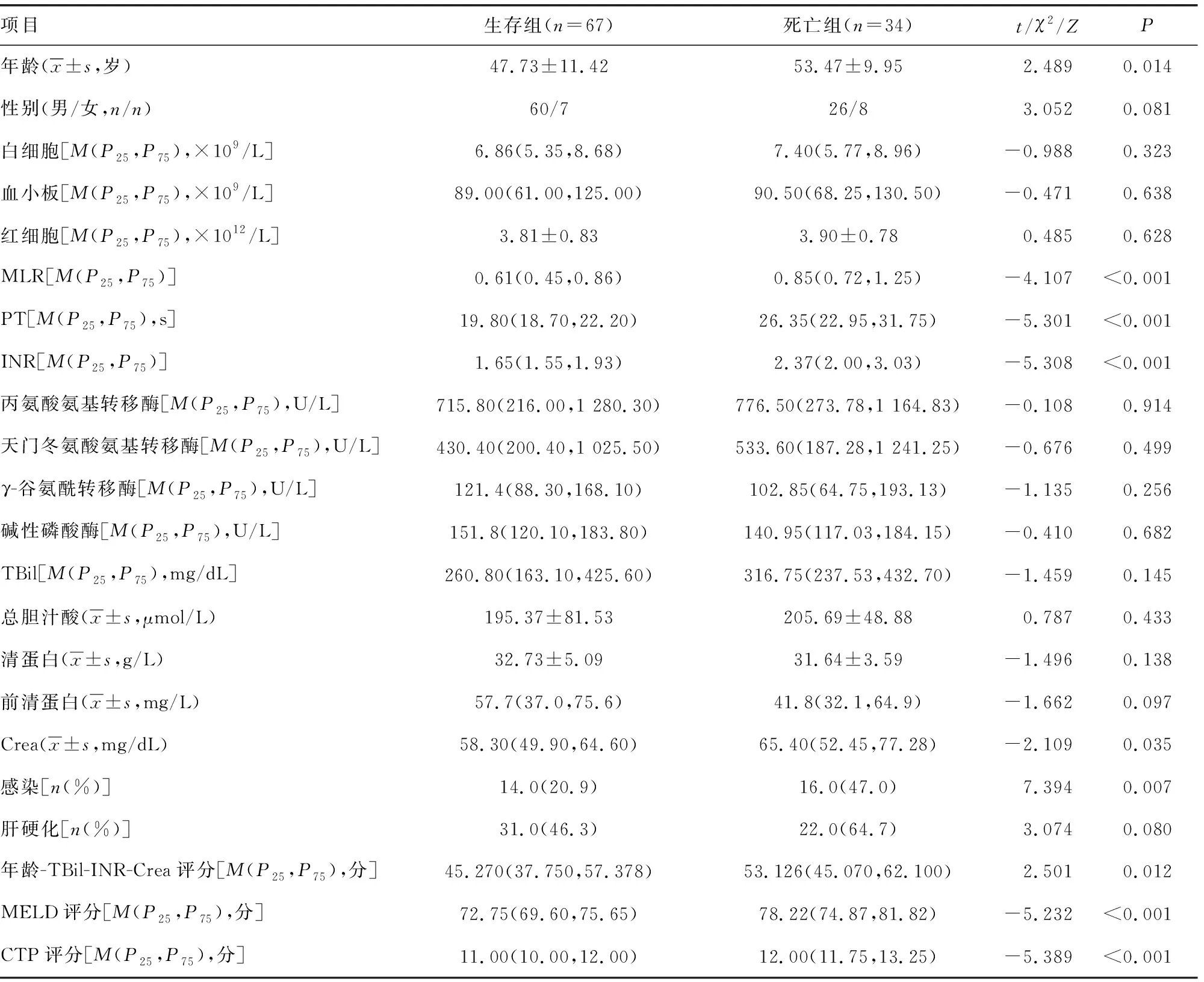
表1 死亡组和生存组组间一般资料比较
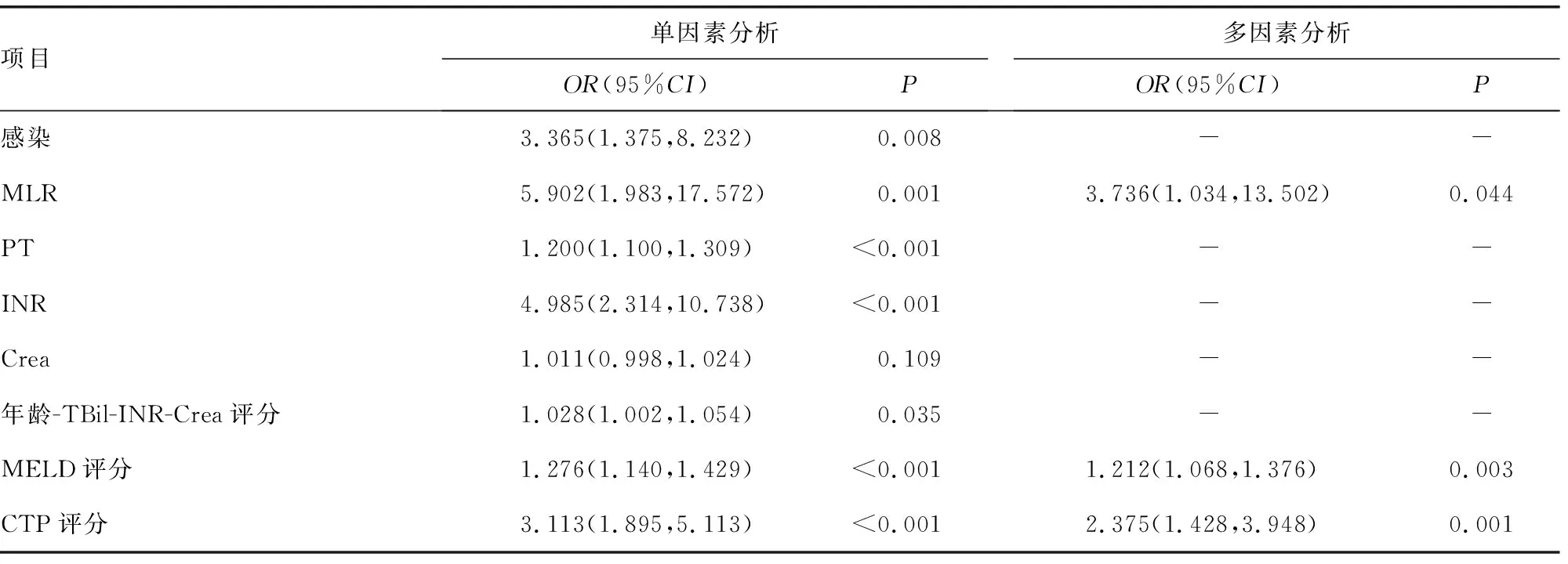
表2 影响经人工肝治疗HBV-ACLF患者90 d预后的单因素和多因素分析
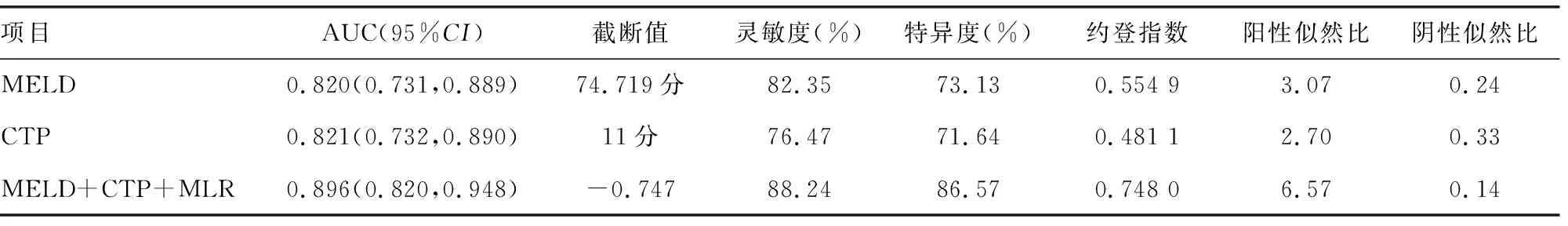
表3 3种模型评估人工肝治疗HBV-ACLF患者的预后的效能
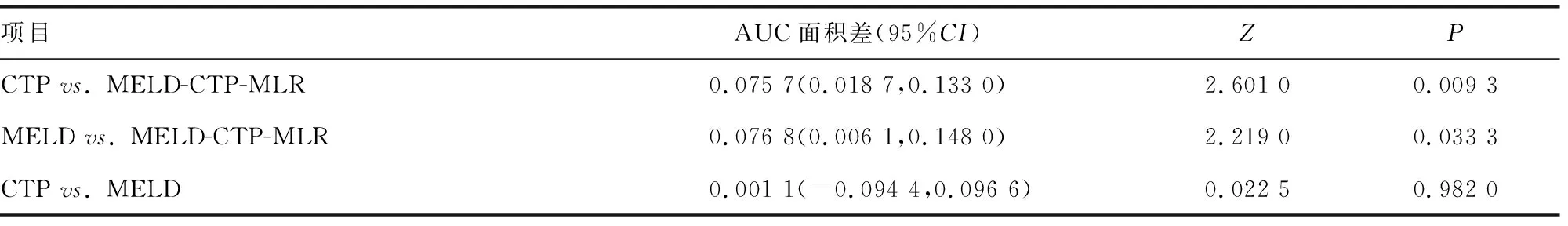
表4 3种模型AUC比较
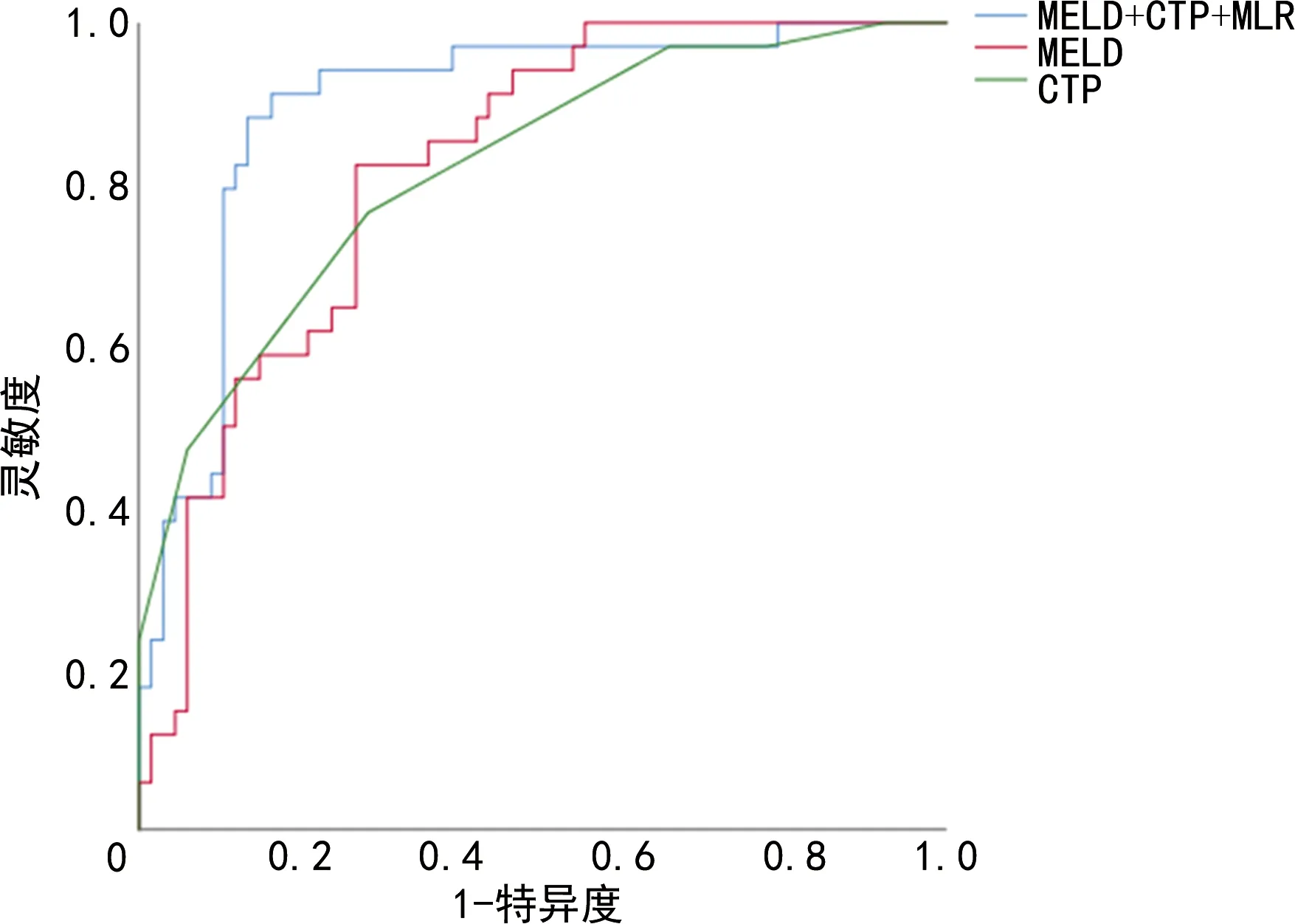
图1 3种评分模型对HBV-ACLF患者90 d预后诊断价值的ROC曲线
3 讨 论
如果不能早期及时诊断和治疗ACLF,肝移植成为后期各种并发症和器官衰竭的唯一有效治疗方案。然而,由于肝脏资源有限且价格高昂,大多数ACLF患者仍依赖内科和人工肝治疗。人工肝治疗可以暂时替代部分肝功能,通过清除血清中的有毒物质和代谢物,改善肝细胞再生和肝功能修复的微环境,防止肝衰竭进一步恶化。近年来,随着人工肝治疗技术的不断发展,肝衰竭的救治成功率明显提升。本研究通过联合MELD、CTP评分系统及MLR建立经人工肝治疗HBV-ACLF患者的预后评估模型,结果发现高MELD、CTP评分及MLR是经人工肝治疗90 d后HBV-ACLF患者死亡的独立危险因素,且MELD、CTP评分联合MLR对HBV-ACLF患者经人工肝治疗90 d后的预后有较好的预测价值。
人工肝又称为人工肝支持系统,是指借助体外机械、化学或生物性装置,暂时部分替代肝脏功能,从而协助治疗肝功能不全、肝衰竭或相关疾病的方法。人工肝能清除过量的有毒物质,纠正严重的凝血功能障碍,提供适合肝细胞恢复肝功能的内部环境,其确切疗效已经被临床认可[11]。目前评价人工肝治疗效果多依赖检测患者生化及凝血指标,主要由反映肝功能的各项实验室指标组成的预后评分系统来判断。本研究发现,高MELD和CTP评分是经人工肝治疗HBV-ACLF患者90 d死亡的独立影响因素。但这两种评分模型均是以西方人群为基础建立的,而西方人群患ACLF的主要病因为酒精性肝病,与我国以乙型肝炎病毒感染为主的病因不同。因此,有必要寻找新的、简单高效的预测方法,用于临床评估经人工肝治疗HBV-ACLF患者预后。
在本研究中,单因素和二元logistic回归分析结果发现,高MLR是经人工肝治疗HBV-ACLF患者90 d死亡的独立危险因素,MLR越高患者死亡风险越高,与既往研究结果一致[12]。本研究中经人工肝治疗后存活组MLR明显低于死亡组,考虑与死亡组患者外周血中单核细胞数量增加和淋巴数量减少有关。外周血单核细胞作为浸润免疫细胞在肝脏免疫功能障碍中发挥重要作用。淋巴细胞是适应性免疫系统的主要元素,伴随着疾病的不断发展,它在调节随后的系统性炎症中起到了重要作用。已有研究报道,肝细胞坏死会引起大量炎症因子释放,激活体内的免疫炎症反应,诱导大量粒细胞从骨髓迁移至外周血中,外周淋巴细胞数量明显下降[13-14]。同时,当肝脏处于病理环境下,Kupffer细胞可以通过释放促炎细胞因子,包括白细胞介素(IL)-1、IL-6、IL-8、肿瘤坏死因子-α等,使体内炎症反应持续存在[15]。过度的炎症细胞因子会触发骨髓中单核细胞的释放,单核细胞向炎症肝脏迁移。单核细胞浸润的早期阶段可能导致增殖阶段的组织局部损伤,促进促炎细胞因子的分泌,从而形成恶性循环[16-17]。因此,MLR是反映可能导致死亡的持续炎症的可靠指标。本研究纳入并证实MLR为预测经人工肝治疗HBV-ACLF患者短期预后的危险因素。
本项研究在分析MELD、CTP评分基础上,建立了MELD-CTP-MLR预测模型。MELD、CTP及MELD-CTP-MLR 3个模型的AUC均大于0.7,预测性能较好,且MELD-CTP-MLR模型的AUC最高(0.896),预测性能最好。另外,MELD-CTP-MLR模型预测HBV-ACLF患者人工治疗90 d预后的灵敏度和特异度分别为88.24%和86.57%,均大于70%,且高于MELD评分、CTP评分的灵敏度和特异度,提示MELD-CTP-MLR模型提升了HBV-ACLF患者人工肝治疗90 d预后的预测价值。
综上所述,本研究证实了高MLR、MELD及CTP评分是经人工肝治疗HBV-ACLF患者90 d死亡的独立危险因素,新纳入的评价指标MLR通过血常规结果计算即可得到,在临床工作中简单易行。另外,MELD-CTP-MLR模型对经人工肝治疗HBV-ACLF患者90 d预后具有良好的预测价值。但本研究也存在一定局限性:(1)该研究为单中心回顾性研究;(2)虽然MLR是预测经人工肝治疗HBV-ACLF患者90 d预后的一个潜在指标,但由于纳入的患者数量有限,可能存在偏倚,后续研究会纳入更大的样本量进一步论证。



