黄凯凯,童 勇,包世杰,陈雪茹,孙志强
(南方医科大学深圳医院血液科,广东深圳 518133)
急性髓系白血病(acute myeloid leukemia,AML)是起源于骨髓的髓系原始细胞恶性克隆性疾病,临床主要表现为贫血、出血、感染及浸润,其发病率占所有类型白血病的60%~70%,目前仅异基因造血干细胞移植(allo-HSCT)可能将其彻底治愈,但临床上大部分患者由于无合适的供者、移植后再次出现复发、经济原因等无法行allo-HSCT,只能使用新的治疗方案如靶向治疗联合化疗或去甲基化治疗等。本研究尝试使用阿扎胞苷联合新型靶向药物Bcl-2抑制剂Venetoclax治疗5例难治复发AML患者,取得初步疗效,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年10月至2020年3月本院收治的5例接受阿扎胞苷联合分子靶向药物Bcl-2抑制剂维奈克拉(Venetoclax)治疗的难治复发AML患者纳入本研究,男2例,女3例,中位年龄53(28~71)岁。纳入标准:(1)诊断标准和分型均依据《血液病诊断及疗效标准》[1]和WHO 2008年版血液肿瘤诊断标准[2],所有患者均经包括骨髓形态学、免疫分型、细胞遗传学和分子生物学(MICM分型)在内的系统的检查确诊;(2)体能状态符合美国东部肿瘤协作组(ECOG)分级标准中的0~3级;(3)由于各种原因无法行allo-HSCT。5例患者中,包括AML(中危组、复发)、AML(高危组、难治复发)、AML(高危组、难治、IDH2、DNMT3A突变)、AML-M5(高危组、高白细胞性、FLT3-ITD、AF3B1 突变)、AML(复杂核型、TET2及ETV6基因突变、RUNX1-RUNX1T1及RUNX1T1-RUNX1融合基因阳性)。
1.2 方法
1.2.1治疗方案
本研究通过本院伦理委员会审核批准,所有受试者均知情并签署化疗同意书。治疗方案:阿扎胞苷 75 mg·m-2·d-1,联用7 d;Bcl-2抑制剂Venetoclax第1天100 mg,第2天200 mg,第3~14天或第3~21天400 mg,28 d为1个周期。纳入的患者至少治疗4个周期,若患者疗效评价为疾病缓解、持续获益或稳定,后续无法行移植且无严重并发症者,可继续给予同样的方案治疗;若患者有合适的移植供者或强烈要求行allo-HSCT,可随时进入移植程序;若患者发生疾病进展,认定为无效。
1.2.2治疗期间不良事件的发生及处理原则
按照WHO急性和亚急性药物不良反应标准评定不良反应。治疗期间定期监测血常规、肝肾功能、感染指标(超敏C反应蛋白、降钙素原、血清淀粉样蛋白)等,并行(1,3)-β-D-葡聚糖试验(G试验)、半乳甘露聚糖试验(GM试验)了解是否合并真菌感染。针对化疗过程中出现的骨髓抑制,采取输注成分血、使用粒细胞集落刺激因子(G-CSF)和(或)血小板生成素(r-TPO)等对症支持治疗;同时,常规应用左氧氟沙星或莫西沙星、复方磺胺甲恶唑片(SMZ)、泊沙康唑混悬液预防性抗细菌及真菌感染治疗,予复方氯己定常规含漱。当患者体温大于或等于38 ℃或出现畏寒、寒战时,行一般细菌、真菌血培养及药敏检测,并行胸部CT检查,依据《中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南》(2020年版)经验性给予广谱抗菌药物治疗。常规抗菌药物治疗5~7 d无效后或胸部CT提示真菌感染或G试验、GM试验阳性者,根据《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则》(第6次修订版),给予合适的静脉抗真菌治疗。如血培养阳性,根据血培养结果调整抗感染药物的应用。
1.2.3疗效评价标准
所有患者治疗前完成下列检测:血常规及外周血细胞形态、生化、凝血功能、感染相关指标及骨髓MICM检测。疗效判定依据2003年AML国际工作组(IWG)疗效修订标准[3]:分为完全缓解(CR)、骨髓缓解伴血象不完全恢复(CRi)、血液学进步(HI)、疾病稳定(SD)、疾病进展(PD),其中达到CR、HI、CRi者视为治疗有效。随访时间及生存时间均从起病起至随访终点时间(2020年3月30日)结束,患者总生存时间558(234~1 430)d。
2 结 果
2.1 一般资料
5例患者一般临床资料,见表1。
2.2 治疗效果
所有患者均顺利完成治疗,分别完成4、5、5、5、6个疗程,无治疗相关死亡病例。5例难治复发AML中,CR 2例,继续给予阿扎胞苷联合Bcl-2抑制剂Venetoclax治疗;CRi 1例,仍需间断输注血制品,但较用药前输注频率明显减少;SD 2例,目前继续给予相同方案治疗过程中,需要间断输注血制品,见表1。
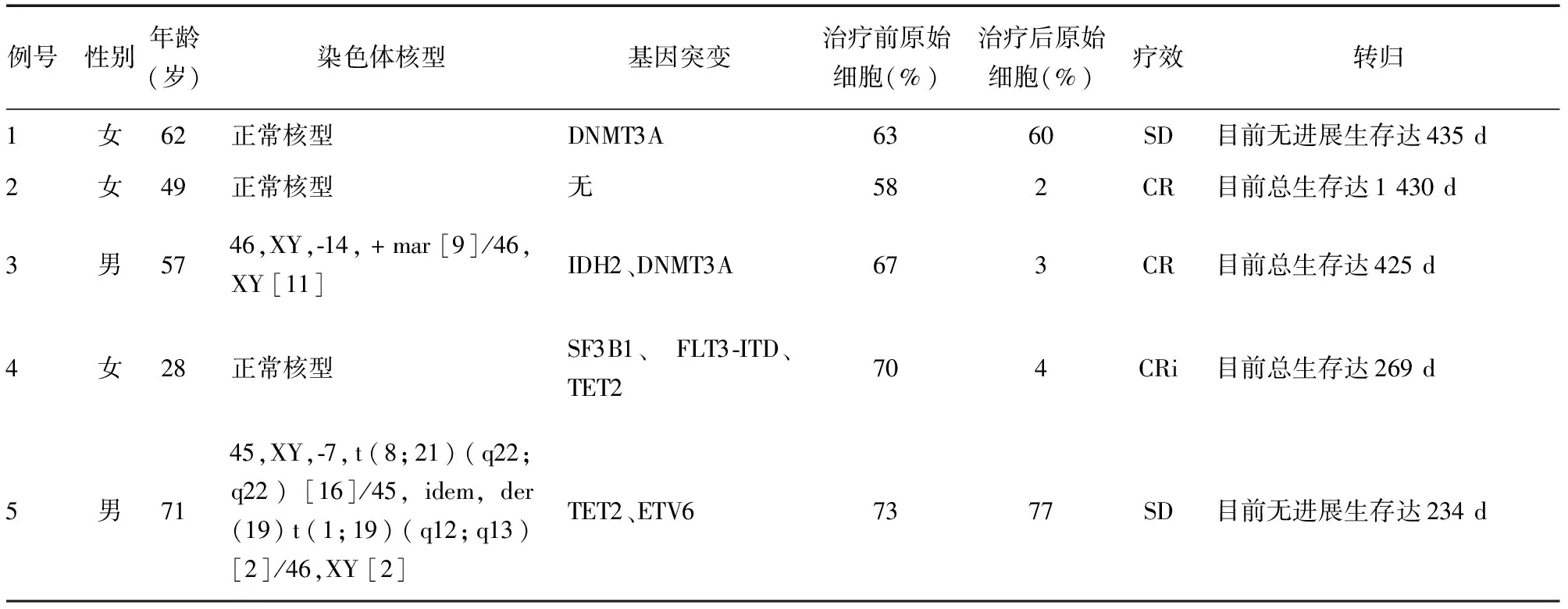
表1 Azacitidine联合Bcl-2抑制剂Venetoclax治疗难治复发AML患者的临床特征
2.3 不良反应
治疗过程中5例患者均出现Ⅳ°骨髓抑制,发生在用药后1~2周。5例患者在化疗后骨髓抑制期均合并不同程度的肺部感染,抗感染治疗后均明显好转,其中1例患者出现感染性休克,抗感染治疗后均明显好转。1例患者出现轻微的肝功能异常,1例患者出现轻微恶心、呕吐,2例患者阿扎胞苷皮下注射部位出现不同程度的红肿、硬结,经积极对症处理后均好转。
3 讨 论
AML是以造血干细胞克隆性增生和髓系分化障碍为特征的一类高度异质性血液系统恶性肿瘤[4],其治疗方法主要是联合化疗,但由于其靶向性低、不良反应多,尽管60%~80%患者可获得CR并延长生存期,但仍有40%~60%患者复发或最终发展成难治性白血病,成为临床面对的棘手问题。因此,AML的复发是影响患者疗效及长期生存的严峻问题。近年来,新的靶向药物(如FLT3/IDH2/Bcl-2抑制剂等)的应用在一定程度上改善了AML的疗效,延长了AML患者的总生存。
Bcl-2是从滤泡性B淋巴瘤中发现的一种癌基因。而Venetoclax是最早上市的Bcl-2抑制剂,已被WHO批准用于复发难治慢性淋巴细胞白血病(CLL)及非霍奇金淋巴瘤的治疗,其中在复发难治CLL的总反应率(ORR)为77%,CR率为23%[5-6]。治疗相关的副作用包括胃肠道反应、上呼吸道感染,偶有治疗相关的血象改变等。因临床疗效的卓越性,2016年美国食品药品监督管理局(FDA)加速批准Venetoclax联合去甲基化药物用于不适合标准化疗的老年AML患者。
Venetoclax联合低剂量阿糖胞苷和地西他滨/阿扎胞苷治疗老年AML患者的Ⅰ期临床试验初步结果显示,老年AML患者可获得与标准诱导疗法相当的总体反应率,不良反应可耐受[7]。美国一项多中心研究观察了145例新诊断的老年AML患者(中位年龄74岁)应用Venetoclax联合去甲基化药物(地西他滨或阿扎胞苷)治疗的有效性和安全性,结果显示有73%的CR率,中位生存时间为17.5个月,常见的3~4级不良反应有中性粒细胞减少性发热(43%)、白细胞计数下降(31%)、贫血(25%)。研究证实,Venetoclax联合去甲基化药物对一些临床预后相对差的患者,如年龄≥75岁、较差的细胞遗传学、继发性AML患者有良好的反应率和耐受性[8-9]。同样在未经治疗的老年AML患者中,Venetoclax联合地西他滨或阿扎胞苷有61%的总有效率,不良反应主要是骨髓抑制,无论联合地西他滨还是阿扎胞苷其安全性接近,但是Venetoclax的最佳治疗剂量仍需要大量的临床病例来探讨[10]。国际上相关的临床研究中Venetoclax的最大剂量高达1 200 mg,但由于与我国患者存在体质性差异,以及国内会常规使用泊沙康唑预防性抗真菌治疗,该药会使得Venetoclax的血药浓度不同程度的增加,相关临床研究建议二者联合使用时,Venetoclax的用量至少下降至75%[11]。因此,本组患者Venetoclax的临床剂量最高为400 mg/d。
在难治复发AML方面,多项临床研究证实了Venetoclax联合去甲基化药物(阿扎胞苷或地西他滨)的有效性及治疗相关的不良反应[12-15],相关研究结果显示,Venetoclax联合去甲基化药物治疗难治复发AML的ORR为21%~75%,患者的中位生存时间为3.0~16.6个月,72%的患者发生Ⅲ~Ⅳ级不良反应,大多数为感染性事件,且不良反应均可耐受[15-17],这也和本研究结果类似。本组5例患者ORR为60%,所有患者均发生肺部感染,但经过积极的抗感染治疗后均显着好转。
目前的基础研究结果显示,两种药物联合的作用机制并不完全明确。体外研究表明,Bcl-2抑制剂Venetoclax联合去甲基化药物可起到协同作用[16],可能的机制包括Venetoclax联合去甲基化药物可增加线粒体活性氧(ROS)诱导的凋亡[17]。由于Venetoclax联合阿扎胞苷的有效性及良好的耐受性,作者认为不久的将来,该方案可作为老年AML患者或难治复发AML患者的一线治疗方案。



