何卫东,杨柳清,林 姿,徐林诗,刘建帅
(1.福建中医药大学附属人民医院,福建 福州350004;2.福建中医药大学,福建 福州350122)
糖尿病及其并发症已成为严重危害人类健康的世界性公共卫生问题,其防治研究意义重大。氧化应激损伤是糖尿病血管并发症的重要发病机制,Kelch样环氧氯丙烷相关蛋白-1(kelch-like epichlorohydrin associated protein-1,Keap1)/核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)信号通路是调控糖尿病氧化应激损伤的重要信号通路。中医药治疗糖尿病及其血管病变有一定的优势,阴虚血瘀是消渴全病程的重要病机,地红方具有滋阴活血的功效,临床治疗糖尿病效果显着。因此,本课题通过体外细胞实验,围绕氧化应激Keap1/Nrf2信号通路研究地红方干预糖尿病血管内皮细胞损伤的机制,为滋阴活血法在糖尿病及其血管并发症的临床应用提供客观依据,并为同类研究提供借鉴。
1 实验材料
1.1 实验动物和细胞 SPF级雄性SD大鼠50只,7周龄,体质量(300±15)g,分笼饲养,自由摄水,温度(23±2)℃,湿度50%~70%,通风良好,12 h光照明暗交替。人脐静脉血管内皮细胞(HUVEC),于恒温37℃、5%CO2、95%湿度的无菌培养箱中培养。每1~2天更换MEM培养液1次;4~5 d细胞长满后传代,选择第三代细胞用于实验。
1.2 实验药物 地红方药物组成:熟地黄、山茱萸、山药、泽泻、茯苓、牡丹皮、葛根、天花粉、桃仁、红花、当归、白芍、川芎、丹参。药材均经专业人员鉴定,不含重金属。药材先用5倍量清洁自来水清洗2遍,再以10倍量的蒸馏水浸泡0.5 h,用700瓦的火力煎煮1 h,过滤药液;第2遍煎药时加6倍量清洁自来水,同等火力煎煮40 min,再次过滤。将2次滤液合并,再以700瓦火力煎煮浓缩至1 g/mL浓度药材的药液(即1∶1药液),无菌包装,实验备用。
1.3 实验试剂 Keap1抗体、GAPDH抗体、HRPconjugated Affinipure Goat Anti-Mouse IgG(H+L)(美国proteintech公司,批号:60027-1-Ig、60004-1-Ig、SA00001-1)。BCA蛋白定量试剂盒、SDS-PAGE蛋白上样缓冲液、SDS-PAGE凝胶制备试剂盒、Tris-Glycine-SDS电泳缓冲液、考马斯亮蓝染色液、考马斯亮蓝染色脱色液、Western专用一抗二抗稀释液、无蛋白快速封闭液、超敏ECL化学发光即用底物(武汉博士德生物工程有限公司,批号:AR0102、AR1178、AR0198、AR1112、AR0138、AR0139、AR0163-1、AR0163-2、AR1017、AR-0041、AR1111)。
1.4 实验仪器 BCD-196TCSJ低温冰箱(青岛海尔股份有限公司产品);DK-8D电热恒温水槽(上海一恒科技有限公司);BSA124S电子天平[赛多利斯科学(北京)有限公司];JXFSTPRP-48研磨机(上海净信实业发展有限公司);WP-UP-YJ-10实验室超纯水机(四川沃特尔水处理设备有限公司);NYC-60转移脱色摇床(泰州诺米医疗科技有限公司);电泳仪、凝胶玻璃板、固定夹、垂直电泳槽、转移槽(美国Bio-Rad公司);Tanon-5200超高灵敏化学发光成像系统(上海天能科技有限公司);7500荧光定量PCR仪(美国ABI公司)。
2 实验方法
2.1 实验分组 传代后的HUVEC以标准培养液培养24 h,更换培养液并随机分为5个组,每组10个样本。①正常组:葡萄糖浓度为5.6 mmol/L的MEM培养液加10%的无药血清培养。②模型组:葡萄糖浓度为22.2 mmol/L的MEM培养液加10%的无药血清培养。③低剂量含药血清组(简称低剂量组):在模型组基础上培养6 h后,葡萄糖浓度为22.2 mmol/L的MEM培养液加5%含药血清及5%无药血清继续培养。④中剂量含药血清组(简称中剂量组):在模型组基础上培养6 h后,葡萄糖浓度为22.2 mmol/L的MEM培养液加7.5%含药血清及2.5%无药血清继续培养。⑤高剂量含药血清组(简称高剂量组):在模型组基础上培养6 h后,葡萄糖浓度为22.2 mmol/L的MEM培养液加10%含药血清继续培养。以上各组分组培养72 h后,分别收集细胞进行相关指标检测。
2.2 Western blot检测血管内皮细胞质内Keap1蛋白表达 收集各组HUVEC细胞,BCA法测定蛋白浓度;经电泳、转膜后将载有蛋白的PVDF膜置于TBST溶液漂洗3次,5 min/次。漂洗后用封闭液室温摇床孵育30 min,将膜置于一抗溶液中,置摇床室温孵育2 h。使用TBST洗膜3次,10 min/次,将膜置于二抗中,37℃摇床孵育2 h,用TBST洗膜3次,10 min/次。用ECL化学发光显色液,显影读片。
2.3 实时荧光定量PCR(qPCR)法检测血管内皮细胞相关因子mRNA表达 采用qPCR法检测血管内皮细胞中Nrf2、谷胱甘肽S-转移酶(GST)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷氨酰半胱氨酸连接酶(GCL)、NAD(P)H:醌氧化还原酶-1(NQO1)和血红素加氧酶-1(HO-1)的mRNA表达。收集各组HUVEC细胞,采用Trizol法提取细胞总RNA并反转录为cDNA,反转录反应条件为:50℃、15 min(反转录反应),85℃、5 s(反转录酶失活反应);根据SYBR荧光定量PCR反应体系进行PCR操作,反应参数:95℃30 s,95℃10 s,60℃30 s,40个循环。待反应结束后,通过ABI 7500荧光定量PCR仪进行数据处理。选择Homo的GAPDH为内参基因,依据实时定量PCR引物设计原则,根据Homo(NRF2,GST,SOD,CAT,GPX,GCL,NQO1,HO-1)的mRNA序列,用Primer Premier 5.0设计目标基因和内参基因的特异性引物,用Oligo 6.0检验其特异性。引物由上海博尚生物工程技术有限公司合成。引物序列为:GADPH F:5GGTGTGAACCATGAGAAGTATGA3,GADPH R:5GAGTCCTTCCACGATACCAAAG3;NRF2 F:5ATG CCACAGTCAACACAGATT3,NRF2 R:5GCCCATTTA GAAGTTCAGAGAGT3;GST F:5CAACGCCAAAGGT GAAGAAC3,GST R:5CGGTCAGAGCCAAATAACAT G3;SOD F:5ATTGCATCATTGGCCGCAC3,SOD R:5TCCCAATTACACCACAAGCCA3;CAT F:5TCTCA CCAAGGTTTGGCCTC3,CATR:5GCGGTGAGTGTCA GGATAGG3;GPXF:5AAGCTCATCACCTGGTCTCC3,GPX R:5CGATGTCAATGGTCTGGAAGC3;GCL F:5AGATTCCTGACCAGAACATTGATG3,GCL R:5CTG CTGTATTAAACCGTCCAACT3;NQO1 F:5GAAGAG CACTGATCGTACTGGC3,NQO1 R:5GGATACTGAAA GTTCGCAGG3;HO-1 F:5CTGCTGACCCATGACACC AA3,HO-1 R:5AGTGTAAGGACCCATCGGAGA3。
2.4 统计学方法 实验数据采用统计软件SPSS 24.0进行分析,定量资料数据属正态分布者以(±s)表示,非正态分布以中位数(四分位间距)即M(IQR)表示,多组定量资料数据均符合正态分布采用单因素方差分析,否则采用非参数检验。
3 结果
3.1 5组血管内皮细胞Keap1蛋白表达比较 见图1、表1。
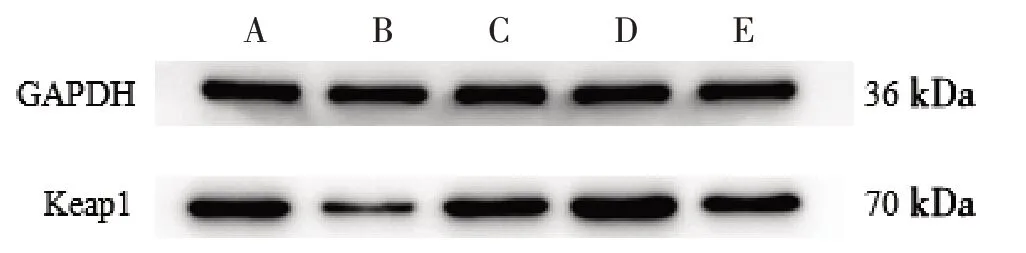
图1 5组血管内皮细胞Keap1蛋白电泳图
表1 5组血管内皮细胞Keap1蛋白表达比较[(±s或M(IQR),n=10)]
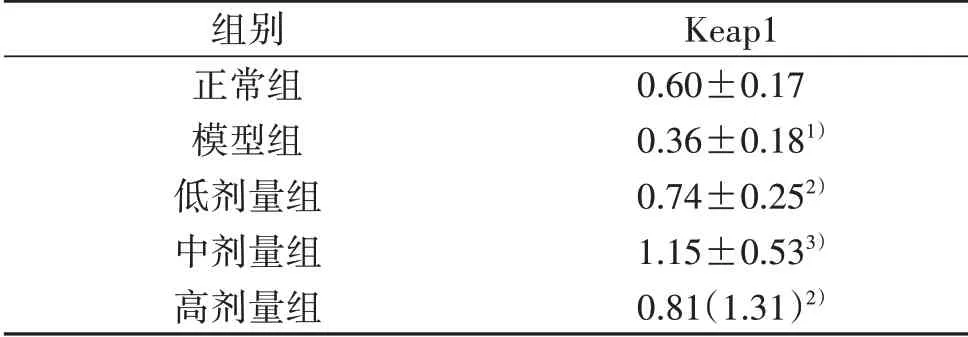
表1 5组血管内皮细胞Keap1蛋白表达比较[(±s或M(IQR),n=10)]
注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05,3)P<0.01。
组别正常组模型组低剂量组中剂量组高剂量组Keap1 0.60±0.17 0.36±0.181)0.74±0.252)1.15±0.533)0.81(1.31)2)
3.2 5组Nrf2、GST、SOD、CAT、GPx、GCL、NQO1、HO-1的mRNA表达比较 见表2。
表2 5组Nrf2、GST、SOD、CAT、GPx、GCL、NQO1、HO-1 mRNA表达比较[(±s或M(IQR),n=6)]
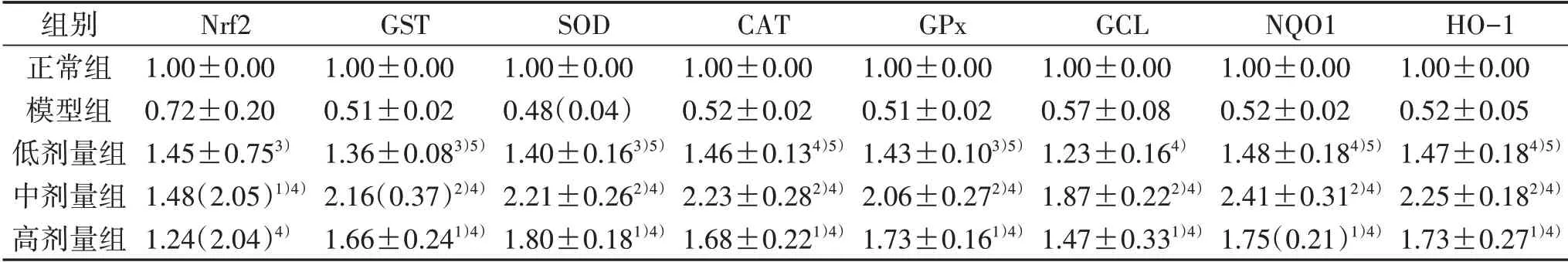
表2 5组Nrf2、GST、SOD、CAT、GPx、GCL、NQO1、HO-1 mRNA表达比较[(±s或M(IQR),n=6)]
注:与正常组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05,4)P<0.01;与中剂量组比较,5)P<0.05。
组别正常组模型组低剂量组中剂量组高剂量组Nrf2 1.00±0.00 0.72±0.20 1.45±0.753)1.48(2.05)1)4)1.24(2.04)4)GST 1.00±0.00 0.51±0.02 1.36±0.083)5)2.16(0.37)2)4)1.66±0.241)4)SOD 1.00±0.00 0.48(0.04)1.40±0.163)5)2.21±0.262)4)1.80±0.181)4)CAT 1.00±0.00 0.52±0.02 1.46±0.134)5)2.23±0.282)4)1.68±0.221)4)GPx 1.00±0.00 0.51±0.02 1.43±0.103)5)2.06±0.272)4)1.73±0.161)4)GCL 1.00±0.00 0.57±0.08 1.23±0.164)1.87±0.222)4)1.47±0.331)4)NQO1 1.00±0.00 0.52±0.02 1.48±0.184)5)2.41±0.312)4)1.75(0.21)1)4)HO-1 1.00±0.00 0.52±0.05 1.47±0.184)5)2.25±0.182)4)1.73±0.271)4)
4 讨论
国际糖尿病联盟预测2030年全球糖尿病患者人数将达5.52亿。如此大量的糖尿病患者不仅会使社会损失大量的劳动力,耗费大量财力和资源,而且严重影响经济和社会的发展。糖尿病及其并发症已成为严重危害人类健康的世界性公共卫生问题,其预防及治疗意义重大[1-2]。高血糖是诱发糖尿病患者血管内皮细胞损伤和功能紊乱的始动因素[3]。血管内皮损伤是高血糖和血管病变之间的连接枢纽[4]。糖尿病的血管并发症,包括大血管并发症如冠心病、脑卒中、外周大血管病变,微血管并发症如糖尿病肾病、糖尿病视网膜病变、糖尿病性心肌病等,在发病学上都与血管内皮细胞损伤有密切关系[5]。
氧化应激在糖尿病血管并发症中具有突出的意义。糖尿病导致慢性并发症的四条经典途径(蛋白质非酶促糖化途径、糖醇代谢紊乱途径、G蛋白激酶途径、果糖胺途径)最终都与氧化应激有关。无论是实验性还是临床性研究均表明:氧化应激在糖尿病及其血管并发症中起着至关重要的作用[6-8]。氧化应激产生的活性氧(reactive oxygen species,ROS)可促进细胞毒性的产生[9]。因此,抗氧化剂似乎是预防或治疗氧化损伤的一种有效方法。据报道,已有维生素E等外源性抗氧化剂被用于治疗人类心血管及肾脏疾病,虽然有些研究取得了一定的成果,但关于外源性抗氧化化合物对减少人类糖尿病并发症的研究多以失败而告终[10-11]。为此,发现并激活或上调内源性抗氧化剂的有效药物可能是预防或治疗糖尿病及其并发症更有效的方法。
近年来新发现的Keap1/Nrf2信号通路可清除细胞内产生的过量ROS,从而对抗细胞内的氧化损伤,在疾病预防和治疗中具有积极的意义。因此,Keap1/Nrf2被认为是机体内最重要的内源性抗氧化信号通路,也是近几年抗氧化研究领域的热点。正常机体暴露于活性氧刺激时,Keap1蛋白中的活性半胱氨酸残基结构被改变,导致Nrf2从Keap1/Nrf2复合体中解离或者诱导Keap1发生构象变化,使新合成的Nrf2免于被蛋白酶体降解,从而促进Nrf2由细胞质向细胞核的转移。在核内,Nrf2与其他的转录因子(如小的Maf蛋白)形成异二聚体,促进Nrf2结合到位于启动子区域的Nrf2靶基因(如顺式调节因子ARE或亲电子)反应元件上,增加第Ⅱ阶段解毒及抗氧化酶:GST、SOD、CAT、GPx、GCL、NQO1和HO-1等基因的表达[12-15]。Nrf2介导内源性抗氧化物表达被认为是机体防御糖尿病引起氧化应激损伤的重要机制[16],一定程度上,过量的ROS可能促进糖尿病及其相关疾病的发生。高糖状态下,细胞内的葡萄糖氧化增加,线粒体产生过多的超氧化物引起组织细胞氧化应激损伤,是引起糖尿病、胰岛素抵抗和血管并发症的重要原因。激活Keap1/Nrf2信号通路可减轻糖代谢异常引起的氧化应激损伤而发挥其保护功能。
中医药治疗糖尿病及其血管病变有独特的优势。祖国医学对消渴的认识和研究由来已久,已形成规范、成熟的理论并指导临床实践。消渴病的基本病机是阴虚为本、燥热为标。近年来,随着认识的深入,经过临床观察证实瘀血也是消渴的病机之一[17-18]。因此,阴虚血瘀是消渴全病程的重要病机。滋阴活血法在临床应用中取得了较好的临床效果,其相关作用机制值得研究并有益于指导临床。地红方由六味地黄汤、桃红四物汤化裁而来,滋阴活血之力强,可用于治疗阴虚血瘀型糖尿病。
本研究发现,糖尿病模型组Keap1蛋白表达较正常组明显下降(P<0.05),模型组Nrf2、GST、SOD、CAT、GPx、GCL、NQO1、HO-1的mRNA表达均较正常组有所下降;与模型组比较,低、中、高剂量组Keap1蛋白表达和Nrf2、GST、SOD、CAT、GPx、GCL、NQO1、HO-1的mRNA表达均明显升高(P<0.05或P<0.01),而且以中剂量地红方组最为突出,提示地红方可能通过调控Keap1/Nrf2信号通路治疗糖尿病血管内皮细胞氧化应激损伤。



