赵棋琴,陈进晓,沃 达,何 嘉,彭 军,3,朱伟东,任丹妮,3*
(1.福建中医药大学中西医结合研究院,福建福州 350122;2.福建中医药大学科技创新与转化中心,福建福州 350122;3.福建省中西医结合老年性疾病重点实验室,福建福州 350122)
癌症是全球主要死因之一[1],50%的晚期癌症患者都患有癌症恶病质[2],癌症恶病质是癌症患者死亡的主要原因[3]。骨骼肌萎缩是癌症恶病质最主要的临床表现,其与患者器官功能障碍、生活质量降低以及抗癌治疗的耐受性和疗效性降低相关[4]。目前缺乏治疗肌肉萎缩的有效药物,所以迫切需要研发新的药物[5]。炎症是骨骼肌萎缩的主要原因,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是重要的肌肉萎缩诱导因子[6],核因子κB(nuclear factor kappa-B,NF-κB)信号通路作为经典炎症信号通路,是炎症因子诱导肌肉萎缩的一个重要步骤[7-8],NF-κB 信号通路可被炎症因子TNF-α激活,导致肌肉蛋白降解主要信号通路——泛素蛋白酶体系统(ubiquitin-proteasome system,UPS)的关键组分泛素连接酶表达过度上调,最终使UPS 系统处于高度应激状态[9-10],肌肉蛋白降解增多[11]。萎缩相关基因1(atrophy gene 1,Atrogin-1)是一种泛素连接酶,在骨骼肌中特异性表达,其过度表达会导致肌肉蛋白降解增多[12-13]。八宝丹(Babaodan,BBD)为我国经典复方,临床实践证明BBD 作为多种晚期癌症辅助用药可提高患者生活质量,缓解化疗出现的不良反应[14],由此可见BBD 可以缓解晚期癌症患者出现的不良状态,但目前尚无BBD 治疗癌症恶病质肌肉萎缩的相关研究。故本课题拟通过体外实验探讨BBD 对TNF-α 诱导的NF-κB 信号通路及下游通路UPS 系统中Atrogin-1 表达的作用机制研究,为BBD 抑制肌蛋白降解相关通路提供了体外实验数据,也为治疗癌症恶病质提供新的治疗思路。
1 实验材料
1.1 实验细胞 C2C12 成肌细胞购于中国科学院细胞库(目录号:SCSP-505)。
1.2 实验药物 BBD 购自厦门中药厂股份有限公司(批号:190530)。
1.3 实验试剂 p-P65 抗体、p-IκB 抗体(美国CST公司,货号:3033T、2859S);GAPDH 抗体(美国Proteintech 公司,货号:60004-1-Ig);Atrogin-1 抗体(英国Abcam 公司,货号:ab168372);Goat-anti-Mouse-IgG、Goat-anti-Rabbit-IgG(美国Signaling Antibody公司,货号:L3032、L3012);DMEM 不完全高糖培养液(江苏凯基生物技术有限公司,货号:KGM12800 N-500);胎牛血清(PEAK Serum 公司,货号:S-FBSSA-015);青霉素和链霉素混合液、0.4%台盼蓝染液、NP-40 裂解液(北京索莱宝科技有限公司,货号:SV30010、C0040、N8032);1×PBS 缓冲液(南京维森特生物技术有限公司,货号:311-010-CL);0.25%胰蛋白酶(美国Gibco 公司,货号:25200072);BCA蛋白浓度测定试剂盒(武汉博士德生物工程有限公司,货号:AR0197);MTT 试剂盒(上海碧云天生物技术有限公司,货号:C0009S);蛋白酶抑制剂Cocktail、磷酸酶抑制剂Cocktail Ⅰ、磷酸酶抑制剂Cocktail Ⅱ(MCE公司,货号:HY-K0010,HY-K0021、HYK0022);SuperKineTM超敏型ECL 发光液(Abbkine 公司,货号:BMU102-CN);TNF-α 蛋白液(美国R&D Systems 公司,货号:410-MT)。
1.4 实验仪器 CO2培养箱(美国Thermo Fisher 公司);超净工作台(苏州净化设备公司);Countstar 全自动细胞计数仪(上海睿钰生物科技有限公司);倒置显微镜(德国Leica 公司);多功能酶标仪(美国Thermo Fisher 公司);干式恒温金属浴(上海培青科技有限公司);SDS-PAGE 电泳仪(美国Bio-Rad 公司);Trans-Blot 小型转膜槽转膜仪(美国Bio-Rad公司);旋转摇床(中国江苏其林贝尔仪器有限公司);超高灵敏化学发光系统(美国Bio-Rad 公司)。
2 方法与结果
2.1 BBD药液制备 称取25 mg BBD溶于1 mL PBS缓冲液,制备成25 mg/mL BBD 药液,储存于-20 ℃冰箱中。
2.2 细胞培养 将C2C12 成肌细胞培养于含10%胎牛血清、1%青霉素和链霉素混合液的DMEM 不完全高糖培养液中,置于37 ℃、5% CO2培养箱中培养,待细胞汇合度至70%~80%进行后续实验。
2.3 统计学方法 采用SPSS 26.0 统计软件进行数据分析。计量资料符合正态分布以(±s)表示,2 组比较采用独立样本t 检验。
2.4 MTT 法筛选BBD 干预细胞浓度 将C2C12 成肌细胞以3×103个/100 μL 的密度接种于96 孔板中,每孔100 μL,待各组细胞汇合度至70%~80%,弃上清液,分别予0、0.125、0.25、0.5、0.75、1 mg/mL BBD 药液干预48 h,每种浓度6 个复孔,48 h 后弃上清液,每孔加入浓度为0.5 mg/mL MTT 溶液100 μL,培养箱内继续孵育4 h,每孔再加入100 μL Formazan 溶解液,适当混匀,使用酶标仪在570 nm 处测吸光度,根据公式计算细胞活力。
MTT 法实验结果显示,不同浓度BBD 对C2C12成肌细胞活力无明显影响,差异无统计学意义(P>0.05),见图1。结合本课题组前期研究结果,最终选用0.75 mg/mL作为后续实验BBD的干预浓度[15]。
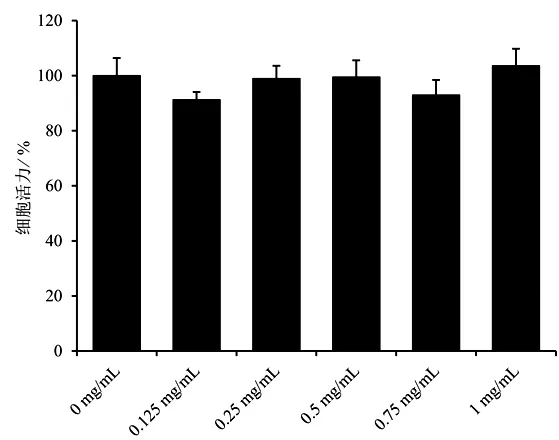
图1 不同浓度BBD 对C2C12 细胞活力的影响
2.5 筛选TNF-α 上调p-P65 蛋白表达的浓度和时间 按3×105个/mL 的细胞密度,将对数生长期C2C12 成肌细胞接种于35 mm2培养皿中,待细胞汇合度至70%~80%,分别加入0、1、10、50 ng/mL TNF-α 蛋白液干预C2C12 成肌细胞8 min。NP-40裂解液提取细胞总蛋白,BCA 蛋白定量试剂盒定量,细胞总蛋白中加入SDS-PAGE 蛋白上样缓冲液(还原性,5×),再将其置于100 ℃干式恒温金属浴变性。20~30 μL 蛋白样本经聚丙烯酰胺(SDSPAGE)凝胶电泳完全分离后,TBST 洗膜3 次,通过湿转法将蛋白转至PVDF 膜上,TBST 洗膜3 次,5%脱脂奶粉常温封闭1 h,TBST 洗膜,抗体p-P65(1∶1 000),GAPDH(1∶5 000)4 ℃孵育过夜,随后TBST洗膜3 次,加Goat-anti-Mouse-IgG 或Goat-anti-Rabbit-IgG(1∶5 000)室温孵育1 h,TBST 清洗3 次,使用SuperKine™超敏型ECL 发光液显色,将GAPDH作为总蛋白内参,运用Image J 软件分析各目的蛋白的灰度值,比较不同TNF-α 浓度对p-P65 蛋白相对表达量的影响,结果见图2。与0 ng/mL 比较,10、50 ng/mL TNF-α 分别刺激细胞后,p-P65 蛋白表达均明显上调(P<0.05),最终选取TNF-α 刺激浓度为10 ng/mL。
再筛选TNF-α 上调p-P65 蛋白表达的最佳时间,按3×105个/mL 的细胞密度,将对数生长期C2C12 成肌细胞接种于35 mm2培养皿中,10 ng/mL TNF-α 蛋白液分别在8 min、15 min、30 min、1 h 刺激细胞,提取细胞总蛋白及Western blot 法操作同前,结果见图3,10 ng/mL TNF-α 刺激细胞8 min 显着上调p-P65蛋白表达(P<0.05),最终选取10 ng/mL TNF-α 刺激细胞8 min 作为后续实验干预浓度和时间。
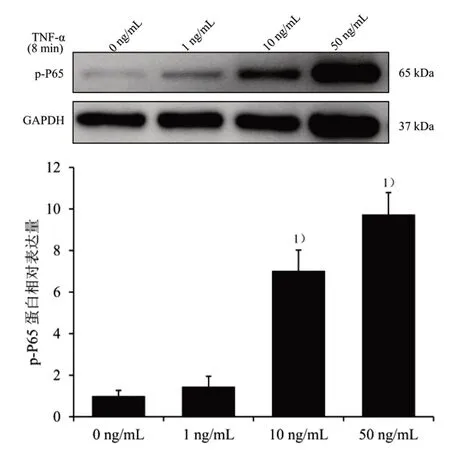
图2 不同TNF-α 浓度对p-P65 蛋白表达的影响
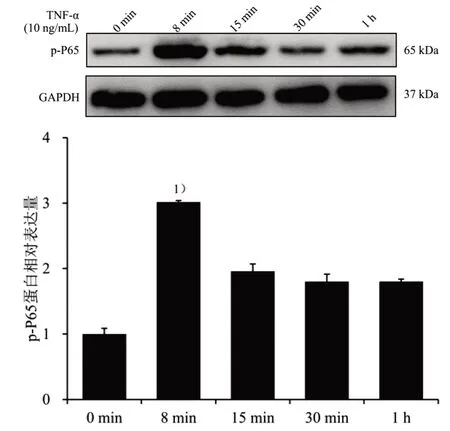
图3 不同TNF-α 刺激时间对p-P65 蛋白表达的影响
2.6 筛选TNF-α 上调Atrogin-1 蛋白表达的浓度和时间 Atrogin-1 为NF-κB 信号通路下游通路指标,对TNF-α 蛋白反应时间不同,因此再筛选TNF-α 上调Atrogin-1 蛋白表达的浓度和时间。取对数生长期C2C12 成肌细胞按3×105个/mL 的细胞密度接种于35 mm2培养皿中,待细胞汇合度至70%~80%,分别加入0、1、10、50 ng/mL TNF-α 蛋白液干预C2C12 成肌细胞4 h,Western blot 法步骤同前,Atrogin-1 和GAPDH 抗体稀释比例分别为1∶1 000 和1∶5 000,结果见图4。与0 ng/mL 比较,1、10、50 ng/mL TNF-α 刺激细胞后,Atrogin-1 蛋白表达明显上调(P<0.05),为与前刺激浓度一致,最终选取TNF-α 刺激浓度为10 ng/mL。
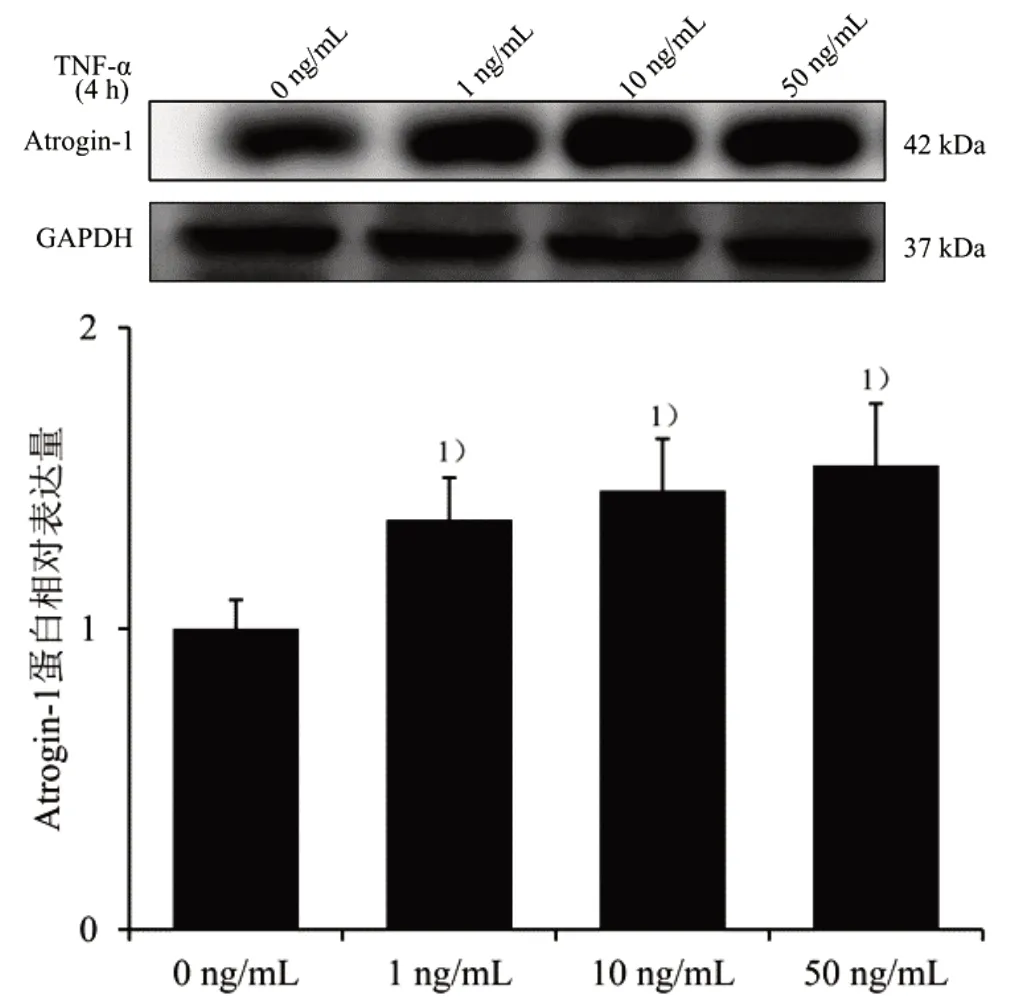
图4 不同TNF-α 浓度对Atrogin-1 蛋白表达的影响
再筛选TNF-α 上调Atrogin-1 蛋白表达的最佳时间,将对数生长期C2C12成肌细胞按3×105个/mL的细胞密度接种于35 mm2培养皿中,10 ng/mL TNF-α 蛋白液分别在8 min、15 min、30 min、1 h、4 h刺激细胞,Western blot 法操作同前,结果见图5。10 ng/mL TNF-α 刺激细胞4 h 显着上调Atrogin-1蛋白表达(P<0.05),最终选取10 ng/mL TNF-α 刺激细胞4 h作为后续实验干预浓度和时间。
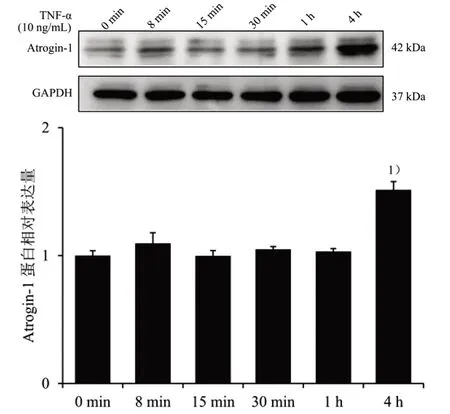
图5 不同TNF-α 刺激时间对Atrogin-1 蛋白表达的影响
2.7 BBD 对p-P65、Atrogin-1 蛋白表达的作用 按3×105个/mL 的细胞密度,取对数生长期C2C12 成肌细胞接种于35 mm2培养皿中,设置空白对照组,药物对照组、模型组、八宝丹组,待细胞汇合度达到70%~80%,药物对照组和八宝丹组加入0.75 mg/mL BBD 药液,同时空白对照组和模型组加入等体积PBS,预处理2 h。①模型组和八宝丹组加入10 ng/mL TNF-α 蛋白液,与此同时空白对照组和药物对照组加入等体积PBS,刺激细胞8 min 后,冰PBS 收取细胞,与上述提取细胞总蛋白及Western blot 法步骤一致,检测各组p-P65 蛋白表达;②模型组和八宝

图6 4 组C2C12 成肌细胞p-P65 蛋白表达比较
3 讨 论
肌肉萎缩是癌症恶病质患者死亡的预测因子[16],在癌症恶病质的动物模型中,肌肉萎缩得到改善的动物模型病死率降低[17],表明改善肌肉萎缩可能有助于提高恶病质患者生存率。成肌细胞是体外研究肌肉生长修复重要的细胞系,目前用于实验研究的成肌细胞主要是C2C12 成肌细胞[18]。因此本研究选用C2C12 成肌细胞作为研究对象。炎症是肌肉萎缩的常见触发因素,炎症因子是肌肉萎缩的有效诱导剂,TNF-α 已被证明对骨骼肌有分解代谢作用[19],主要是通过激活NF-κB 信号通路[7],TNF-α 通过结合并激活其同源受体TNF-αR后,促使IKKα 磷酸化IκBα 而被降解,NF-κB-IκB二聚体解离,NF-κB p65 亚单位上的S536 发生磷酸化,使得NF-κB 入核调控下游基因表达,从而导致丹组加入10 ng/mL TNF-α 蛋白液,同时空白对照组和药物对照组加入等体积PBS,刺激细胞4 h 后,冰PBS 收取细胞,与上述提取细胞总蛋白及Western blot 法步骤一致,检测各组Atrogin-1 蛋白表达。
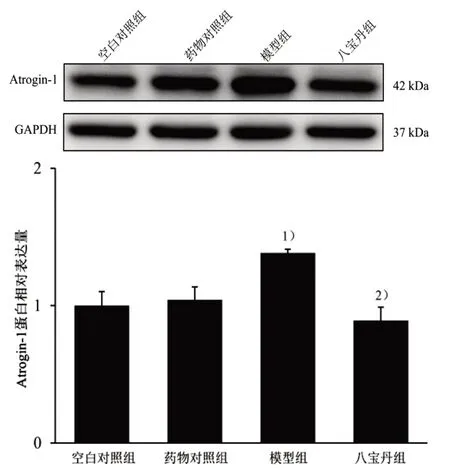
图7 4 组C2C12 成肌细胞Atrogin-1 蛋白表达比较
图6 结果显示,与空白对照组比较,模型组p-P65 蛋白表达显着上调(P<0.01),而与模型组比较,八宝丹组p-P65 蛋白表达显着下调(P<0.01)。图7 结果显示,与空白对照组比较,模型组Atrogin-1蛋白表达显着上调(P<0.05),而与模型组比较,八宝丹组Atrogin-1 蛋白表达显着下调(P<0.05)。UPS 中泛素连接酶如Atrogin-1 过度上调,肌肉蛋白质降解增多[9]。故选取TNF-α 蛋白液刺激C2C12成肌细胞模拟体内炎症引起的肌肉萎缩模型,因p-P65 及下游通路指标Atrogin-1 在不同时间点对TNF-α 反应时间不一致,故分别筛选TNF-α 上调p-P65、Atrogin-1 表达的最佳浓度和时间。结果表明10 ng/mL TNF-α 刺激细胞8 min 显着上调p-P65蛋白表达,而10 ng/mL TNF-α 刺激细胞4 h 显着上调Atrogin-1 蛋白表达。
癌症恶病质归为中医“虚劳”范畴[20],治疗原则为扶正固本、化痰祛湿、活血化瘀解毒以助癌毒消散[21]。BBD 由牛黄、蛇胆、羚羊角、麝香、珍珠、三七和两种保密药物组成,功效为清利湿热、活血解毒、通经止痛,其功效基本符合中医对癌症恶病质的治疗原则[14]。本研究发现,BBD 可抑制TNF-α诱导的NF-κB 信号通路中NF-κB 的磷酸化水平及下游通路Atrogin-1 蛋白表达,表明BBD 可能通过抑制NF-κB 通路的激活进而削弱UPS 系统的活性,减少肌肉蛋白降解量。本研究为有效防治癌症恶病质肌肉萎缩提供了研究基础,但BBD 对癌症恶病质肌肉萎缩动物模型的作用有待进一步研究探讨。



